Резюме
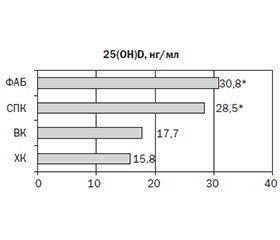
Актуальність. Запальні захворювання кишечника (ЗЗК) частіше розвиваються в дитячому віці, тривають упродовж усього життя, і частота їх стрімко зростає в індустріально розвинених країнах. Більшість дослідників визначають вітамін D (VD) як ключовий регулятор шлунково-кишкового гомеостазу і вродженої імунної відповіді та біомаркер активності й тяжкості перебігу ЗЗК. Мета: визначити частоту виникнення дефіциту вітаміну D та його зв’язок із перебігом запальних захворювань кишечника у дітей. Матеріали та методи. У дослідження включено 36 дітей: 13 дітей із ЗЗК (основна група) та 23 дитини групи порівняння із синдромом подразненого кишечника (СПК) та функціональним абдомінальним болем (ФАБ). Середній вік дітей становив 13,09 ± 2,28, медіана — 14,5 року; 63,6 % були хлопчики. Пацієнтів із ЗЗК оцінювали щодо клінічних проявів захворювання, локалізації захворювання (Паризька класифікація) та активності захворювання (PCDAI/PUCAI). СПК та ФАБ були діагностовані на основі Римських критеріїв IV. Сироватковий 25-гідроксивітамін D (25(OH)D) оцінювали електрохемілюмінесцентним методом (Elecsys Vitamin D total, Cobas). Результати. Серед обстежених дітей переважав тяжкий перебіг ЗЗК (61,5 %). Вірогідної різниці в показниках маси тіла та зросту в цілому між групами не спостерігалося, що може бути пов’язано із невеликою тривалістю ЗЗК, однак у дітей із ЗЗК відзначалася тенденція до зниження показників фізичного розвитку. Серед досліджуваних груп спостерігалися значні відмінності в показниках гемоглобіну, ШОЕ, С-реактивного протеїну, кількості тромбоцитів, фекального кальпротектину (p < 0,05). Концентрація VD у крові обстежених дітей коливалася від 39,9 до 10,8 нг/мл, при середньому показнику 21,8 ± 5,8 нг/мл. У 76,9 % дітей із ЗЗК концентрація VD у крові була зниженою, тоді як серед дітей групи порівняння тільки у 21,7 % його рівень був нижчим за норму. Діти, хворі на ЗЗК, характеризувалися вірогідно нижчими показниками концентрації VD у крові (середній показник 16,7 нг/мл). Нижчі рівні VD були пов’язані з жіночою статтю, ХК та ВК, а також із тривалістю хвороби більше ніж 3 роки та її тяжкістю. Виявлено зворотну кореляцію VD зі ступенем активності ЗЗК (ХК: r = –0,33; p = 0,01, та ВК: r = –0,38; р = 0,01) і тяжкістю перебігу (ХК: r = –0,35; p = 0,01, та ВК: r = –0,36; р = 0,01), показником С-реактивного протеїну (ХК: r = –0,39; p = 0,01, та ВК: r = –0,37; р = 0,01), рівнем фекального кальпротектину (ХК: r = –0,42; p = 0,01, та ВК: r = –0,46; р = 0,01). Висновки. У більшості дітей (76,9 %), хворих на запальні захворювання кишечника, концентрація VD у крові є вірогідно нижчою щодо такої в дітей із функціональними захворюваннями шлунково-кишкового тракту. Нижчі рівні вітаміну D були пов’язані з жіночою статтю, хворобою Крона та виразковим колітом, а також із тривалістю хвороби більше ніж 3 роки, ступенем активності та тяжким перебігом, що підтверджує роль вітаміну D як можливого предиктора тяжкості перебігу цих захворювань у дитячому віці.
Background. Inflammatory bowel diseases (IBD) develop in childhood more often, last throughout life, and their frequency is rapidly increasing in industrialized countries. Most researchers identify vitamin D (VD) as a key regulator of gastrointestinal homeostasis, an innate immune response and a biomarker for the activity and severity of IBD. The purpose was to determine the frequency of vitamin D deficiency and its relationship with the course of inflammatory bowel diseases in children. Materials and methods. The study included 36 patients: 13 with IBD (main group) and 23 children of the comparison group with irritable bowel syndrome and functional abdominal pain. The average age of children was 13.09 ± 2.28 years, with a median of 14.5 years; 63.6 % were boys. Patients with IBD were evaluated for clinical disease manifestations, disease localization (Paris Classification) and disease activity (PCDAI/PUCAI). Irritable bowel syndrome and functional abdominal pain were diagnosed based on the Rome IV Criteria. Serum 25-hydroxyvitamin D (25(OH)D) was assessed by the electrochemiluminescence method (Elecsys Vitamin D total, Cobas). Results. Severe IBD prevailed among the examined children (61.5 %). There was no significant difference in overall body weight and height between the groups, which may be due to the short duration of IBD. However, children with IBD showed a tendency to lower physical development indicators. Significant differences in hemoglobin, erythrocyte sedimentation rate, C-reactive protein, number of platelets, fecal calprotectin were observed among the studied groups (p < 0.05). The concentration of VD in the blood of the examined children ranged from 39.9 to 10.8 ng/ml, with an average of 21.8 ± 5.8 ng/ml. In 76.9 % of patients with IBD, blood concentration of VD reduced, while only 21.7 % children in the comparison group had its level below the norm. Children with IBD were characterized by significantly lower levels of VD in the blood (average of 16.7 ng/ml). Lower levels of VD were associated with female sex, Chron’s disease (CD) and ulcerative colitis (UC), as well as disease duration of more than 3 years and disease severity. There was an inverse correlation between VD and the degree of IBD activity (CD: r = –0.33; p = 0.01; UC: r = –0.38; p = 0.01) and the severity of the course (CD: r = –0.35; p = 0.01; UC: r = –0.36; p = 0.01), the levels of C-reactive protein (CD: r = –0.39; p = 0.01; UC: r = –0.37; p = 0.01) and fecal calprotectin (CD: r = –0.42; p = 0.01; UC: r = –0.46; p = 0.01). Conclusions. In most children (76.9 %) with inflammatory bowel diseases, the concentration of VD in the blood is significantly lower than in those with functional gastrointestinal disorders. Lower vitamin D levels were associated with female sex, Crohn’s disease, and ulcerative colitis, as well as disease duration of more than 3 years, activity level, and severity, supporting the role of vitamin D as a possible predictor of severity of these diseases in childhood.
Список литературы
1. Охотнікова О.М., Ткачова Т.М., Романчук А.А., Грищенко О.М., Семененко Л.В. Сучасні підходи до лікування запальних захворювань кишечника у дітей згідно з останніми рекомендаціями Європейської організації з вивчення хвороби Крона та коліту та Європейського товариства дитячих гастроентерологів, гепатологів і дієтологів. Сучасна педіатрія. Україна. 2021. 2(114). 40-57. doi: 10.15574/SP.2021.114.40.
2. Cantoro L., Monterubbianesi R., Falasco G. [et al.]. The Earlier You Find, the Better You Treat: Red Flags for Early Diagnosis of Inflammatory Bowel Disease. Diagnostics (Basel). 2023. 13(20). 3183. doi: 10.3390/diagnostics13203183.
3. Pivac I. et al. Characteristics of the Inflammatory Bowel Disease in Children: A Croatian Single-Centre Retrospective Study. Children (Basel). 2023. 10(10). 1677. doi: 10.3390/children10101677.
4. Kuenzig M.E., Benchimol E.I., Lee L. [et al.]. The Impact of Inflammatory Bowel Disease in Canada 2018: Direct Costs and Health Services Utilization. J. Can. Assoc. Gastroenterol. 2019. 2(Suppl. 1). S17-S33. doi: 10.1093/jcag/gwy055.
5. Kuenzig M.E., Coward S., Targownik L.E. [et al.]. The 2023 Impact of Inflammatory Bowel Disease in Canada: Direct Health System and Medication Costs. J. Can. Assoc. Gastroenterol. 2023. 6(Suppl. 2). S23-S34. doi: 10.1093/jcag/gwad008.
6. Phoebe H., Paul K. Inflammatory bowel disease in Africa: what is the current state of knowledge? International Health. 2020. 2 (3). 222-230. doi.org/10.1093/inthealth / ihaa005.
7. Park J., Cheon J.H. Incidence and Prevalence of Inflammatory Bowel Disease across Asia. Yonsei Med. J. 2021. 62(2). 99-108. doi: 10.3349/ymj.2021.62.2.99.
8. Guan Q. A Comprehensive Review and Update on the Pathogenesis of Inflammatory Bowel Disease. J. Immunol. Res. 2019. 2019. 7247238. doi: 10.1155/2019/7247238.
9. Cantoro L., Monterubbianesi R., Falasco G. [et al.]. The Earlier You Find, the Better You Treat: Red Flags for Early Diagnosis of Inflammatory Bowel Disease. Diagnostics (Basel). 2023. 13(20). 3183. doi: 10.3390/diagnostics13203183.
10. Zangara M.T., Bhesania N., Liu W., Cresci G.A.M., Kurowski J.A., McDonald C. Impact of Diet on Inflammatory Bowel Disease Symptoms: An Adolescent Viewpoint. Crohns Colitis 360. 2020. 2(4). otaa084. doi: 10.1093/crocol/otaa084.
11. Caliendo G., D’Elia G., Makker J. [et al.]. Biological, genetic and epigenetic markers in ulcerative colitis. Adv. Med. Sci. 2023. 68(2). 386-395. doi: 10.1016/j.advms.2023.09.010.
12. Murthy S.K., Begum J., Benchimol E.I. [et al.]. Introduction of anti-TNF therapy has not yielded expected declines in hospitalisation and intestinal resection rates in inflammatory bowel diseases: a population-based interrupted time series study. Gut. 2020. 69(2). 274-282. doi: 10.1136/gutjnl-2019-318440.
13. Hodson R. Inflammatory bowel disease. Nature. 2016. 540(7634). S97. doi: 10.1038/540S97a.
14. Conrad M.A., Rosh J.R. Pediatric Inflammatory Bowel Di–sease. Pediatr. Clin. North. Am. 2017. 64(3). 577-591. doi: 10.1016/j.pcl.2017.01.005.
15. Dovrolis N., Moschoviti A., Fessatou S., Karamanolis G., Kolios G., Gazouli M. Identifying Microbiome Dynamics in Pediatric IBD: More than a Family Matter. Biomedicines. 2023. 11(7). 1979. doi: 10.3390/biomedicines11071979.
16. Miele E., Shamir R., Aloi M. [et al.]. Nutrition in Pediatric Inflammatory Bowel Disease: A Position Paper on Behalf of the Porto Inflammatory Bowel Disease Group of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J. Pediatr. Gastroenterol. Nutr. 2018. 66(4). 687-708. doi: 10.1097/MPG.0000000000001896.
17. Infantino C., Francavilla R., Vella A. [et al.]. Role of Vitamin D in Celiac Disease and Inflammatory Bowel Diseases. Nutrients. 2022. 14(23). 5154. doi: 10.3390/nu14235154.
18. Barbalho S.M., Bechara M.D., de Alvares Goulart R. [et al.]. Reflections About Inflammatory Bowel Disease and Vitamins A and D. J. Med. Food. 2016. 19(12). 1105-1110. doi: 10.1089/jmf.2016.0101.
19. Li P., Wang Y., Li P. [et al.]. Maternal vitamin D deficiency aggravates the dysbiosis of gut microbiota by affecting intestinal barrier function and inflammation in obese male offspring mice. Nutrition. 2023. 105. 111837. doi: 10.1016/j.nut.2022.111837.
20. Nielsen O.H., Rejnmark L., Moss A.C. Role of Vitamin D in the Natural History of Inflammatory Bowel Disease. Journal of Crohn’s and Colitis. 2018. 12(6). 742-752. doi: org/10.1093/ecco-jcc/jjy025.
21. Ricciuto A., Aardoom M., Orlanski-Meyer E. [et al.]. Predicting Outcomes in Pediatric Crohn’s Disease for Management Optimization: Systematic Review and Consensus Statements from the Pediatric Inflammatory Bowel Disease-Ahead Program. Gastroenterology. 2021. 160(1). 403-436.e26. doi: 10.1053/j.gastro.2020.07.065.
22. Zheng Y., Li J.H., Liao S.Y. [et al.]. Joint Detection of Serum Vitamin D, Body Mass Index, and Tumor Necrosis Factor Alpha for the Diagnosis of Crohn’s Disease. Curr. Med. Sci. 2023. 43(3). 496-504. doi: 10.1007/s11596–023-2741-6.
23. Chen D., Li J., Zhang X.Y. [et al.]. Zhonghua Yi Xue Za Zhi. 2020. 100(10). 757-762. doi: 10.3760/cma.j.cn112137-20190917–02050.
24. Ye Y.L., Yin J., Hu T., Zhang L.P., Wu L.Y., Pang Z. Increased circulating circular RNA_103516 is a novel biomarker for inflammatory bowel disease in adult patients. World J. Gastroenterol. 2019. 25(41). 6273-6288. doi: 10.3748/wjg.v25.i41.6273.
25. van Rheenen P.F., Aloi M., Assa A. [et al.]. Medical management of pediatric Crohn’s disease: ECCO-ESPGHAN guidelines update. J. Crohn’s Colitis. 2021. 171-194.
26. Levine A., Koletzko S., Turner D. [et al.]. ESPGHAN revised porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J. Pediatr. Gastroenterol. Nutr. 2014. 58(6). 795-806. doi: 10.1097/MPG.0000000000000239.
27. Drossman D.A. Functional gastrointestinal disorders: history, pathophysiology, clinical features and Rome IV. Gastroenterology. 2016. 150. 1262-1279.e2.
28. Zhan Y., Jin Q., Yousif T.Y.E., Soni M., Ren Y., Liu S. Predicting pediatric Crohn’s disease based on six mRNA-constructed risk signature using comprehensive bioinformatic approaches. Open Life Sci. 2023. 18(1). 20220731. doi: 10.1515/biol-2022–0731.
29. Wallace C., Gordon M., Sinopoulou V., Limketkai B.N. Vitamin D for the treatment of inflammatory bowel disease. Cochrane Database Syst. Rev. 2023. 10(10). CD011806. doi: 10.1002/14651858.CD011806.pub2.
30. El Amrousy D., El Ashry H., Hodeib H., Hassan S. Vitamin D in Children with Inflammatory Bowel Disease: A Randomized Controlled Clinical Trial. J. Clin. Gastroenterol. 2021. 55(9). 815-820. doi: 10.1097/MCG.0000000000001443.
31. Sun Y.H., Tian D.D., Zhou J.M., Ye Q. Association between vitamin D level and pediatric inflammatory bowel disease: A systematic review and meta-analysis. Front. Pediatr. 2023. 11. 1155004. doi: 10.3389/fped.2023.1155004.
32. Jørgensen S.P., Hvas C.L., Agnholt J., Christensen L.A., Heicken–dorff L., Dahlerup J.F. Active Crohn’s disease is associated with low vitamin D levels. J. Crohns Colitis. 2013. 7(10). e407-e413. doi: 10.1016/j.crohns.2013.01.012.
33. Montoro-Huguet M.A., Belloc B., Domínguez-Cajal M. Small and Large Intestine (I): Malabsorption of Nutrients. Nutrients. 2021. 13(4). 1254. doi: 10.3390/nu13041254.
34. Infantino C., Francavilla R., Vella A. [et al.]. Role of Vitamin D in Celiac Disease and Inflammatory Bowel Diseases. Nutrients. 2022. 14(23). 5154. doi: 10.3390/nu14235154.
35. Goulart R.A., Barbalho S.M. Can vitamin D induce remission in patients with inflammatory bowel disease? Ann. Gastroenterol. 2022. 35(2). 140-149. doi: 10.20524/aog.2022.0692.
36. Wu Z., Liu D., Deng F. The Role of Vitamin D in Immune System and Inflammatory Bowel Disease. J. Inflamm. Res. 2022. 15. 3167-3185. doi: 10.2147/JIR.S363840.
37. Sharifi A., Vahedi H., Nedjat S., Rafiei H., Hosseinzadeh-Attar M.J. Effect of single-dose injection of vitamin D on immune cytokines in ulcerative colitis patients: a randomized placebo-controlled trial. APMIS. 2019. 127(10). 681-687. doi: 10.1111/apm.12982.
38. Bendix M., Dige A., Jørgensen S.P., et al. Decrease in Mucosal IL17A, IFNγ and IL10 Expressions in Active Crohn’s Disease Patients Treated with High-Dose Vitamin Alone or Combined with Infliximab. Nutrients. 2020. 12(12). 3699. doi: 10.3390/nu12123699.