Международный эндокринологический журнал Том 19, №8, 2023
Вернуться к номеру
Вміст та ультраструктура природних клітин-кілерів у крові пацієнтів із вперше виявленим цукровим діабетом 2-го типу
Авторы: V.V. Popova, K.P. Zak, M.D. Tronko
State Institution “V.P. Komisarenko Institute of Endocrinology and Metabolism of the National Academy of Medical Sciences of Ukraine”, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
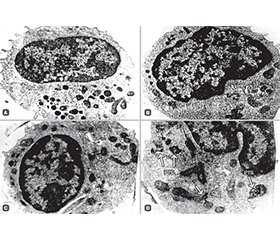
Актуальність. У хворих із вперше виявленим цукровим діабетом 2-го типу (ЦД2) спостерігається невелике, але статистично вірогідне зниження абсолютного числа природних клітин-кілерів (СD56+) у периферичній крові (ПК), особливо виражене при супутньому ожирінні. У зв’язку з вищевикладеним метою дослідження було подальше вивчення ролі NK-клітин у пацієнтів із вперше виявленим ЦД2, у тому числі ускладненим ожирінням. Для цього використовували комбінацію методів проточної цитометрії зі скануючою та трансмісійною електронною мікроскопією для визначення кількості та функції CD56+ клітин у ПК хворих із ЦД2. Матеріали та методи. Обстежено 144 особи обох статей із вперше виявленим ЦД2 віком 40–70 років, які не мали інших гострих та хронічних захворювань і раніше не приймали гіпоглікемічних препаратів. Контрольну групу становили 50 здорових людей із нормоглікемією віком 40–65 років, які не хворіли на COVID-19. Результати. Наші дослідження встановили, що в нелікованих пацієнтів із вперше діагностованим ЦД2 порівняно зі здоровими особами спостерігається дуже невелике статистично значуще зниження абсолютної кількості клітин CD56+ у ПК. При поєднанні проточної цитометрії (FACS методом) і супутніх трансмісійної та скануючої електронної мікроскопії у хворих на ЦД2 було виявлено значні зміни в ультраструктурі СD56+ клітин. Це вказує на зниження їхньої функції, а саме збільшення кількості клітин із більш гладенькою поверхнею клітинної мембрани, різке зменшення кількості азурофільних гранул у цитоплазмі, які вважаються основним продуцентом цитокінів і перфоринів, появу паралельно-трубчастих структур, біомаркерів зниження функцій клітин, порушення структури апарату Гольджі, гранулярного ендоплазматичного ретикулума та ін. Отримані дані свідчать про те, що у хворих на ЦД2, особливо на початковій стадії розвитку, спостерігається виражене послаблення функції NК-клітин, а отже, природного імунного захисту організму, й пояснюють підвищену схильність пацієнтів із діабетом до захворювання на різні віруси та інфекції, у тому числі COVID-19, а також тяжчий клінічний перебіг й підвищену смертність. Висновки. Проведені дослідження показують, що у хворих на початковій стадії ЦД2 спостерігається різке порушення субмікроскопічної організації CD56+ — найважливішого клітинного елемента природного імунітету, що свідчить про ослаблення функції природного імунного захисту. Це основна причина підвищеної чутливості хворих на діабет до інфікування різними патогенами, включаючи вірус SARS-CoV-2, а також більш тяжкого клінічного перебігу та підвищення рівня смертності.
Background. In patients with newly diagnosed type 2 diabetes mellitus (T2DM), a small but statistically significant decrease in absolute number of natural killer (NK) cells (CD56+) in the peripheral blood (PB) was found, especially pronounced with concomitant obesity. In connection with the above, one of the main aims of the present report was to further study the role of NK cells in patients with newly diagnosed T2DM, including those with obesity. For this purpose, a combination of flow cytometry methods with scanning and transmission electron microscopy was used to determine the number and function of CD56+ cells in the PB of patients with T2DM. Materials and methods. We examined 144 patients of both sexes with newly diagnosed T2DM aged 40–70 years who had no other acute or chronic diseases and had not previously taken any hypoglycemic drugs. The control group consisted of 50 healthy individuals with normoglycemia aged 40–65 years who had not COVID-19 disease. Results. Our studies have found that in untreated patients with newly diagnosed T2DM compared to healthy controls, there is a very small statistically significant decrease in the absolute number of CD56+ cells in the PB. When combining flow cytometry (FACS method), transmission and scanning electron microscopy in patients with T2DM, a significant change in the ultrastructure of CD56+ cells was revealed, indicating a decrease in their function (an increase in the number of cells with a smoother surface of the cell membrane, a sharp decrease in the number of azurophilic granules in the cytoplasm considered the main producer of cytokines and perforins, the appearance of parallel tubular structures, biomarkers of decreased cell function, a disruption of the Golgi apparatus structure, granular endoplasmic reticulum, etc.). The data obtained indicate that at the initial stage of T2DM development in humans, there is a pronounced weakening in the function of NK cells and, consequently, the natural immune defense of the body and explain the increased susceptibility of diabetics to various viruses and infections, including COVID-19, and also more severe clinical course and increased mortality. Conclusions. The conducted studies show that in patients with T2DM who are at the initial stage of T2DM, there is a sharp disturbance in the submicroscopic organization of CD56+ cells, the most important cellular element of natural immunity, which suggests a weakening of the function of natural immune defense. It is the main cause of increased sensitivity of diabetic patients to infection with various pathogens, including the SARS-CoV-2, as well as more severe clinical course and increased mortality rate.
цукровий діабет 2-го типу; ожиріння; вірусні захворювання; COVID-19; NК-клітини, що експресують CD56 антиген; цитокіни
type 2 diabetes mellitus; obesity; viral diseases; COVID-19; NK cells expressing CD56 antigen; cytokines
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Herberman R.B. Immunoregulation and natural killer cells. Mol. Immunol. 1982 Oct. 19(10). 1313-21. doi: 10.1016/0161-5890(82)90299-1.
- Zak K.P., Kindzel’skiy L.P., Butenko A.K. Large granular lymphocytes in pathology. Kyiv: Naukova Dumka, 1992. 164 p.
- Timonen T., Ortaldo J.R., Herberman R.B. Analysis by a single cell cytotoxicity assay of natural killer (NK) cells frequencies among human large granular lymphocytes and of the effects of interferon on their activity. J. Immunol. 1982 Jun. 128(6). 2514-21.
- Cooper M.A., Fehniger T.A., Caligiuri M.A. The biology of human natural killer-cell subsets. Trends Immunol. 2001 Nov. 22(11). 633-40. doi: 10.1016/s1471-4906(01)02060-9.
- Wang H., Cao K., Liu S., Xu Y., Tang L. Tim-3 expression causes NK cell dysfunction in type 2 diabetes patients. Front. Immunol. 2022 Apr 5. 13. 852436. doi: 10.3389/fimmu.2022.852436.
- Donath M.Y. Targeting inflammation in the treatment of type 2 diabetes: time to start. Nat. Rev. Drug Discov. 2014 Jun. 13(6). 465-76. doi: 10.1038/nrd4275.
- Donath M.Y. Multiple benefits of targeting inflammation in the treatment of type 2 diabetes. Diabetologia. 2016 Apr. 59(4). 679-82. doi: 10.1007/s00125-016-3873-z.
- Roden M., Shulman G.I. The integrative biology of type 2 diabetes. Nature. 2019 Dec. 576(7785). 51-60. doi: 10.1038/s41586-019-1797-8.
- IDF Diabetes Atlas, 10th edition, 2021.
- Hussain M.J., Alviggi L., Millward B.A., Leslie R.D.G., Pyke D.A., Vergani D. Evidence that the reduced number on natural killer cells in type 1 (insulin-dependent) diabetes may be genetically determined. Diabetologia. 1987. 30(12). 907-11.
- Mxinwa V., Dludla P.V., Nyambuya T.M., Mokgalaboni K., Mazibuko-Mbeje S.E., Nkambule B.B. Natural killer cell levels in adults living with type 2 diabetes: a systematic review and meta-ana–lysis of clinical studies. BMC Immunol. 2020 Sep 9. 21(1). 51. doi: 10.1186/s12865-020-00378-5.
- Senel S., Sahin I., Kaya E. et al. The effect of glycemic control on lymphocyte neural cell adhesion molecule (CD56) expression in patients with type 2 diabetes mellitus. Diabetologia. 2005. 48(Suppl. 1). A-195.
- Allahyani M., Alshalawi A.M., Alshalawii M.R., Alqorashi S.A., Aljuaid A., Almehmadi M.M. et al. Phenotypical evaluation of lymphocytes and monocytes in patients with type 2 diabetes mellitus in Saudi Arabia. Saudi Med. J. 2023 Mar. 44(3). 296-305. doi: 10.15537/smj.2023.44.3.20220873.
- Michailidou Z., Gomez-Salazar M., Alexaki V.I. Innate immune cells in the adipose tissue in health and metabolic disease. J. Innate Immun. 2022. 14(1). 4-30. doi: 10.1159/000515117.
- Bähr I., Spielmann J., Quandt D., Kielstein H. Obesity-associated alterations of natural killer cells and immunosurveillance of cancer. Front. Immunol. 2020 Mar 13. 11. 245. doi: 10.3389/fimmu.2020.00245.
- Kumar S., Wilson B., Watson L., Alsop J. Obesity is associated with poorer clinical outcomes following insulin initiation for patients with type 2 diabetes. Diabetologia. 2009. 52(Suppl. 1).
- Tronko N.D., Zak K.P. Obesity and diabetes. Likars’ka sprava. 2013. 8(1125). 3-21.
- Kim J.H., Park K., Lee S.B., Kang S., Park J.S., Ahn C.W., Nam J.S. Relationship between natural killer cell activity and glucose control in patients with type 2 diabetes and prediabetes. J. Diabetes Investig. 2019 Sep. 10(5). 1223-8. doi: 10.1111/jdi.13002.
- Tate J., Knuiman M., Davis W.A., Davis T.M.E., Bruce D.G. A comparison of obesity indices in relation to mortality in type 2 diabetes: the Fremantle Diabetes Study. Diabetologia. 2020 Mar. 63(3). 528-36. doi: 10.1007/s00125-019-05057-8.
- Hotamisligil G.S. Inflammation and metabolic disorders. Nature. 2006. 444(7121). 860-7.
- Lynch L.A., O’Connell J.M., Kwasnik A.K., Cawood T.J., O’Farrelly C., O’Shea D.B. Are natural killer cells protecting the meta–bolically healthy obese patient? Obesity (Silver Spring). 2009 Mar. 17(3). 601-5. doi: 10.1038/oby.2008.565.
- O’Shea D., Cawood T.J., O’Farrelly C., Lynch L. Natural killer cells in obesity: impaired function and increased susceptibility to the effects of cigarette smoke. PLoS One. 2010 Jan 25. 5(1). e8660. doi: 10.1371/journal.pone.0008660.
- Lautenbach A., Breitmeier D., Kuhlmann S., Nave H. Human obesity reduces the number of hepatic leptin receptor (ob-R) expressing NK cells. Endocr. Res. 2011. 36(4). 158-66. doi: 10.3109/07435800.2011.580442.
- Nieman D.C., Henson D.A., Nehlsen-Cannarella S.L., Ekkens M., Utter A.C., Butterworth D.E., Fagoaga O.R. Influence of obesity on immune function. J. Am. Diet. Assoc. 1999 Mar. 99(3). 294-9. doi: 10.1016/S0002-8223(99)00077-2.
- Laue T., Wrann C.D., Hoffmann-Castendiek B., Pietsch D., Hübner L., Kielstein H. Altered NK cell function in obese healthy humans. BMC Obes. 2015 Jan 24. 2. 1. doi: 10.1186/s40608-014-0033-1.
- Romero V., Zúñiga J., Azocar J., Clavijo O.P., Terreros D., Kidwai H. et al. Genetic interactions of KIR and G1M immunoglo–bulin allotypes differ in obese from non-obese individuals with type 2 diabetes. Mol. Immunol. 2008 Aug. 45(14). 3857-62. doi: 10.1016/j.molimm.2008.06.004.
- Guo H., Xu B., Gao L., Sun X., Qu X., Li X. et al. High frequency of activated natural killer and natural killer T-cells in patients with new onset of type 2 diabetes mellitus. Exp. Biol. Med. (Maywood). 2012 May. 237(5). 556-62. doi: 10.1258/ebm.2012. 011272.
- Zak K.P., Popova V.V. Immune intervention in the treatment of diabetes mellitus (analytical review). Diabet. Ozhireniye. Metabo–licheskiy sindrom. 2015. 6(IV). 31-44.
- Rudenko L.N. Ultrastructure of the surface of T-lymphocytes in the blood of patients with diabetes mellitus. DAN Ukrainskoy SSR. Seriya B. 1983. (8). 68-71.
- Yoon Kim D., Kwon Lee J. Type 1 and 2 diabetes are associated with reduced natural killer cell cytotoxicity. Cell. Immunol. 2022 Sep. 379. 104578. doi: 10.1016/j.cellimm.2022.104578.
- Prager I., Liesche C., van Ooijen H., Urlaub D., Verron Q., Sandström N. et al. NK cells switch from granzyme B to death receptor-mediated cytotoxicity during serial killing. J. Exp. Med. 2019 Sep 2. 216(9). 2113-27. doi: 10.1084/jem.20181454.
- Tanaka Y., Goodman J.R. Electron microscopy of human blood cells. New York: Harper & Row; 1972.
- Smit J.M., Rumke H., Halie M.R. Lymphocytes with parallel tubular structures. Morphology, function and induction. Brit. J. Haematol. 1982. 50(4). 696-7.
- Chan W.C., Link S., Mawle A., Check I., Brynes R.K., Winton E.F. Heterogeneity of large granular lymphocyte proliferations: delineation of two major subtypes. Blood. 1986 Nov. 68(5). 1142-53.
- Zak K.P., Popova V.V., Orlenko V.L., Furmanova O.V., Tronko N.D. Cytokines in the blood of patients with type 2 diabetes mellitus. Mìžnarodnij endokrinologìčnij žurnal. 2021. 17(7). 534-51. doi: 10.22141/2224-0721.17.7.2021.244969.
- Qin H., Lee I.-F., Panagiotopoulos C. et al. Natural killer cells from children with type 1 diabetes have defects in NKG2D-dependent function and signaling. Diabetes. 2011. 60(3). 857-66.
- Возианов А.Ф., Бутенко А.К., Зак К.П. Цитокины. Биологические и противоопухолевые свойства. К.: Наукова думка, 1998. 315 с.
- Kedia-Mehta N., Tobin L., Zaiatz-Bittencourt V., Pisar–ska M.M., De Barra C. et al. Cytokine-induced natural killer cell training is dependent on cellular metabolism and is defective in obesity. Blood Adv. 2021 Nov 9. 5(21). 4447-55. doi: 10.1182/bloodadvances.2021005047.
- Holst J.J. Treatment of type 2 diabetes and obesity on the basis of the incretin system: The 2021 Banting Medal for Scientific Achievement Award Lecture. Diabetes. 2021 Nov. 70(11). 2468-75. doi: 10.2337/dbi21-0026.
- Zak K.P., Tronko M.D., Komisarenko S.V. Immunological mechanisms of increased susceptibility to COVID-19 disease and its severe course in patients with diabetes mellitus type 2 and obesity. Ukr. Biochem. J. 2023 Mar-Apr. 95(2). 5-23. doi: 10.15407/ubj95.02.005.
- Moulin C.M., Marguti I., Peron J.P., Halpern A., Rizzo L.V. Bariatric surgery reverses natural killer (NK) cell activity and NK-related cytokine synthesis impairment induced by morbid obesity. Obes. Surg. 2011 Jan. 21(1). 112-8. doi: 10.1007/s11695-010-0250-8.
- Negishi K., Kiyama H., Kato S., Teranishi T., Hatakenaka S., Katayama Y. et al. An immunohistochemical study on the river lamprey retina. Brain Res. 1986 Jan 8. 362(2). 389-93. doi: 10.1016/0006-8993(86)90470-1.
- Piatkiewicz P.J., Czech A., Kniotek M., Nowaczyk M. Effects of metformin vs sulphonylurea on immune activity of Natural Killer (NK) cells in individuals with newly diagnosed type 2 diabetes. Diabetologia. 2009. 52(Suppl. 1). A-494.
- Czech A., Piatkiewicz P., Kniotek M., Nowaczyk M. Metformin significantly improves immune activity of Natural Killer (NK) cells of type 2 diabetic patients by regulating the expression of glucotransporter 4 (glut4). Diabetologia. 2008. 51(Suppl. 1). 332 (A-835).
- Sansoni P., Cossarizza A., Brianti V., Fagnoni F., Snelli G., Monti D., Marcato A., Passeri G., Ortolani C., Forti E. et al. Lymphocyte subsets and natural killer cell activity in healthy old people and centenarians. Blood. 1993. Nov. 1. 82(9). 2767-73.