Международный эндокринологический журнал Том 19, №8, 2023
Вернуться к номеру
Оцінка ниркових і серцевих ризиків у пацієнтів із цукровим діабетом 2-го типу при використанні нестероїдних антагоністів мінералокортикоїдних рецепторів
Авторы: Єрохович В.М. (1), Комісаренко Ю.І. (1), Карпенко О.В. (1), Паньків В.І. (2), Кобиляк Н.М. (1), Бобрик М.І. (1), Кирієнко Д.В. (3), Гурська К.С. (1), Капліна А.А. (1), Васюк В.Л. (4)
(1) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
(3) - Київський міський ендокринологічний центр, м. Київ, Україна
(4) - Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
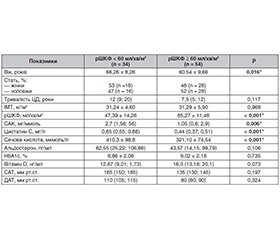
Актуальність. З огляду на доведену надмірну активацію ренін-ангіотензин-альдостеронової системи (РААС) і клінічні прояви артеріальної гіпертензії (АГ) здебільшого ниркового генезу виникає потреба в оптимізації антигіпертензивної терапії, націленої на активну нефропротекцію. Мета роботи: провести комплексну оцінку ниркових і серцевих факторів ризику в пацієнтів із цукровим діабетом 2-го типу (ЦД2) і хронічною хворобою нирок (ХХН), обґрунтувати призначення нестероїдних антагоністів мінералокортикоїдних рецепторів такій групі хворих. Матеріали та методи. У проспективному когортному дослідженні обстежено 88 хворих на ЦД2: група 1 — розрахункова швидкість клубочкової фільтрації (рШКФ) < 60 мл/хв/м2, група 2 — рШКФ ≥ 60 мл/хв/м2. РШКФ оцінювали за формулою CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) за сироватковим креатиніном. Категорію ШКФ встановлювали за критеріями KDIGO. Обчислювали альбумін-креатинінове співвідношення (САК). Рівень глікованого гемоглобіну (HbA1c) визначали методом високопродуктивної рідинної хроматографії. Альдостерон визначали методом імуноферментного аналізу. Результати. У групі пацієнтів з рШКФ < 60 мл/хв/м2 САК у добовій сечі було статистично вірогідно вищим порівняно з пацієнтами другої групи. Пацієнти з рШКФ < 60 мл/хв/м2 мали середній рівень сечової кислоти 410,3 ± 98,8 мкмоль/л, що статистично значимо вище, ніж у пацієнтів з рШКФ ≥ 60 мл/хв/м2 — 321,10 ± 74,54 мкмоль/л. Статистично значимий кореляційний зв’язок між рівнем сечової кислоти і маркерами порушення функції нирок виявлено лише в групі пацієнтів з рШКФ < 60 мл/хв/м2. Показники альдостерону були вищими в пацієнтів першої групи. Статистичної різниці між середнім значенням HbA1c у досліджуваних групах не виявлено. Висновки. Виявлені численні фактори несприятливого прогнозу щодо ниркових і серцевих ризиків: АГ, підвищення САК і холестерину, незадовільна компенсація ЦД2, ожиріння. Спостерігається збільшення частоти резистентної АГ, гіперурикемії, гіперальдостеронізму в пацієнтів зі зниженням рШКФ. У хворих з діабетичним ураженням нирок на тлі ЦД2 патогенетично обґрунтованим є призначення нестероїдного антагоніста мінералокортикоїдних рецепторів (фінеренону) в дозуванні 10–20 мг/добу.
Background. Given the proven excessive activation of the renin-angiotensin-aldosterone system and the clinical manifestations of hypertension, mostly of renal origin, there is a need to optimize antihypertensive therapy aimed at an active nephroprotection. The purpose of the study is to carry out a comprehensive assessment of kidney and heart risk factors in patients with type 2 diabetes mellitus and chronic kidney disease (CKD) and to justify the administration of non-steroidal mineralocorticoid receptor antagonists to these patients. Materials and methods. In a prospective cohort study, 88 patients with type 2 diabetes were examined: group 1 — estimated glomerular filtration rate (eGFR) < 60 ml/min/m2, group 2 — eGFR ≥ 60 ml/min/m2. eGFR was evaluated according to the CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) formula based on serum creatinine. GFR category was defined according to the KDIGO (Kidney Disease: Improving Global Outcomes) criteria. The albumin-creatinine ratio was calculated. The level of glycated hemoglobin (HbA1c) was assessed by the method of high-performance liquid chromatography. Aldosterone was evaluated by immunoenzymatic method. Results. In patients with eGFR < 60 ml/min/m2, the albumin-creatinine ratio in daily urine is statistically significantly higher compared to group 2. Patients with eGFR < 60 ml/min/m2 had an average uric acid level of 410.3 ± 98.8 μmol/l, which is statistically significantly higher than in those with eGFR ≥ 60 ml/min/m2 — 321.10 ± 74.54 μmol/l. A statistically significant correlation between the level of uric acid and markers of renal dysfunction was found only in patients with eGFR < 60 ml/min/m2. Aldosterone levels were higher in the first group. No statistical difference was found between the average value of HbA1c in the studied groups. Conclusions. Numerous factors of unfavorable prognosis regarding kidney and heart risks have been identified: hypertension, increased albumin-creatinine ratio and cholesterol, unsatisfactory compensation of diabetes, obesity. There is an increase in the frequency of resistant hypertension, hyperuricemia, and hyperaldosteronism in patients with decreased eGFR. In patients with diabetic kidney damage on the background of type 2 diabetes, the administration of finerenone, a non-steroidal mineralocorticoid receptor antagonist, at a dose of 10–20 mg/day is pathogenetically justified.
цукровий діабет; хронічна хвороба нирок; артеріальна гіпертензія; гіперальдостеронізм; антагоністи мінералокортикоїдних рецепторів
diabetes mellitus; chronic kidney disease; hypertension; hyperaldosteronism; mineralocorticoid receptor antagonists
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sun H., Saeedi P., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.B., Stein C. et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022 Jan. 183. 109119. doi: 10.1016/j.diabres.2021.109119. Epub 2021 Dec 6. Erratum in: Diabetes Res. Clin. Pract. 2023 Oct. 204. 110945. PMID: 34879977.
- Kidney Disease: Improving Global Outcomes (KDIGO) Dia–betes Work Group. KDIGO 2022 Clinical Practice Guideline for Dia–betes Management in Chronic Kidney Disease. Kidney Int. 2022 Nov. 102(5S). S1-S127. doi: 10.1016/j.kint.2022.06.008. PMID: 36272764.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int. Suppl. (2011). 2017 Jul. 7(1). 1-59. doi: 10.1016/j.kisu.2017.04.001. Epub 2017 Jun 21. Erratum in: Kidney Int. Suppl. (2011). 2017 Dec. 7(3). e1. PMID: 30675420; PMCID: PMC6340919.
- Kobrynska O., Didushko O. Current possibilities of influencing the main cardiovascular risk factors in patients with type 2 diabetes mellitus. International Journal of Endocrinology (Ukraine). 2022. 18(8). 426-431. https://doi.org/10.22141/2224-0721.18.8.2022.1220.
- Pankiv V.I., Yuzvenko T.Y., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 68(2). 46-51. https://doi.org/10.21856/j-PEP.2019.2.07.
- Habas E.Sr., Eledrisi M., Khan F., Elzouki A.Y. Secondary Hyperparathyroidism in Chronic Kidney Disease: Pathophysiology and Management. Cureus. 2021 Jul 14. 13(7). e16388. doi: 10.7759/cureus.16388. PMID: 34408941; PMCID: PMC8362860.
- Lanzer P., Hannan F.M., Lanzer J.D., Janzen J., Raggi P., Furniss D., Schuchardt M. et al. Medial Arterial Calcification: JACC State-of-the-Art Review. J. Am. Coll. Cardiol. 2021 Sep 14. 78(11). 1145-1165. doi: 10.1016/j.jacc.2021.06.049. PMID: 34503684; PMCID: PMC8439554.
- Dudar I., Savchuk V., Loboda O., Dudar S. Secondary hyperparathyroidism in diabetic kidney disease patients treated with hemodialysis. Ukrainian Journal of Nephrology and Dialysis. 2023. 1(77). 57-65. https://doi.org/10.31450/ukrjnd.1(77).2023.08.
- Petrova A., Kondratiuk V., Karpenko O., Ostashevska T., Krasiuk E. The effectiveness of melatonin in the complex treatment of hypertension in patients with stage 5 chronic kidney disease. Georgian Med. News. 2020 Feb. (299). 87-93. PMID: 32242852.
- Huang W., Molitch M.E. Prolactin and Other Pituitary Disorders in Kidney Disease. Semin. Nephrol. 2021 Mar. 41(2). 156-167. doi: 10.1016/j.semnephrol.2021.03.010. PMID: 34140094.
- Dourado M., Cavalcanti F., Vilar L., Cantilino A. Relationship between Prolactin, Chronic Kidney Disease, and Cardiovascular Risk. Int. J. Endocrinol. 2020 Jun 22. 2020. 9524839. doi: 10.1155/2020/9524839. PMID: 32655635; PMCID: PMC7327580.
- Ferrario C.M., Schiffrin E.L. Role of Mineralocorticoid Receptor Antagonists in Cardiovascular Disease. Circ. Res. 2015. 116. 206-13. https://doi.org/10.1161/CIRCRESAHA.116.302706.
- Tsukashita M., Marui A., Nishina T., Yoshikawa E., Kanemitsu H., Wang J. et al. Spironolactone alleviates late cardiac remo–deling after left ventricular restoration surgery. Journal of Thoracic and Cardiovascular Surgery. 2008. 136. https://doi.org/10.1016/j.jtcvs.2007.11.016.
- Trinchieri A., Perletti G., Magri V., Stamatiou K., Trinchie–ri M., Montanari E. Drug-induced gynecomastia: A systematic review and meta-analysis of randomized clinical trials. Arch. Ital. Urol. Androl. 2021 Dec 21. 93(4). 489-496. doi: 10.4081/aiua.2021.4.489. PMID: 34933535.
- Lin M.H., Wu W.T., Chen Y.C., Lu C.H., Su S.C., Kuo F.C., Chou Y.C., Sun C.A. Association between Non-Steroidal Anti-Inflammatory Drugs Use and the Risk of Type 2 Diabetes Mellitus: A Nationwide Retrospective Cohort Study. J. Clin. Med. 2022 Jun 2. 11(11). 3186. doi: 10.3390/jcm11113186. PMID: 35683572; PMCID: PMC9181422.
- Aringer M., Brinks R., Dörner T., Daikh D., Mosca M., Ramsey-Goldman R., Smolen J.S. et al. European League Against Rheumatism (EULAR)/American College of Rheumatology (ACR) SLE classification criteria item performance. Ann. Rheum. Dis. 2021 Jun. 80(6). 775-781. doi: 10.1136/annrheumdis-2020-219373. Epub 2021 Feb 10. PMID: 33568386.
- Khanna D., Fitzgerald J.D., Khanna P.P., Bae S., Singh M.K., Neogi T., Pillinger M.H. et al.; American College of Rheumatology. 2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res. (Hoboken). 2012 Oct. 64(10). 1431-46. doi: 10.1002/acr.21772. PMID: 23024028; PMCID: PMC3683400.
- Huang X., Jiang X., Wang L., Chen L., Wu Y., Gao P., Hua F. Visceral adipose accumulation increased the risk of hyperuricemia among middle-aged and elderly adults: a population-based study. J. Transl. Med. 2019 Oct 10. 17(1). 341. doi: 10.1186/s12967-019-2074-1. PMID: 31601236; PMCID: PMC6785935.
- Pludowski P., Takacs I., Boyanov M., Belaya Z., Diaco–nu C.C., Mokhort T., Zherdova N. et al. Clinical Practice in the Prevention, Diagnosis and Treatment of Vitamin D Deficiency: A Central and Eastern European Expert Consensus Statement. Nutrients. 2022 Apr 2. 14(7). 1483. doi: 10.3390/nu14071483. PMID: 35406098; PMCID: PMC9002638.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension. 2019. 23(3). 183-189. DOI: 10.5603/AH.a2019.0012.
- Cheng Q., Boucher B.J., Leung P.S. Modulation of hypovitaminosis D-induced islet dysfunction and insulin resistance through direct suppression of the pancreatic islet renin-angiotensin system in mice. Diabetologia. 2013 Mar. 56(3). 553-62. doi: 10.1007/s00125-012-2801-0. Epub 2012 Dec 19. PMID: 23250033.
- Kohut A.O., Chaban O.S., Dolynskyi R.G., Sandal O.S., Bursa A.I., Bobryk M.I., Vertel A.V. The features of posttraumatic stress disorder development in patients with diabetes mellitus 2 type. Wiad. Lek. 2022. 75 (8 pt 1). 1903-1907. doi: 10.36740/WLek202208115. PMID: 36089877.