Журнал «Боль. Суставы. Позвоночник» Том 13, №4, 2023
Вернуться к номеру
Поширеність надмірної маси тіла й ожиріння та пов’язані з ними фактори ризику в пацієнтів з аксіальним спондилоартритом
Авторы: G.O. Protsenko, A.O. Sytenko
State Institution “National Scientific Center “The M.D. Strazhesko Institute of Cardiology, Clinical and Regenerative
Medicine of the National Academy of Medical Sciences of Ukraine”, Kyiv, Ukraine
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
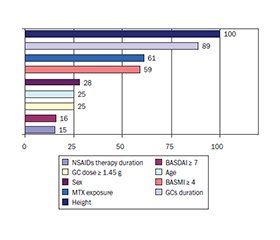
Актуальність. Надмірна маса тіла (МТ) та ожиріння частіше зустрічаються в пацієнтів з аксіальним спондилоартритом (аксСпА), ніж у загальній популяції. Мета: оцінити поширеність надмірної МТ/ожиріння в пацієнтів з аксСпА залежно від статі та виявити чинники з боку аксСпА, які позитивно асоціюються з МТ. Матеріали та методи. Проведено ретроспективний одноцентровий аналіз даних історій хвороби та амбулаторних карт пацієнтів з аксСпА. Нутритивний статус оцінювали за індексом маси тіла відповідно до критеріїв ВООЗ. Результати. Проаналізовано дані 142 пацієнтів з аксСпА (78,2 % чоловіків). МТ була позитивно пов’язана зі зростом (p < 0,0001), активністю аксСпА (BASMI ≥ 4) (p < 0,0001), лікуванням метотрексатом (p < 0,000) та кумулятивною дозою глюкокортикоїдів (ГК) ≥ 1,45 г (p = 0,01), з відповідною відносною важливістю кожного фактора 100, 59, 61 та 24,8 % відповідно. Сила зв’язку між МТ та низьким індексом рухливості (за BASMI) була ослаблена під впливом таких факторів-конфаундерів, як стать (23,7 %), вік (20,7 %), зріст (12,9 %), і підвищувалася під впливом наступних чинників: активність аксСпА (BASDAI ≥ 7) (на 13,7 %) та тривалість терапії ГК (на 11,1 %). Зріст був негативно пов’язаний із жіночою статтю (p < 0,0001) та інтенсивністю болю в спині (p < 0,04). Розроблені регресійні моделі маси тіла та зросту пояснювали відповідно 57,8 та 54 % варіацій вищезазначених параметрів у пацієнтів з аксСпА. Висновки. Поширеність надмірної МТ/ожиріння в досліджуваній вибірці з аксСпА нижча, ніж у когортах за межами України, але є значною. Позитивна асоціація між масою тіла та обмеженням рухливості хребта, впливом метотрексату та високою кумулятивною дозою ГК надає попередні докази їх ролі в патологічному збільшенні ваги.
Background. Overweight and obesity are more common in axial spondyloarthritis (axSpA) cohorts than in the general population. The purpose of this study wase to assess the prevalence of overweight in patients with axSpA depending on sex and to identify axSpA-related factors, which are positively associated with body weight (BW). Materials and methods. Study design: a retrospective single-institution case series. Data source: medical records of patients with axSpA. Nutritional status was categorized by body mass index (BMI) according to WHO criteria. Results. The data of 142 patients with axSpA (78.2 % men) were analyzed. Weight was positively associated with: height (p < 0.0001), BASMI ≥ 4 (p < 0.0001), methotrexate treatment (p < 0.000) and cumulative glucocorticoids (GCs) dose ≥ 1.45 g (p = 0.01), with the relative importance (RI) of each factor of 100, 59, 61, and 24.8 %. The strength of the association between BW and BASMI was attenuated under the influence of the following confounders: gender (23.7 %), age (20.7 %), height (12.9 %) and strengthened under by the influence of BASDAI ≥ 7 (by 13.7 %) and the duration of GCs therapy (by 11.1 %). Height was negatively associated with female gender (p < 0.0001) and back pain intensity (p < 0.04). The developed regression models for body weight and height explained, respectively, 57.8 and 54 % of the variations parameters of patients with axSpA. Conclusions. Prevalence of overweight in the study sample of Ukrainian axSpA patients is lower than in cohorts outside of Ukraine, but still significant positive association of BW with spinal mobility limitation, exposure to MTX and high cumulative dose of GCs provides preliminary evidence their role in pathological weight gain
аксіальний спондилоартрит; ожиріння; надмірна вага; фактори ризику
axial spondyloarthritis; obesity; overweight; risk factors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bindesbøll C., Garrido-Cumbrera M., Bakland G., Dagfinrud H. Obesity Increases Disease Activity of Norwegian Patients with Axial Spondyloarthritis: Results from the European Map of Axial Spondyloarthritis Survey. Curr. Rheumatol. Rep. 2020 Jun 23. 22(8). 43. doi: 10.1007/s11926-020-00917-4.
- Liew J.W., Huang I.J., Louden D.N., Singh N., Gensler L.S. Association of body mass index on disease activity in axial spondyloarthritis: systematic review and meta-analysis. RMD Open. 2020 May. 6(1). e001225. doi: 10.1136/rmdopen-2020-001225.
- Rubio Vargas R., van den Berg R., van Lunteren M., Ez-Zaitouni Z., Bakker P.A. et al. Does body mass index (BMI) influence the Ankylosing Spondylitis Disease Acti–vity Score in axial spondyloarthritis? Data from the SPACE cohort. RMD Open. 2016 Jun 16. 2(1). e000283. doi: 10.1136/rmdopen-2016-000283.
- Kim S.K., Choe J.Y., Lee S.S., Shin K. Body mass index is related with the presence of syndesmophyte in axial spondyloarthritis: Data from the Korean College of Rheumatology BIOlogics (KOBIO) registry. Mod. Rheumatol. 2017 Sep. 27(5). 855-861. doi: 10.1080/14397595.2016.1265637.
- Maas F., Arends S., van der Veer E., Wink F., Efde M. et al. Obesity Is Common in Axial Spondyloarthritis and Is Associated with Poor Clinical Outcome. J. Rheumatol. 2016 Feb. 43(2). 383-7. doi: 10.3899/jrheum.150648.
- Micheroli R., Bhatia S., Vallejo-Yagüe E., Burden A.M., Möller B. et al. Obesity Represents a Persisting Health Issue in Axial Spondyloarthritis, Particularly Affec–ting Socially Disadvantaged Patients. J. Rheumatol. 2023 Jul 15. jrheum.2023-0137. doi: 10.3899/jrheum.2023-0137.
- Maguire S., Wilson F., Gallagher P., O’Shea F. Central Obesity in Axial Spondyloarthritis: The Missing Link to Understanding Worse Outcomes in Women? J. Rheumatol. 2022 Jun. 49(6). 577-584. doi: 10.3899/jrheum.211062.
- Fitzgerald G., Gallagher P., O’Shea F.D. Multimorbidity in Axial Spondyloarthropathy and Its Association with Disease Outcomes: Results from the Ankylosing Spondylitis Registry of Ireland Cohort. J. Rheumatol. 2020 Feb. 47(2). 218-226. doi: 10.3899/jrheum.181415.
- Slouma M., Lahmer W., Kharrat L., Ali K.B., Tezeghdenti A. et al. Obesity, Lipid Profile and Cytokines in Spondyloarthritis. Indian J. Endocrinol. Metab. 2022 Jul-Aug. 26(4). 348-353. doi: 10.4103/ijem.ijem_176_22.
- O’Dwyer T., O’Shea F., Wilson F. Decreased physical activity and cardiorespiratory fitness in adults with ankylosing spondylitis: a cross-sectional controlled study. Rheumatol. Int. 2015 Nov. 35(11). 1863-72. doi: 10.1007/s00296-015-3339-5.
- Dhir V., Mishra D., Samanta J. Glucocorticoids in spondyloarthritis — systematic review and real-world analysis. Rheumatology (Oxford). 2021 Oct 2. 60(10). 4463-4475. doi: 10.1093/rheumatology/keab275.
- Fardet L., Nazareth I., Petersen I. Long-term systemic glucocorticoid therapy and weight gain: a population-based cohort study. Rheumatology (Oxford). 2021 Mar 2. 60(3). 1502-1511. doi: 10.1093/rheumatology/keaa289.
- Ahmed N.J., Alshehri A.M., Almalki Z.S., Alahmari A. Drug-induced weight gain in the last 10 years: a descriptive study. Pharmazie. 2022 Oct 1. 77(10). 299-301. doi: 10.1691/ph.2022.2408.
- Huscher D., Thiele K., Gromnica-Ihle E., Hein G., Demary W. et al. Dose-related patterns of glucocorticoid-induced side effects. Ann. Rheum. Dis. 2009 Jul. 68(7). 1119-24. doi: 10.1136/ard.2008.092163.
- Vergne-Salle P., Salle L., Fressinaud-Marie A.C., Descamps-Deplas A., Montestruc F. et al. Diet and Disease Activity in Patients with Axial Spondyloarthritis: SpondyloArthritis and NUTrition Study (SANUT). Nutrients. 2022 Nov 9. 14(22). 4730. doi: 10.3390/nu14224730.
- Hulander E., Zverkova Sandström T., Beckman Rehnman J., Law L., Söderberg S., Forsblad-d’Elia H. Patients with radiographic axial spondylarthritis have an impaired dietary intake — a cross-sectional study with matched controls from northern Sweden. Arthritis Res. Ther. 2023 Aug 7. 25(1). 142. doi: 10.1186/s13075-023-03126-3.
- Valido A., Crespo C.L., Pimentel-Santos F.M. Muscle Evaluation in Axial Spondyloarthritis — The Evidence for Sarcopenia. Front. Med. (Lausanne). 2019 Oct 18. 6. 219. doi: 10.3389/fmed.2019.00219.
- Neto A., Pinheiro Torres R., Ramiro S., Sardoo A., Rodrigues-Manica S. et al. Muscle dysfunction in axial spondylarthritis: the MyoSpA study. Clin. Exp. Rheumatol. 2022 Feb. 40(2). 267-273. doi: 10.55563/clinexprheumatol/9ljng7.
- Bedaiwi M., Sari I., Thavaneswaran A., Ayearst R., Haroon N., Inman R.D. Fatigue in Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis: Analysis from a Longitudinal Observation Cohort. J. Rheumatol. 2015 Dec. 42(12). 2354-60. doi: 10.3899/jrheum.150463.
- Gossec L., Dougados M., D’Agostino M.A., Fautrel B. Fatigue in early axial spondyloarthritis. Results from the French DESIR cohort. Joint Bone Spine. 2016 Jul. 83(4). 427-31. doi: 10.1016/j.jbspin.2015.07.012.
- Reddy K.N., Sabu N., Pandey N., Raut A., Joag K., Patil P. Anxiety and depression among patients with axial spondyloarthritis. Eur. J. Rheumatol. 2022 Jan. 9(1). 8-13. doi: 10.5152/eurjrheum.2021.21022.
- Kieskamp S.C., Paap D., Carbo M.J.G., Wink F., Bos R. et al. Central sensitization, illness perception and obesity should be considered when interpreting disease activity in axial spondyloarthritis. Rheumatology (Oxford). 2021 Oct 2. 60(10). 4476-4485. doi: 10.1093/rheumatology/keab019.
- Martindale J., Smith J., Sutton C.J., Grennan D., Goodacre L., Goodacre J.A. Disease and psychological status in ankylosing spondylitis. Rheumatology (Oxford). 2006 Oct. 45(10). 1288-93. doi: 10.1093/rheumatology/kel115.
- Vasilenko E., Nikolaeva O., Dadalova A. et al. AB0734 changes in height and body mass index over time in patients with axial spondyloarthritis, treated with tumor necrosis factor-a inhibitors. Annals of the Rheumatic Di–seases. 2019. 78. 1830-1831.
- Kerola A.M., Kazemi A., Rollefstad S., Lillegra–ven S., Sexton J. et al. All-cause and cause-specific morta–lity in rheumatoid arthritis, psoriatic arthritis and axial spondyloarthritis: a nationwide registry study. Rheumatology (Oxford). 2022 Nov 28. 61(12). 4656-4666. doi: 10.1093/rheumatology/keac210.
- Poddubnyy D., Sieper J., Akar S., Muñoz-Fernández S., Haibel H. et al. Characteristics of patients with –axial spondyloarthritis by geographic regions: PROOF multicountry observational study baseline results. Rheumato–logy (Oxford). 2022 Aug 3. 61(8). 3299-3308. doi: 10.1093/rheumatology/keab901.
- Kiapour A., Joukar A., Elgafy H., Erbulut D.U., Agarwal A.K., Goel V.K. Biomechanics of the Sacroiliac Joint: Anatomy, Function, Biomechanics, Sexual Dimorphism, and Causes of Pain. Int. J. Spine Surg. 2020 Feb 10. 14 (Suppl. 1). 3-13. doi: 10.14444/6077.
- Braun J. Significance of structural changes in the –axial skeleton in patients with axial spondyloarthritis: how important are lesions in the sacroiliac joint? RMD Open. 2022 Dec. 8(2). e002822. doi: 10.1136/rmdopen-2022-002822.
- Kilic G., Senol S., Baspinar S., Kilic E., Ozgocmen S. Degenerative changes of lumbar spine and their clinical implications in patients with axial spondyloarthritis. Clin. Rheumatol. 2023 Jan. 42(1). 111-116. doi: 10.1007/s10067-022-06321-w.
- Chilton-Mitchell L., Martindale J., Hart A., Goodacre L. Normative values for the Bath Ankylosing Spondylitis Metrology Index in a UK population. Rheumatology (Oxford). 2013 Nov. 52(11). 2086-90. doi: 10.1093/rheumatology/ket272.
- Mishra D., Dhir V., Naidu G.S.R.S.N.K., Khullar A., Kumar V. et al. Efficacy of a step-down regimen of oral prednisolone in axial spondyloarthritis: result of a –double-blind randomized controlled trial (COBRA-AS Study). Rheumatology (Oxford). 2021 Apr 6. 60(4). 1932-1941. doi: 10.1093/rheumatology/keaa685.
- Zhang Y.P., Gong Y., Zeng Q.Y., Hou Z.D., Xiao Z.Y. A long-term, observational cohort study on the safety of low-dose glucocorticoids in ankylosing spondylitis: adverse events and effects on bone mineral density, blood lipid and glucose levels and body mass index. BMJ Open. 2015 Jun 3. 5(6). e006957. doi: 10.1136/bmjopen-2014-006957.
- Baker J.F., Sauer B.C., Cannon G.W., Teng C.C., Michaud K. et al. Changes in Body Mass Related to the Initiation of Disease-Modifying Therapies in Rheumatoid Arthritis. Arthritis Rheumatol. 2016 Aug. 68(8). 1818-27. doi: 10.1002/art.39647.
- John K., Marino J.S., Sanchez E.R., Hinds T.D. Jr. The glucocorticoid receptor: cause of or cure for obesity? Am J. Physiol. Endocrinol. Metab. 2016 Feb 15. 310(4). E249-57. doi: 10.1152/ajpendo.00478.2015.
- Peter R.S., Fromm E., Klenk J., Concin H., Nagel G. Change in height, weight, and body mass index: longitudinal data from Austria. Am. J. Hum. Biol. 2014 Sep-Oct. 26(5). 690-6. doi: 10.1002/ajhb.22582.