Международный эндокринологический журнал Том 20, №1, 2024
Вернуться к номеру
Від радіойодної абляції після тиреоїдектомії можна безпечно відмовитися або відкласти її в окремих пацієнтів групи низького ризику із папілярним раком щитоподібної залози І стадії: обсерваційне проспективне дослідження
Авторы: S.M. Cherenko (1), A.Yu. Glagolieva (1), D.E. Makhmudov (2)
(1) - International Medical Center “CitiDoctor”, Kyiv, Ukraine
(2) - National Cancer Institute of the Ministry of Health of Ukraine, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
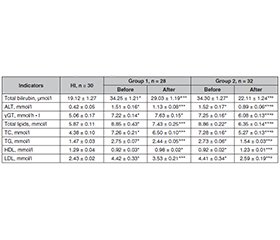
Актуальність. Згідно з консенсусом Європейської тиреоїдної асоціації щодо лікування диференційованої карциноми щитоподібної залози (ЩЗ) 2006 р., було запропоновано уникати застосування радіоактивного йоду (RAI) після тиреоїдектомії в пацієнтів з уніфокальною мікрокарциномою (≤ 1 см) без поширення за межі капсули ЩЗ та без метастазів у лімфатичні вузли. Оскільки отримано нові дані та переглянуто стратифікацію ризику, у 2022 році цю ж рекомендацію було розширено для пацієнтів із мікрокарциномою та ураженням центральних лімфовузлів шиї. У рекомендаціях Американської тиреоїдної асоціації (2015) указано на можливість відсутності абляції RAI після гемі- або тотальної тиреоїдектомії при раку ЩЗ розміром до 1 см із 5 і менше мікрометастазами (до 2 мм) у центральні лімфатичні вузли шиї, оскільки ця стратегія не має негативного впливу на прогноз захворювання. У пацієнтів із низьким ризиком ще не було продемонстровано достатніх доказів обов’язкової післяхірургічної абляції радіойодом. Мета дослідження: виявити, чи можна припинити або відкласти терапію RAI після тиреоїдектомії до підтвердження прогресування захворювання в пацієнтів із низьким ризиком. Матеріали та методи. Протягом п’яти років спостерігали дві групи хворих (по 30 у групі, всього 60) з папілярною мікрокарциномою ЩЗ Т1N1a (5 і менше мікрометастазів VI рівня до 2 мм). У першій групі пацієнти отримували 100 мКі (3,75 ГБк) I131 незабаром після тотальної тиреоїдектомії, тоді як у другій групі RAI застосовували відтерміновано, коли спостерігалися ознаки прогресування (підвищений рівень тиреоглобуліну в сироватці крові та підозрілі результати ультразвукового дослідження чи комп’ютерної томографії) після операції на ЩЗ. Результати. Через 5 років не було суттєвої різниці між групами щодо місцевих рецидивів після використання RAI (один у першій групі й два в другій) та/або віддалених метастазів (t-критерій, p = 0,58). В усіх випадках рецидивів хворих лікували з подальшим хірургічним висіченням, без нових даних щодо прогресування протягом зазначеного часу спостереження. Висновки. Ад’ювантна терапія RAI при папілярному раку щитоподібної залози Т1N1a може бути необов’язковою в пацієнтів із невеликою кількістю мікрометастазів VI рівня. Місцеві та віддалені метастази, виявлені під час ретельного спостереження за підвищенням рівня тиреоглобуліну або при візуалізації, можна ефективно лікувати за допомогою відстроченої терапії RAI та/або хірургічного втручання.
Background. The European Thyroid Association consensus for the management of differentiated thyroid cancer (2006) suggested to avoid radioactive iodine (RAI) after thyroidectomy in patients with unifocal microcarcinoma (≤ 1 cm) with no extension beyond the thyroid capsule and without lymph node metastases. As the new data was collected and the risk stratification was revised, in 2022 the same recommendation was expanded to the patients with microcarcinoma and central neck lymph node involvement. The American Thyroid Association guidelines (2015) advocated no RAI ablation after hemi- or total thyroidectomy for thyroid cancer less than 1 cm with 5 and less micrometastases up to 2 mm in central neck lymph nodes as this strategy has no negative impact on the disease prognosis. In low-risk patients, no sufficient evidence of the obligatory postsurgical radioiodine ablation has been yet demonstrated. The aim of our study was to reveal whether RAI after thyroidectomy can be abandoned or postponed until the disease progression is confirmed in low-risk patients. Materials and methods. Two groups of patients (30 per group, 60 in total) with papillary microcarcinoma Т1N1a (5 and less level VI micrometastases up to 2 mm) were observed during a 5-year follow-up. In the first group, patients received 100 mCi (3.75 GBq) I131 shortly after total thyroidectomy while in the second group, postponed RAI was applied when progression signs were observed (elevated serum thyroglobulin level and US/CT suspected findings) after thyroid surgery. Results. After 5 years, no significant difference between groups was observed regarding post-RAI local recurrences (one in the first group and two in the second group) and/or distant metastases (t-test, p = 0.58). All cases of neck recurrences were treated with subsequent surgical excision, with no new data of progression within the specified follow-up. Conclusions. RAI adjuvant therapy for papillary thyroid carcinoma Т1N1a may not be necessary for patients with small number of level VI micrometastases. Local and distant metastases revealed during the careful follow-up by thyroglobulin level elevation and when using visualization techniques can be effectively treated with postponed RAI therapy and/or surgery.
папілярна карцинома щитоподібної залози; низький ризик; тиреоїдектомія; відстрочена радіойодна абляція
papillary thyroid carcinoma; low risk; thyroidectomy; postponed radioiodine ablation
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Pacini F., Schlumberger M., Dralle H., Elisei R., Smit J.W., Wiersinga W.; European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur. J. Endocrinol. 2006 Jun. 154(6). 787-803. doi: 10.1530/eje.1.02158.
- Pacini F., Fuhrer D., Elisei R., Handkiewicz-Junak D., Le–boulleux S. et al. 2022 ETA Consensus Statement: What are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur. Thyroid J. 2022 Jan 1. 11(1). e210046. doi: 10.1530/ETJ-21-0046.
- Haugen B.R., Alexander E.K., Bible K.C., Doherty G.M., Mandel S.J. et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016 Jan. 26(1). 1-133. doi: 10.1089/thy.2015.0020.
- Ulisse S., Baldini E., Lauro A., Pironi D., Tripodi D. et al. Papillary Thyroid Cancer Prognosis: An Evolving Field. Cancers (Basel). 2021 Nov 7. 13(21). 5567. doi: 10.3390/cancers13215567.
- Lam A.K. Papillary Thyroid Carcinoma: Current Position in Epidemiology, Genomics, and Classification. Methods Mol. Biol. 2022. 2534. 1-15. doi: 10.1007/978-1-0716-2505-7_1.
- Glikson E., Alon E., Bedrin L., Talmi Y.P. Prognostic Factors in Differentiated Thyroid Cancer Revisited. Isr. Med. Assoc. J. 2017 Feb. 19(2). 114-118.
- Watanabe K., Igarashi T., Uchiyama M., Ojiri H. Relapse-free survival after adjuvant radioactive iodine therapy in patients with differentiated thyroid carcinoma with a microscopically positive tumor margin. Ann. Nucl. Med. 2020 Dec. 34(12). 920-925. doi: 10.1007/s12149-020-01523-1.
- Zhao H., Gong Y. Radioactive iodine in low- to intermedia–te-risk papillary thyroid cancer. Front. Endocrinol. (Lausanne). 2022 Aug 11. 13. 960682. doi: 10.3389/fendo.2022.960682.
- Clement S.C., Peeters R.P., Ronckers C.M., Links T.P., van den Heuvel-Eibrink M.M. et al. Intermediate and long-term adverse effects of radioiodine therapy for differentiated thyroid carcinoma — a systematic review. Cancer Treat. Rev. 2015 Dec. 41(10). 925-34. doi: 10.1016/j.ctrv.2015.09.001.
- Haugen B.R. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Diffe–rentiated Thyroid Cancer: What is new and what has changed? Cancer. 2017 Feb 1. 123(3). 372-381. doi: 10.1002/cncr.30360.
- Stewart L.A., Kuo J.H. Advancements in the treatment of differentiated thyroid cancer. Ther. Adv. Endocrinol. Metab. 2021 Mar 17. 12. 20420188211000251. doi: 10.1177/20420188211000251.
- Cadena-Piñeros E., Escobar J.V., Carreño J.A., Rojas J.G. Second Adjuvant Radioiodine Therapy after Reoperation for Locoregionally Persistent or Recurrent Papillary Thyroid Carcinoma. World J. Nucl. Med. 2022 Sep 2. 21(4). 290-295. doi: 10.1055/s-0042-1750404.
- Kalaitzidou S., Papadakis G., Sapera A., Tampouratzi D., Drosou A. et al. Outcomes of surgery and radioiodine treatment for neck recurrence in papillary thyroid cancer. J. BUON. 2020 Jan-Feb. 25(1). 383-388.
- Hung M.L., Wu J.X., Li N., Livhits M.J., Yeh M.W. Association of Radioactive Iodine Administration After Reoperation with Outcomes Among Patients with Recurrent or Persistent Papillary Thyroid Cancer. JAMA Surg. 2018 Dec 1. 153(12). 1098-1104. doi: 10.1001/jamasurg.2018.2659.
- Radowsky J.S., Howard R.S., Burch H.B., Stojadinovic A. Impact of degree of extrathyroidal extension of disease on papillary thyroid cancer outcome. Thyroid. 2014 Feb. 24(2). 241-4. doi: 10.1089/thy.2012.0567.
- Ahn J., Jin M., Song E., Jeon M.J., Kim T.Y. et al. Clinical Outcomes after Early and Delayed Radioiodine Remnant Ablation in Patients with Low-Risk Papillary Thyroid Carcinoma: Propensity Score Matching Analysis. Endocrinol. Metab. (Seoul). 2020 Dec. 35(4). 830-837. doi: 10.3803/EnM.2020.747.
- Pasqual E., Schonfeld S., Morton L.M., Villoing D., Lee C. et al. Association Between Radioactive Iodine Treatment for Pediatric and Young Adulthood Differentiated Thyroid Cancer and Risk of Second Primary Malignancies. J. Clin. Oncol. 2022 May 1. 40(13). 1439-1449. doi: 10.1200/JCO.21.01841.
- Nilsson J.N., Siikanen J., Condello V., Jatta K., Saini R. et al. Iodine avidity in papillary and poorly differentiated thyroid cancer is predicted by immunohistochemical and molecular work-up. Eur. Thyroid J. 2023 Jul 28. 12(4). e230099. doi: 10.1530/ETJ-23-0099.