Международный эндокринологический журнал Том 20, №1, 2024
Вернуться к номеру
Кардіометаболічні особливості пацієнтів із цукровим діабетом 2-го типу залежно від фенотипів ожиріння
Авторы: Прибила О.В., Зінич О.В., Кушнарьова Н.М., Ковальчук А.В., Шишкань-Шишова К.О.
ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
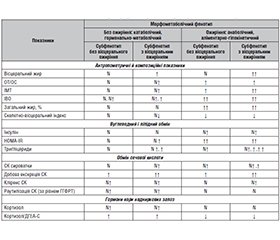
Актуальність. Проблема дослідження причин і механізмів порушення метаболічних процесів при метаболічному синдромі й цукровому діабеті (ЦД) 2-го типу є однією з найбільш актуальних у сучасній медицині у зв’язку зі зростаючою поширеністю дисметаболічних станів і їх тяжкими наслідками для здоров’я населення в сучасному світі. Початкова гіпотеза полягала в тому, що відмінності гормонально-метаболічних станів у пацієнтів із ЦД 2-го типу можуть пояснюватись особливостями анаболічно-катаболічного балансу при різних метаболічних фенотипах. Метою роботи було вивчення особливостей антропометричних і композиційних показників, показників вуглеводного, ліпідного й пуринового обміну, анаболічно-катаболічного балансу як предикторів кардіоваскулярних захворювань у пацієнтів із ЦД 2-го типу залежно від фенотипу. Матеріали та методи. До дослідження включено 165 хворих на ЦД 2-го типу, з них 71 жінка і 94 чоловіки, віком від 32 до 82 років (59,0 ± 8,3 року), які мали рівень глікованого гемоглобіну (HbA1c) вище за 6,7 % (8,3 ± 1,8 %) на тлі прийому пероральних цукрознижуючих засобів. Результати. У процесі обстеження 165 пацієнтів виявлено, що метаболізм групи без загального ожиріння має переважно катаболічну спрямованість, що проявляється порівняно з групою з загальним ожирінням у меншому абсолютному накопиченні загального й вісцерального жиру, нижчому рівні урикемії (за рахунок меншої реабсорбції уратів у ниркових канальцях, більш низької активності анаболічного шляху реутилізації), що супроводжується нижчим рівнем анаболічних гормонів — інсуліну і ДГЕА-С і вищим — катаболічного стресового гормону кортизолу. Загальне ожиріння в групі з ІМТ ≥ 30 кг/м2 зумовлене переважним впливом анаболічних гормонів (інсуліну, ДГЕА-С), що сприяють синтезу de novo жирних кислот і пуринових основ, реутилізації пуринів і реабсорбції сечової кислоти, що веде до накопичення жиру в підшкірній і вісцеральній жировій тканині й підвищення рівня урикемії, за умов нижчого вмісту катаболічного гормону кортизолу. Висновки. Застосовування комплексу антропометричних, композиційних біохімічних і гормональних показників дозволяє проводити диференціальну діагностику аліментарно-гіпокінетичного (анаболічного) і стресового (катаболічного) фенотипів у хворих на ЦД 2-го типу. Додатковою характеристикою метаболічного статусу при ЦД 2-го типу може бути визначення показників продукції та екскреції сечової кислоти в пацієнтів з різним ступенем ожиріння. Перелічені ознаки вказують на анаболічний тип метаболізму при ожирінні.
Background. The problem of studying the causes and mechanisms of metabolic disorders in metabolic syndrome and type 2 diabetes mellitus (T2DM) is one of the most important questions in modern medicine. It is due to the growing prevalence of dysmetabolic conditions and their serious consequences for the population health in the modern world. The initial hypothesis was that the differences in hormonal and metabolic conditions in patients with T2DM can be explained by the peculiarities of the anabolic-catabolic balance in different metabolic phenotypes. The aim of the work was to study the features of anthropometric and compositional parameters, indicators of carbohydrate, lipid and purine metabolism, anabolic-catabolic balance as predictors of cardiovascular diseases in patients with T2DM, depending on the phenotype. Materials and methods. One hundred and sixty-five patients with T2DM were included in the study, 71 women and 94 men aged from 32 to 82 years (59.0 ± 8.3 years). They had a level of glycated hemoglobin higher than 6.7 % (8.3 ± 1.8 %) against the background of taking oral hypoglycemic agents. Results. During the examination, it was found that the metabolism of patients without general obesity has a predominantly catabolic orientation, which, compared to those with general obesity, is manifested in a lower absolute accumulation of total and visceral fat, a reduced level of uricemia (due to a lower reabsorption of urate in the renal tubules, a lower activity of the anabolic pathway of reutilization), which is accompanied by a lower level of anabolic hormones, insulin and dehydroepiandrosterone sulfate (DHEA-S), and a higher level of the catabolic stress hormone cortisol. General obesity in patients with body mass index ≥ 30 kg/m2 is caused by the predominant influence of anabolic hormones (insulin, DHEA-S), which contribute to the de novo synthesis of fatty acids and purine bases, the reutilization of purines and the reabsorption of uric acid. This leads to the accumulation of fat in the subcutaneous and visceral adipose tissue and an increase in the level of uricemia under the conditions of a lower content of the catabolic hormone cortisol. Conclusions. The application of a set of anthropometric, composition biochemical and hormonal indicators allows for a differential diagnosis of alimentary hypokinetic (anabolic) and stress (catabolic) phenotypes in patients with T2DM. An additional characteristic of the metabolic status in T2DM may be the assessment of uric acid production and excretion in patients with varying degrees of obesity. The listed signs indicate an anabolic type of metabolism in obesity.
цукровий діабет 2-го типу; ожиріння; жирова тканина; фенотип; серцево-судинні захворювання
type 2 diabetes; obesity; adipose tissue; phenotype; cardiovascular diseases
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Piché M.E., Tchernof A., Després J.P. Obesity Phenotypes, Dia–betes, and Cardiovascular Diseases. Circ. Res. 2020 May 22. 126(11). 1477-1500. doi: 10.1161/CIRCRESAHA.120.316101. Epub 2020 May 21. Erratum in: Circ Res. 2020 Jul 17.127(3).e107. PMID: 32437302.
- Wildman R.P., Muntner P., Reynolds K., McGinn A.P., Rajpathak S., Wylie-Rosett J., Sowers M.R. The obese without cardiome–tabolic risk factor clustering and the normal weight with cardiometabolic risk factor clustering: prevalence and correlates of 2 phenotypes among the US population (NHANES 1999–2004). Arch. Intern. Med. 2008 Aug 11. 168(15). 1617-24. doi: 10.1001/archinte.168.15.1617. PMID: 18695075.
- Worm D., Madsbad S., Hansen D.L. Metabolic Health in Severely Obese Subjects: A Descriptive Study. Metab. Syndr. Relat. Disord. 2019 Mar. 17(2). 115-119. doi: 10.1089/met.2018.0083. Epub 2019 Jan 16. PMID: 30649996.
- Tang A., Coster A.C.F., Tonks K.T., Heilbronn L.K., Po–cock N., Purtell L., Govendir M. et al. Longitudinal Changes in Insulin Resistance in Normal Weight, Overweight and Obese Individuals. J. Clin. Med. 2019 May 8. 8(5). 623. doi: 10.3390/jcm8050623. PMID: 31071971; PMCID: PMC6572215.
- Tian S., Xu Y. Association of sarcopenic obesity with the risk of all-cause mortality: A meta-analysis of prospective cohort studies. Ge–riatr. Gerontol. Int. 2016 Feb. 16(2). 155-66. doi: 10.1111/ggi.12579. Epub 2015 Aug 14. PMID: 26271226.
- Voloshyna L., Smiyan S. Pathomorphosis of the metabolic phenotype osteoarthritis: the role of obesity, diabetes and hypothyroidism (age and gender features). International Journal of Endocrinology (Ukraine). 2017. 13(5). 303-310. https://doi.org/10.22141/2224-0721.13.5.2017.110018
- Wang Q., Zheng D., Liu J., Fang L., Li Q. Skeletal muscle mass to visceral fat area ratio is an important determinant associated with type 2 diabetes and metabolic syndrome. Diabetes Metab. Syndr. Obes. 2019 Aug 14. 12. 1399-1407. doi: 10.2147/DMSO.S211529. PMID: 31616170; PMCID: PMC6698596.
- Joseph J.J., Wang X., Diez Roux A.V., Sanchez B.N., Seeman T.E., Needham B.L., Golden S.H. Antecedent longitudinal changes in body mass index are associated with diurnal cortisol curve features: The multi-ethnic study of atherosclerosis. Metabolism. 2017 Mar. 68. 95-107. doi: 10.1016/j.metabol.2016.12.001. Epub 2016 Dec 8. PMID: 28183457; PMCID: PMC5312946.
- de Oliveira L.F.G., Souza-Junior T.P., Fechio J.J., Gomes-Santos J.A.F., Sampaio R.C., Vardaris C.V., Lambertucci R.H., de Barros M.P. Uric Acid and Cortisol Levels in Plasma Correlate with Pre-Competition Anxiety in Novice Athletes of Combat Sports. Brain Sci. 2022 May 31. 12(6). 712. doi: 10.3390/brainsci12060712. PMID: 35741598; PMCID: PMC9221204.
- Pujia R., Tarsitano M.G., Arturi F., De Lorenzo A., Lenzi A., Pujia A., Montalcini T. Advances in Phenotyping Obesity and in Its Dietary and Pharmacological Treatment: A Narrative Review. Front. Nutr. 2022 Feb 15. 9. 804719. doi: 10.3389/fnut.2022.804719. PMID: 35242796; PMCID: PMC8885626.
- Pankiv V., Yuzvenko T. The relationships between variables of glycated hemoglobin and diabetes distress in patients with type 1 and type 2 diabetes mellitus. International Journal of Endocrinology (Ukraine). 2023. 19(6). 424-427. https://doi.org/10.22141/2224-0721.19.6.2023.1310.
- Lee B.J., Nam J., Kim J.Y. Predictors of metabolic abnormalities in phenotypes that combined anthropometric indices and triglycerides. BMC Complement. Altern. Med. 2016 Feb 10. 16. 59. doi: 10.1186/s12906-016-1024-1. PMID: 26861162; PMCID: PMC4748450.
- Favero V., Cremaschi A., Parazzoli C., Falchetti A., Gaudio A., Gennari L. et al. Pathophysiology of Mild Hypercortisolism: From the Bench to the Bedside. Int. J. Mol. Sci. 2022 Jan 8. 23(2). 673. doi: 10.3390/ijms23020673. PMID: 35054858; PMCID: PMC8775422.
- Yildiz M., Isik E., Abali Z.Y., Keskin M., Ozbek M.N., Bas F. et al. Clinical and Hormonal Profiles Correlate With Molecular Characteristics in Patients With 11β-Hydroxylase Deficiency. J. Clin. Endocrinol. Metab. 2021 Aug 18. 106(9). e3714-e3724. doi: 10.1210/clinem/dgab225. PMID: 33830237.
- Marciniak M., Sato M., Rutkowski R., Zawada A., Ju–chacz A., Mahadea D. et al. Effect of the one-day fasting on cortisol and DHEA daily rhythm regarding sex, chronotype, and age among obese adults. Front. Nutr. 2023 Feb 6. 10. 1078508. doi: 10.3389/fnut.2023.1078508. PMID: 36814510; PMCID: PMC9940638.
- Dube S., Norby B.J., Pattan V., Carter R.E., Basu A., Basu R. 11β-hydroxysteroid dehydrogenase types 1 and 2 activity in subcutaneous adipose tissue in humans: implications in obesity and diabetes. J. Clin. Endocrinol. Metab. 2015 Jan. 100(1). E70-6. doi: 10.1210/jc.2014-3017. PMID: 25303491; PMCID: PMC4283013.
- Chiodini I. Clinical review: Diagnosis and treatment of subclinical hypercortisolism. J. Clin. Endocrinol. Metab. 2011 May. 96(5). 1223-36. doi: 10.1210/jc.2010-2722. Epub 2011 Mar 2.
- Кovalchuk A., Zinych О., Кushnarova N., Prybyla О., Shyshkan-Shyshova K. Pathophysiological basis of sarcopenia — a chro–nic complication of diabetes. International Journal of Endocrinology (Ukraine). 2022. 18(6). 343-350. https://doi.org/10.22141/2224-0721.18.6.2022.1205.
- Janssen J.A.M.J.L. New Insights into the Role of Insulin and Hypothalamic-Pituitary-Adrenal (HPA) Axis in the Metabolic Syndrome. Int. J. Mol. Sci. 2022 Jul 25. 23(15). 8178. doi: 10.3390/ijms23158178. PMID: 35897752; PMCID: PMC9331414.
- Sheng J.A., Bales N.J., Myers S.A., Bautista A.I., Roueinfar M., Hale T.M., Handa R.J. The Hypothalamic-Pituitary-Adrenal Axis: Development, Programming Actions of Hormones, and Maternal-Fetal Inte–ractions. Front. Behav. Neurosci. 2021 Jan 13. 14. 601939. doi: 10.3389/fnbeh.2020.601939. PMID: 33519393; PMCID: PMC7838595.