Журнал «Здоровье ребенка» Том 19, №1, 2024
Вернуться к номеру
Захворювання горла та ротової порожнини: розчини наносрібла як ключ до успішного лікування
Авторы: Няньковський С.Л. (1), Яцула М.С. (1), Койро О.О. (2)
(1) - Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) - Національний фармацевтичний університет, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
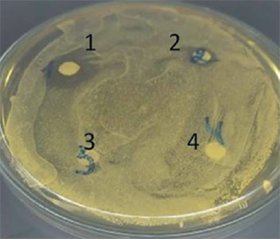
Проаналізовано та узагальнено сучасний стан наукових знань щодо антибактеріальних властивостей наносрібла та екстракту ісландського моху. Вивчено антибактеріальну активність медичного виробу Бріомосс Сільвер Спрей, активними компонентами якого є наносрібло та екстракт ісландського моху. За допомогою диско-дифузійного методу була визначена чутливість типових патогенів, що спричиняють захворювання ротової порожнини та глотки, до розчину Бріомосс Сільвер Спрей різних концентрацій (нативний, розведений стерильним ізотонічним розчином натрію хлориду у співвідношеннях 1 : 1 та 1 : 10). Встановлено, що нативний розчин чинив виражену антибактеріальну дію щодо тестових штамів Streptococcus pyogenes ATCCC 21059 та Staphylococcus aureus ATCCC 25923, а також помірний ефект щодо Streptococcus pneumoniae ATCCC 49619. Діаметр зон затримки росту становив 17,0 ± 2,6 мм, 21,3 ± 1,1 мм та 12,7 ± 0,6 мм відповідно. Антимікробна дія зберігалася при використанні розведення 1 : 1, але не 1 : 10. Таким чином, ефективність медичного виробу Бріомосс Сільвер Спрей проти вказаних патогенів підтверджує його терапевтичний потенціал у лікуванні запальних захворювань горла та ротової порожнини.
The current state of scientific knowledge regarding the antibacterial properties of nanosilver and Iceland moss extract is analyzed and summarized. The antibacterial activity of Briomoss Silver Spray, a medicinal product with active ingredients such as nanosilver and Iceland moss extract, was studied. The susceptibility of common pathogens, responsible for oral cavity and pharynx diseases, to different concentrations of Briomoss Silver Spray solution (native, in a 1 : 1 and 1 : 10 dilutions with sterile isotonic saline solution) was assessed using the disk diffusion method. It was found that the native solution had a pronounced antibacterial effect against the test strains of Streptococcus pyogenes ATCC 21059 and Staphylococcus aureus ATCC 25923 as well as moderate effect against Streptococcus pneumoniae ATCC 49619, with inhibition zones diameters of 17.0 ± 2.6 mm, 21.3 ± 1.1 mm, and 12.7 ± 0.6 mm, respectively. The antimicrobial effect was maintained when using a 1 : 1 dilution, but not 1 : 10. Therefore, the effectiveness of Briomoss Silver Spray, a medicinal product, against these pathogens confirms its therapeutic potential in treating inflammatory diseases of the throat and oral cavity.
наночастинки срібла; екстракт ісландського моху; антимікробна активність; запальні захворювання горла та ротової порожнини
silver nanoparticles; Iceland moss extract; antimicrobial activity; inflammatory diseases of the throat and oral cavity
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Alexander J.W. History of the medical use of silver. Surg. Infect. (Larchmt). 2009. Vol. 10. № 3. P. 289-292.
- Almanza-Reyes H., Moreno S., Plascencia-López I. et al. Evaluation of silver nanoparticles for the prevention of SARS-CoV-2 infection in health workers: In vitro and in vivo. PLoS One. 2021. Vol. 16. № 8. P. e0256401.
- Anderson J., Paterek E. Tonsillitis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2023. URL: https://www.ncbi.nlm.nih.gov/books/NB44342/
- Bruna T., Maldonado-Bravo F., Jara P. et al. Silver nanoparticles and their antibacterial applications. Int. J. Mol. Sci. 2021. Vol. 22. № 13. P. 7202.
- Calò L., Passàli G.C., Galli J. et al. Role of biofilms in chronic inflammatory diseases of the upper airways. Adv. Otorhinolaryngol. 2011. Vol. 72. P. 93-96.
- Chen C.Y., Yin H., Chen X. et al. Ångstrom-scale silver particle-embedded carbomer gel promotes wound healing by inhibiting bacterial colonization and inflammation. Sci. Adv. 2020. Vol. 6. № 43. P. eaba0942.
- Chen M., Shou Z., Jin X. et al. Emerging strategies in nanotechnology to treat respiratory tract infections: realizing current trends for future clinical perspectives. Drug Deliv. 2022. Vol. 29. № 1. P. 2442-2458.
- Chen N., Zheng Y., Yin J. et al. inhibitory effects of silver nanoparticles against adenovirus type 3 in vitro. J. Virol. Methods. 2013. Vol. 193. P. 470-477.
- Clement J.L., Jarrett P.S. Antibacterial silver. Met. Based Drugs. 1994. Vol. 1. № 5–6. P. 467-482.
- Dakal T.C., Kumar A., Majumdar R.S. et al. Mechanistic basis of antimicrobial actions of silver nanoparticles. Front. Microbiol. 2016. Vol. 7. P. 1831.
- Francolini I., Piozzi A., Donelli G. Usnic acid: potential role in management of wound infections. Adv. Exp. Med. Biol. 2019. Vol. 1214. P. 31-41.
- Freysdottir J., Omarsdottir S., Ingólfsdóttir K. et al. In vitro and in vivo immunomodulating effects of traditionally prepared extract and purified compounds from Cetraria islandica. Int. Immunopharmacol. 2008. Vol. 8. № 3. P. 423-430.
- Galdiero S., Falanga A., Vitiello M. et al. Silver nanoparticles as potential antiviral agents. Molecules. 2011. Vol. 16. № 10. P. 8894-8918.
- Gurunathan S., Han J.W., Kwon D.N. et al. Enhanced antibacterial and anti-biofilm activities of silver nanoparticles against Gram-negative and Gram-positive bacteria. Nanoscale Res. Let. 2014. Vol. 9. P. 373.
- Hadrup N., Sharma A.K., Loeschner K. Toxicity of silver ions, metallic silver, and silver nanoparticle materials after in vivo dermal and mucosal surface exposure: A review. Regulatory Toxicology and Pharmacology. 2018. Vol. 98. P. 257-267.
- Jamal M., Ahmad W., Andleeb S. et al. Bacterial biofilm and associated infections. J. Chin. Med. Assoc. 2018. Vol. 81. № 1. P. 7-11.
- Ji J.H., Jung J.H., Kim S.S. et al. Twenty-eight-day inhalation toxicity study of silver nanoparticles in Sprague-Dawley rats. Inhal Toxicol. 2007. Vol. 19. № 10. P. 857-871.
- Kempe C., Grüning H., Stasche N., Hörmann K. Isländisch-Moos-Pastillen zur Prophylaxe bzw. Heilung von oralen Schleimhautirritationen und ausgetrockneter Rachenschleimhaut [Icelandic moss lozenges in the prevention or treatment of oral mucosa irritation and dried out throat mucosa]. Laryngorhinootologie. 1997. Vol. 76. № 3. P. 186-188.
- Khaky B., Yazdannik A., Mahjobipoor H. Evaluating the efficacy of nanosil mouthwash on the preventing pulmonary infection in intensive care unit: a randomized clinical trial. Med. Arch. 2018. Vol. 72. № 3. P. 206-209.
- Krüger K., Töpfner N., Berner R. et al. Clinical practice guideline: Sore throat. Dtsch. Arztebl Int. 2021. Vol. 118. № 11. P. 188-194.
- Kumar S.N., Mohandas C. An antifungal mechanism of protolichesterinic acid from the lichen Usnea albopunctata lies in the accumulation of intracellular ROS and mitochondria-mediated cell death due to apoptosis in Candida tropicalis. Front. Pharmacol. 2017. Vol. 8. P. 301.
- Landsdown A.B.G. Silver in Healthcare: Its antimicrobial efficacy and safety in use. Royal Society of Chemistry; Cambridge, UK, 2010. 217 p.
- Lara H.H., Romero-Urbina D.G., Pierce C. et al. Effect of silver nanoparticles on Candida albicans biofilms: an ultrastructural study. J. Nanobiotechnology. 2015. Vol. 13. P. 91.
- Mallmann E.J., Cunha F.A., Castro B.N. et al. Antifungal activity of silver nanoparticles obtained by green synthesis. Rev. Inst. Med. Trop. Sao Paulo. 2015. Vol. 57. № 2. P. 165-167.
- Menichetti A., Mavridi-Printezi A., Mordini D., Montalti M. Effect of size, shape and surface functionalization on the antibacterial acti–vity of silver nanoparticles. J. Funct. Biomater. 2023. Vol. 14. № 5. P. 244.
- Mussin J., Giusiano G. Biogenic silver nanoparticles as antifungal agents. Front. Chem. 2022. Vol. 10. P. 1023542.
- Nakamura S., Sato M., Sato Y. et al. Synthesis and application of silver nanoparticles (Ag-NPs) for the prevention of infection in healthcare workers. Int. J. Mol. Sci. 2019. Vol. 20. P. 3620.
- Naumenko K., Zahorodnia S., Pop C.V., Rizun N. Antiviral activity of silver nanoparticles against the influenza A virus. J. Virus Erad. 2023. Vol. 9. № 2. P. 100330.
- Paju S., Scannapieco F.A. Oral biofilms, periodontitis, and pulmonary infections. Oral Dis. 2007. Vol. 13. № 6. P. 508-512.
- Plants medicinal. WHO Consultation on selected medicinal plants. Salerno-Paestum, 2005. 246 р.
- Pompilio A., Geminiani C., Bosco D. et al. Electrochemically synthesized silver nanoparticles are active against planktonic and biofilm cells of Pseudomonas aeruginosa and other cystic fibrosis-associated bacterial pathogens. Front. Microbiol. 2018. Vol. 9. P. 1349.
- Rizzello L., Pompa P.P. Nanosilver-based antibacterial drugs and devices: mechanisms, methodological drawbacks, and guidelines. Chem. Soc. Rev. 2014. Vol. 43. № 5. P. 1501-1518.
- Salleh A., Naomi R., Utami N.D. et al. The potential of silvernanoparticles for antiviral and antibacterial applications: A mechanism of action. Nanomaterials. 2020. Vol. 10. P. 1566.
- Shahverdy A.R., Fakhimi A., Minaian S. Synthesis and effect of silver nanopracles on the antibacterial activity of different antibiotics against Staphylococcus and Escherichia coli. Nanomedicine. 2007. Vol. 3. P. 168-171.
- Shivanna V., Dasegowda V. Comparison of disk diffusion and agar dilution method for the detection of mupirocin resistance in staphylococcal isolates from skin and soft tissue infections. J. Lab. Physicians. 2023. Vol. 15. № 3. P. 372-376.
- Solanki R., Shankar A., Modi U., Patel S. New insights from nanotechnology in SARS-CoV-2 detection, treatment strategy, and prevention. Mater. Today Chem. 2023. Vol. 29. P. 101478.
- Sung J.H., Ji J.H., Song K.S. et al. Acute inhalation toxi–city of silver nanoparticles. Toxicol. Ind. Health. 2011. Vol. 27. № 2. P. 149-154.
- Tăbăran A.F., Matea C.T., Mocan T. et al. Silver nanoparticles for the therapy of tuberculosis. Int. J. Nanomedicine. 2020. Vol. 15. P. 2231-2258.
- Türk A.O., Yilmaz M., Kivanç M., Türk H. The antimicrobial activity of extracts of the lichen Cetraria aculeata and its protolichesterinic acid constituent. Z. Naturforsch C. J. Biosci. 2003. Vol. 58. № 11-12. P. 850-854.
- Vorberg G. Erfahrungsbericht: Flechtenwirkstoffe lindern Reizzustände der 16. Atemwege: Noben den entzündungshemmenden Eigenschaften wirkt sich der Schleimhautschutz besonders günstig aus. Ärztliche Praxis. 1981. Vol. 5. P. 3068.
- Wieler L., Vittos O., Mukherjee N., Sarkar S. Reduction in the COVID-19 pneumonia case fatality rate by silver nanoparticles: A randomized case study. Heliyon. 2023. Vol. 9. № 3. P. e14419.
- Wolford R.W., Goyal A., Belgam Syed S.Y. et al. Pharyngitis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. URL: https://www.ncbi.nlm.nih.gov/books/NBK519550/
- Xia Z.K., Ma Q.H., Li S.Y. et al. The antifungal effect of silver nanoparticles on Trichosporon asahii. J. Microbiol. Immunol. Infect. 2016. Vol. 49. № 2. P. 182-188.
- Yilmaz M., Türk A.O., Tay T., Kivanç M. The antimicrobial activity of extracts of the lichen Cladonia foliacea and its (-)-usnic acid, atranorin, and fumarprotocetraric acid constituents. Z. Naturforsch. C. J. Biosci. 2004. Vol. 59. № 3–4. P. 249-254.
- Yin I.X., Zhang J., Zhao I.S. et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. Int. J. Nanomedicine. 2020. Vol. 15. P. 2555-2562.
- Клінічна настанова, заснована на доказах. Тонзиліт. 2021. URL: https://www.dec.gov.ua/wp-content/uploads/2021/04/2021_639_kn_tonzylit.pdf.
- Недашківська В., Дронова М., Вринчану Н. Біоплівки та їх роль в інфекційних захворюваннях. Український науково-медичний молодіжний журнал. 2016. Т. 4. № 98. С. 10-19.
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги. Тонзиліт. 2021. URL: https://www.dec.gov.ua/wp-content/uploads/2021/04/2021_639_ykpmd_tonzylit_dd.pdf.

/11.jpg)
/12.jpg)