Международный эндокринологический журнал Том 20, №4, 2024
Вернуться к номеру
Роль проадреномедуліну в прогресуванні діабетичної хвороби нирок у пацієнтів із цукровим діабетом 2-го типу
Авторы: Урбанович А.М., Верещинська А.П.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
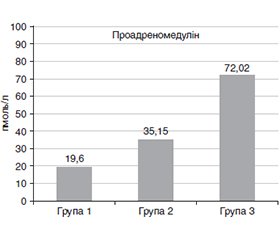
Актуальність. Цукровий діабет 2-го типу (ЦД2) є хронічним захворюванням, поширеність якого щорічно зростає. Метаболічні зміни та запалення, спричинені гіперглікемією при ЦД2, призводять до погіршення функціонального стану нирок. Діабетична хвороба нирок (ДХН) — поширене ускладнення ЦД2 та провідна причина термінальної стадії ниркової недостатності. Ми досліджували прогностичну цінність проадреномедуліну (Pro-ADM) як нетрадиційного біомаркера прогресування ниркових порушень у пацієнтів з ЦД2. Мета: дослідити роль проадреномедуліну в прогресуванні діабетичної хвороби нирок в осіб із цукровим діабетом 2-го типу. Матеріали та методи. Обстежено 86 пацієнтів з ЦД2 та ДХН. Дослідження проводилося на клінічній базі кафедри ендокринології Львівського національного медичного університету ім. Данила Галицького — у Львівському обласному державному клінічному лікувально-діагностичному ендокринологічному центрі. Пацієнтів розділено на 3 групи відповідно до ступенів ризику прогресування ДХН. Крім стандартних клініко-лабораторних обстежень, хворим вимірювали концентрацію Pro-ADM у сироватці крові. Отримані цифрові дані оброблено статистично, з оцінкою рівня вірогідності та кореляційних взаємозв’язків. Результати. Рівень Pro-ADM в усіх досліджуваних пацієнтів з ЦД2 та ДХН значно змінювався залежно від ступеня прогресування ДХН. У групі 1 рівень Pro-ADM становив 19,65 ± 0,98 пмоль/л, у групі 2 — 35,15 ± 2,46 пмоль/л, а у групі 3 — 72,02 ± 2,82 пмоль/л. Результати показали вірогідне підвищення рівня Pro-ADM відповідно до прогресування ДХН (р < 0,001). Проведено кореляційний аналіз між Pro-ADM і віком пацієнтів, тривалістю захворювання, рівнем глікованого гемоглобіну (HbA1c), загальним холестерином, сечовиною, креатиніном, рШКФ, альбумін-креатиніновим співвідношенням (САК). Виявлено у групі 1 прямий слабкий кореляційний зв’язок Pro-ADM з віком (R = 0,02; p < 0,01); рівнем холестерину (R = 0,03; p > 0,05); сечовини (R1 = 0,17; p < 0,01); креатиніном (R = 0,12; р < 0,01); САК (R = 0,16; p < 0,01). Прямий помірний кореляційний зв’язок спостерігався зі тривалістю ЦД2 (R = 0,39; p < 0,05) та рівнем HbA1c (R = 0,31; p < 0,05). Також визначено помірний зворотний зв’язок з рШКФ (R = –0,51; p < 0,01). У групі 2 спостерігався прямий слабкий кореляційний зв’язок Pro-ADM з віком (R = 0,12; p < 0,01); тривалістю ЦД2 (R = 0,28; p < 0,05); рівнем загального холестерину (R = 0,06; p > 0,05) та сечовини (R = 0,06; p > 0,05). Прямий помірний кореляційний зв’язок спостерігався з рівнем HbA1c (R = 0,31; p < 0,05); креатиніну (R = 0,47; р < 0,01) та САК (R = 0,32; p < 0,01). Також виявлено помірний зворотний зв’язок з рШКФ (R = –0,33; p < 0,01). У групі 3 визначався прямий слабкий кореляційний зв’язок Pro-ADM з тривалістю ЦД2 (R = 0,24; p < 0,05) та рівнем загального холестерину (R = 0,19; p > 0,05). Прямий помірний кореляційний зв’язок прослідковувався з віком (R = 0,53; p < 0,01); з рівнем HbA1c (R = 0,33; p < 0,05); сечовини (R = 0,42; p > 0,05); креатиніну (R = 0,34; р < 0,01) та САК (R = 0,36; p < 0,01). Також виявлено сильний зворотний зв’язок з рШКФ (R = –0,71; p < 0,01). Висновки. Виявлено вірогідне підвищення рівня Pro-ADM у пацієнтів з ЦД2 залежно від прогресування ДХН. Виявлені кореляційні зв’язки між Pro-ADM та клінічними показниками ЦД2 й функціонального стану нирок свідчать про те, що рівень Pro-ADM пов’язаний з прогресуванням ДХН. Ці результати вказують на важливість визначення Pro-ADM як потенційного маркера для оцінки прогресування ниркових порушень у пацієнтів з ЦД2.
Background. Type 2 diabetes mellitus (T2DM) is a chronic disease with increasing prevalence. Metabolic changes and inflammation caused by hyperglycemia in T2DM lead to deterioration of kidney function. Diabetic kidney disease (DKD), a common complication of T2DM, is a leading cause of end-stage renal disease. We investigated the prognostic value of proadrenomedullin (Pro-ADM) as an unconventional biomarker of renal impairment progression in patients with T2DM. The purpose was to investigate the role of proadrenomedullin in the progression of DKD in people with T2DM. Materials and methods. Eighty-six patients with T2DM and DKD were examined. The study was conducted at the Lviv Regional State Clinical Medical and Diagnostic Endocrinological Center, a clinical base of the Department of Endocrinology of the Danylo Halytsky Lviv National Medical University. Patients were divided into 3 groups according to the degrees of DKD risk progression. In addition to standardized clinical and laboratory tests, the concentration of Pro-ADM in blood serum was evaluated. The obtained data were processed statistically with an assessment of probability and correlation. Results. The level of Pro-ADM in patients with T2DM and DKD varied statistically significant depending on the risk of DKD progression. In group 1, its average content was 19.65 ± 0.98 pmol/l, in group 2 — 35.15 ± 2.46 pmol/l, and in group 3 — 72.02 ± 2.82 pmol/l. The results showed a significant increase in Pro-ADM with DKD progression (p < 0.001). A correlation analysis was performed between Pro-ADM and patients’ age, duration of disease, HbA1c, total cholesterol, urea, creatinine, estimated glomerular filtration rate (eGFR) levels, and albumin-creatinine ratio (ACR). In group 1, a positive weak correlation was found between Pro-ADM and age (R = 0.02; p < 0.01); cholesterol (R = 0.03; p > 0.05); urea (R1 = 0.17; p < 0.01); creatinine levels (R = 0.12; p < 0.01); and ACR (R = 0.16; p < 0.01). There was a positive moderate correlation with the duration of T2DM (R = 0.39; p < 0.05) and HbA1c level (R = 0.31; p < 0.05) and a moderate negative correlation with eGFR (R = –0.51; p < 0.01). In group 2, a positive weak correlation of Pro-ADM with age (R = 0.12; p < 0.01); duration of T2DM (R = 0.28; p < 0.05); cholesterol (R = 0.06; p > 0.05), and urea levels (R = 0.06; p > 0.05) was observed. There was a positive moderate correlation with HbA1c (R = 0.31; p < 0.05); creatinine (R = 0.47; p < 0.01) levels, and ACR (R = 0.32; p < 0.01). A moderate inverse correlation with eGFR was also found (R = –0.33; p < 0.01). In group 3, a positive weak correlation of Pro-ADM with the duration of T2DM (R = 0.24; p < 0.05), and total cholesterol level (R = 0.19; p > 0.05) was observed. A positive moderate correlation with age (R = 0.53; p < 0.01); HbA1c (R = 0.33; p < 0.05), urea (R = 0.42; p > 0.05), creatinine levels (R = 0.34; p < 0.01), and ACR (R = 0.36; p < 0.01) was found. There was also a negative strong correlation with eGFR (R = –0.71; p < 0.01). Conclusions. We found a significant increase in Pro-ADM level in patients with T2DM depending on the progression of DKD. The revealed correlations between Pro-ADM and clinical parameters of T2DM and the functional state of the kidneys indicate that the level of Pro-ADM is associated with the progression of DKD. These results show the importance of identifying Pro-ADM as a potential marker for assessing the progression of renal impairment in patients with T2DM.
цукровий діабет 2-го типу; діабетична хвороба нирок; функціональний стан нирок; проадреномедулін
type 2 diabetes mellitus; diabetic kidney disease; functional state of kidneys; proadrenomedullin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Wang H, Li N, Chivese T, Werfalli M, Sun H, Yuen L, et al.; IDF Diabetes Atlas Committee Hyperglycaemia in Pregnancy Special Interest Group. IDF Diabetes Atlas: Estimation of Global and Regional Gestational Diabetes Mellitus Prevalence for 2021 by International Association of Diabetes in Pregnancy Study Group’s Criteria. Diabetes Res Clin Pract. 2022 Jan;183:109050. doi: 10.1016/j.diabres.2021.109050. Epub 2021 Dec 6. PMID: 34883186.
- Mora T, Roche D, Rodríguez-Sanchez B. Predicting the onset of diabetes-related complications after a diabetes diagnosis with machine learning algorithms. Diabetes Research and Clinical Practice 2023 (204):110910. https://doi.org/10.1016/j.diabres.2023.110910.
- Urbanovych A, Vereshchynska A. Pathophysiological features of thyroid dysfunction in patients with type 2 diabetes and chronic kidney disease (a literature review and own observations). International Journal of Endocrinology (Ukraine). 2024;19(8):573-8. doi: 10.22141/2224-0721.19.8.2023.1340.
- Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2022 Nov;102(5S):S1-S127. doi: 10.1016/j.kint.2022.06.008. PMID: 36272764.
- Rico-Fontalvo J, Aroca G, Cabrales J, Daza-Arnedo R, et al. Molecular Mechanisms of Diabetic Kidney Disease. Int. J. Mol. Sci. 2022;23:8668. doi.org/10.3390/ijms23158668.
- Tuttle KR, Bakris GL, Bilous RW, Chiang JL, de Boer IH, et al. Diabetic kidney disease: a report from an ADA Consensus Conference. Diabetes Care. 2014 Oct;37(10):2864-83. doi: 10.2337/dc14-1296.
- Colhoun HM, Marcovecchio ML. Biomarkers of diabetic kidney disease. Diabetologia. 2018;61:996-1011. doi.org/10.1007/s00125-018-4567-5.
- Jung CY, Yoo TH. Pathophysiologic Mechanisms and Potential Biomarkers in Diabetic Kidney Disease. Diabetes Metab J. 2022 Mar;46(2):181-197. doi: 10.4093/dmj.2021.0329. Epub 2022 Mar 24.
- Gohda T, Murakoshi M, Suzuki Y, Kagimura T, Wada T, Narita T. Effect of proteinuria on the rapid kidney function decline in chronic kidney disease depends on the underlying disease: A post hoc analysis of the BRIGHTEN study. Diabetes Research and Clinical Practice. 2024;212. doi.org/10.1016/j.diabres.2024.111682.
- Sujana C, Salomaa V, Kee F, et al. Associations of the vasoactive peptides CT-proET-1 and MR-proADM with incident type 2 diabetes: results from the BiomarCaRE Consortium. Cardiovasc Diabetol. 2022;21:99. doi.org/10.1186/s12933-022-01513-9.
- Saulnier PJ, Gand E, Velho G, Mohammedi K, Zaoui P, Fraty M, et al.; SURDIAGENE Study Group. Association of Circulating Biomarkers (Adrenomedullin, TNFR1, and NT-proBNP) With Renal Function Decline in Patients With Type 2 Diabetes: A French Prospective Cohort. Diabetes Care. 2017 Mar;40(3):367-374. doi: 10.2337/dc16-1571. Epub 2016 Dec 20. PMID: 27998909.
- Waked E, Bendary OEL, Metwaly A, et al. Adrenomedullin in patients with type 2 diabetes and kidney disease. African Journal of Nephrology. 2009;13:19-25. DOI: https://doi.org/10.21804/13-1-775.
- Кotsiubiichuk Z, Khukhlina O, Аntoniv А, Mandryk O. Influence of non-alcoholic steatohepatitis on the renal functional status in patients with type 2 diabetes and diabetic kidney disease. International Journal оf Endocrinology (Ukraine). 2023;19(2):100-105. https://doi.org/10.22141/2224-0721.19.2.2023.1253.
- Czajkowska K, Zbroch E, Bielach-Bazyluk A, Mitrosz K, Bujno E, et al. Mid-Regional Proadrenomedullin as a New Biomarker of Kidney and Cardiovascular Diseases — Is It the Future? J Clin Med. 2021;10(3):524. doi: 10.3390/jcm10030524.
- Katerenchuk I, Rustamyan S, Talash V, Yarmola T. Hormonal imbalance in patients with chronic kidney disease in the pre-dialysis and dialysis periods (part 2). International Journal оf Endocrinology (Ukraine). 2023;19(4):312-318. https://doi.org/10.22141/2224-0721.19.4.2023.1292.
- Velho G, Ragot S, Mohammedi K, Gand E, Fraty M, et al.; Plasma Adrenomedullin and Allelic Variation in the ADM Gene and Kidney Disease in People with Type 2 Diabetes. Diabetes. 2015;64(9):3262-3272. doi.org/10.2337/db14-1852.
- Didushko O. Type 2 diabetes mellitus and chronic kidney di–sease: modern opportunities for antihyperglycemic therapy. International Journal оf Endocrinology (Ukraine). 2020;16(3):251-256. https://doi.org/10.22141/2224-0721.16.3.2020.205275.
- de Boer IH, Khunti K, Sadusky T, Tuttle KR, Neumiller JJ, Rhee CM, et al. Diabetes management in chronic kidney disease: a consensus report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Diabetes Care. 2022 Dec 1;45(12):3075-90. doi: 10.2337/dci22-0027.
- Nordheim E, Geir Jenssen T. Chronic kidney di–sease in patients with diabetes mellitus. Endocr Connect. 2021 Apr 29;10(5):R151-R159. doi: 10.1530/EC-21-0097. PMID: 33830068; PMCID: PMC8111312.
- Kumar M, Dev S, Khalid MU, Siddenthi SM, Noman M, John C, et al. The Bidirectional Link Between Diabetes and Kidney Disease: Mechanisms and Management. Cureus. 2023 Sep 20;15(9):e45615. doi: 10.7759/cureus.45615. PMID: 37868469; PMCID: PMC10588295.