Журнал «Здоровье ребенка» Том 19, №6, 2024
Вернуться к номеру
Актуальні питання етіології, наслідків та лікування вторинної лактазної недостатності у дітей: огляд літератури і результати власних досліджень
Авторы: Марушко Ю.В., Дмитришин О.А., Бовкун О.А., Іовіца Т.В., Дмитришин Б.Я.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Стаття присвячена огляду та узагальненню сучасних даних наукових публікацій, що належать до наукометричних баз Scopus, Web of Science, реєстру фахових наукових видань України, щодо причин, наслідків та методів корекції вторинної лактазної недостатності у дітей. Описано особливості розвитку вторинної лактазної недостатності при антибіотикотерапії, а також інші патологічні зміни стану шлунково-кишкового тракту, що розвиваються при застосуванні антибактеріальних препаратів. Наведено власні дані щодо лікування вторинної лактазної недостатності у дітей шкільного віку, що розвинулась на фоні антибіотикотерапії. Встановлено, що застосування ферменту лактази дітям з вторинною лактазною недостатністю, що виникла на фоні антибіотикотерапії, призводить до позитивної динаміки її клінічних проявів вже на 3-й день прийому препарату, а також є більш ефективним методом корекції таких симптомів порівняно з призначенням лише дієтичних рекомендацій та обмеженого вживання продуктів з лактозою. Запропоновано критерії призначення водневого дихального тесту як методу діагностики вторинної лактазної недостатності, що розвинулась на фоні прийому антибіотиків: наявність клінічних проявів (діарея, біль у животі, підвищене газоутворення, здуття живота, нудота, блювання), що виникли під час антибіотикотерапії, і зокрема посилюються при вживанні лактозовмісних продуктів; повторні курси прийому антибактеріальних препаратів (кожні 3–4 місяці) згідно з даними анамнезу; зміни результатів копрограми (жовтий, кашкоподібний, пінистий кал з кислим запахом, наявність слизу, рН калу менше за 5,5, невелика кількість йодофільної флори); відсутність проявів запального ураження кишечника за результатами копрограми (кров, лейкоцити); негативні результати швидких тестів для виявлення токсинів А і В Clostridium difficile у фекаліях. Застосування цих критеріїв для діагностики вторинної лактазної недостатності, асоційованої з прийомом антибіотиків, дозволить підвищити частоту її виявлення і обґрунтованого призначення препаратів лактази з метою зменшення вираженості клінічних проявів лактазної недостатності та швидшого відновлення функціонального стану шлунково-кишкового тракту.
The article presents the review and synthesis of modern data of scientific publications from the Scopus, Web of Science databases, and the register of professional scientific publications of Ukraine on the causes, consequences, and methods of correcting secondary lactase deficiency in children. The features of secondary lactase deficiency in antibiotic therapy and other pathological changes in the gastrointestinal tract that develop with the use of antibacterial drugs are described. The authors present their own data on the treatment of secondary lactase deficiency caused by antibiotic therapy in school-age children. It has been found that the use of the lactase enzyme in children with secondary lactase deficiency, which has developed on the background of antibiotic therapy, leads to positive dynamics of clinical manifestations already on the third day of taking the drug, and it is a more effective method of correcting these symptoms compared to only dietary recommendations and limited consumption of lactose products. The criteria proposed for prescribing a hydrogen breath test to diagnose secondary lactase deficiency developed on the background of antibiotics are as follows: the presence of clinical manifestations (diarrhea, abdominal pain, excessive gas, bloating, nausea, vomiting) that occurred during antibiotic therapy and are aggravated by the use of lactose-containing products; repeated courses of antibacterial drugs (every 3–4 months) according to the anamnesis; changes in the results of the coprogram (yellow, mushy, foamy feces with an acidic odor, the presence of mucus, fecal pH less than 5.5, a small amount of iodophilic flora); no signs of inflammatory bowel disease according to the results of the coprogram (blood, leukocytes); negative results of rapid tests for the detection of Clostridium difficile toxins A and B in the feces. The use of these criteria to diagnose secondary lactase deficiency associated with antibiotics will improve the frequency of its detection and the reasonable prescription of lactase drugs to reduce the severity of clinical manifestations of lactase deficiency and restore the functional state of the gastrointestinal tract more quickly.
вторинна лактазна недостатність; водневий дихальний тест; антибіотикотерапія; лактаза; діти; огляд
secondary lactase deficiency; hydrogen breath test; antibiotic therapy; lactase; children; review
Вступ
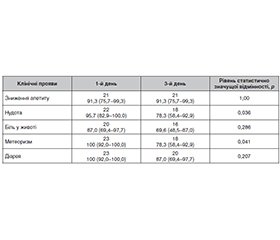
/59.jpg)
Висновки
- Chengolova Z, Ivanova R, Gabrovska K. Lactose Intolerance — Single Nucleotide Polymorphisms and Treatment. J Am Nutr Assoc. 2024 Feb;43(2):213-220. doi: 10.1080/27697061.2023.2251557.
- Олексієнко Я.І., Шахматов В.А., Верещагіна О.П. Харчування та його вплив на здоров’я людини: навчально-методичний посібник. Черкаси: ПП Чабаненко Ю.А., 2014. 42 с.
- Волошина Л.Г., Бєлоусова О.Ю., Бабаджанян О.М. та ін. Використання лактази в купіруванні синдрому хронічної діареї в дітей. Zdorov’e Rebenka. 2020;15(5):346-351. doi: 10.22141/2224-0551.15.5.2020.211444.
- Марушко Ю.В., Іовіца Т.В. Підходи до терапії транзиторної лактазної недостатності у дітей грудного віку. Sovremennaya Рediatriya. 2016;2(74):26-30. doi: 10.15574/SP.2016.74.26.
- Єсипова С.І. Діагностика лактазної недостатності та ведення дітей з цією патологією (огляд літератури та власні дані). Likarska Sprava. 2018;2019 (5/6):15-22. https://doi.org/10.31640/JVD.5-6.2018(2).
- Строй О.А., Сліпачук Л.В., Антошкіна А.М., Казакова Л.М. Корекція лактазної недостатності в дітей грудного віку з проявами алергії на харчові продукти. Актуальні питання педіатрії, акушерства та гінекології. 2017;2:15-20. doi: 10.11603/24116-4944.2017.2.7796.
- Di Costanzo M, Berni Canani R. Lactose Intolerance: Common Misunderstandings. Ann Nutr Metab. 2018;73 Suppl 4:30-37. doi: 10.1159/000493669.
- Sharikadze O. Malabsorption and lactose intolerance: pathophysiology, diagnosis and treatment of pathogenesis. World Science. 2022 Apr.12; 3(75). doi: 10.31435/rsglobal_ws/30042022/7804.
- Darma A, Sumitro KR, Jo J, Sitorus N. Lactose Intolerance versus Cow’s Milk Allergy in Infants: A Clinical Dilemma. Nutrients. 2024 Jan 31;16(3):414. doi: 10.3390/nu16030414.
- Hu Y, Gui L, Chang J, Liu J, Xu S, Deng C, Yu F, Ma Z, Wang G, Zhang C. The incidence of infants with rotavirus enteritis combined with lactose intolerance. Pak J Pharm Sci. 2016 Jan;29(1 Suppl):321-3.
- Леженко Г.О., Усачова О.В., Тарасенко Н.В., Пашкова О.Є. Сучасні погляди на ротавірусну інфекцію у дітей: епідеміологічні та клініко-патогенетичні особливості. Актуальна інфектологія. 2014;2(3):12-17.
- Воробйова Н.В., Усачова О.В. Лабораторні ознаки маль–абсорбції вуглеводів у дітей раннього віку з ротавірусною інфекцією. Pathologia. 2021;18(1):72-79. https://doi.org/10.14739/2310-1237.2021.1.228925.
- Long CX, He L, Guo YF, Liu YW, Xiao NQ, Tan ZJ. Diversity of bacterial lactase genes in intestinal contents of mice with antibiotics-induced diarrhea. World J Gastroenterol. 2017 Nov 14;23(42):7584-7593. doi: 10.3748/wjg.v23.i42.7584.
- Bhatia J, Prihoda AR, Richardson CJ. Parenteral antibio–tics and carbohydrate intolerance in term neonates. Am J Dis Child. 1986 Feb;140(2):111-3. doi: 10.1001/archpedi.1986.02140160029022.
- Evans J, Hanoodi M, Wittler M. Amoxicillin Clavulanate. 2023 Aug 16. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 30844191.
- Dahiya D, Nigam PS. Antibiotic-Therapy-Induced Gut Dysbiosis Affecting Gut Microbiota-Brain Axis and Cognition: Restoration by Intake of Probiotics and Synbiotics. Int J Mol Sci. 2023 Feb 4;24(4):3074. doi: 10.3390/ijms24043074.
- Ramirez J, Guarner F, Bustos Fernandez L, Maruy A, Sdepanian VL, Cohen H. Antibiotics as Major Disruptors of Gut Microbiota. Front Cell Infect Microbiol. 2020 Nov 24;10:572912. doi: 10.3389/fcimb.2020.572912.
- Kho ZY, Lal SK. The Human Gut Microbiome — A Potential Controller of Wellness and Disease. Front Microbiol. 2018 Aug 14;9:1835. doi: 10.3389/fmicb.2018.01835.
- Lathakumari R.H., Vajravelu L.K., Satheesan A., Ravi S., Thulukanam J. Antibiotics and the gut microbiome: Understanding the impact on human health. Medicine in Microecology. 2024 Apr 8:100106. https://doi.org/10.1016/j.medmic.2024.100106.
- Patangia DV, Anthony Ryan C, Dempsey E, Paul Ross R, Stanton C. Impact of antibiotics on the human microbiome and consequences for host health. Microbiologyopen. 2022 Feb;11(1):e1260. doi: 10.1002/mbo3.1260.
- Meng X, Zhang G, Cao H, Yu D, Fang X, de Vos WM, Wu H. Gut dysbacteriosis and intestinal disease: mechanism and treatment. J Appl Microbiol. 2020 Oct;129(4):787-805. doi: 10.1111/jam.14661.
- Марушко Ю.В., Гищак Т.В., Московенко О.Д., Іовиця Т.В. Клініко-інструментальне оцінювання стану кишечнику у дітей з респіраторною патологією та корекція виявлених порушень. Семейная медицина. 2018;6 (80):43-48.
- Högenauer C, Hammer HF, Krejs GJ, Reisinger EC. Mechanisms and management of antibiotic-associated diarrhea. Clin Infect Dis. 1998 Oct;27(4):702-10. doi: 10.1086/514958.
- Ткаченко Т.В., Мостовой Ю.М. Антибіотико-асоційована діарея: клініка, діагностика і лікування. Biomedical and Biosocial Anthropology. 2015;24:191-196.
- Закордонец Л.В., Крамарев С.А., Береговая Т.В., Толстанова А.Н., Довбинчук Т.В. Антибіотик-асоційована діарея: механізми розвитку і можливості корекції. Zdorov’e Rebenka. 2013;7(50):69-73.
- Марушко Ю.В., Дмитришин О.А., Дмитришин Б.Я., Бовкун О.А., Іовіца Т.В. Роль урсодезоксихолевої кислоти в терапії захворювань гепатобіліарного тракту у дітей. Modern Pediatrics. Ukraine. 2022;5(125):84-92. doi: 10.15574/SP.2022.125.84.
- Марушко Ю.В., Грачова М.Г., Іовіца Т.В. Актуальні питання діагностики та терапії вторинної лактазної недостатності у дітей. Sovremennaya Рediatriya. 2015;1(65):110-114. doi: 10.15574/SP.2015.65.110.
- Vandenplas Y. Lactose intolerance. Asia Pac J Clin Nutr. 2015;24 Suppl 1:S9-13. doi: 10.6133/apjcn.2015.24.s1.02.
- Montoro-Huguet MA, Belloc B, Domínguez-Cajal M. Small and Large Intestine (I): Malabsorption of Nutrients. Nutrients. 2021 Apr 11;13(4):1254. doi: 10.3390/nu13041254.
- Чернявський В.В., Павловський, Л.Л., Тищенко В.В. Синдром підвищеної проникності кишечника в загальній клінічній практиці. Сучасна гастроентерологія. 2020;3:91-95. doi: http://doi.org/10.30978/MG-2020-3-91.
- Aleman RS, Moncada M, Aryana KJ. Leaky Gut and the Ingredients That Help Treat It: A Review. Molecules. 2023 Jan 7;28(2):619. doi: 10.3390/molecules28020619.
- France MM, Turner JR. The mucosal barrier at a glance. J Cell Sci. 2017 Jan 15;130(2):307-314. doi: 10.1242/jcs.193482.
- Obrenovich MEM. Leaky Gut, Leaky Brain? Microorganisms. 2018 Oct 18;6(4):107. doi: 10.3390/microorganisms6040107.
- Camilleri M, Vella A. What to do about the leaky gut. Gut. 2022 Feb;71(2):424-435. doi: 10.1136/gutjnl-2021-325428.
- Cappello F., Rappa F., Canepa F., et al. Probiotics can cure oral aphthous-like ulcers in inflammatory bowel disease patients: A review of the literature and a working hypothesis. Int. J. Mol. Sci. 2019;20:5026. doi: 10.3390/ijms20205026.
- Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019 Aug;68(8):1516-1526. doi: 10.1136/gutjnl-2019-318427.
- Toca MDC, Fernández A, Orsi M, Tabacco O, Vinderola G. Lactose intolerance: myths and facts. An update. Arch Argent Pediatr. 2022 Feb;120(1):59-66. English, Spanish. doi: 10.5546/aap.2022.eng.59.
- Szajewska H, Canani RB, Guarino A, еt al.; ESPGHAN Wor–king Group for ProbioticsPrebiotics. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children. J Pediatr Gastroenterol Nutr. 2016 Mar;62(3):495-506. doi: 10.1097/MPG.0000000000001081.
- Baù M, Moretti A, Bertoni E, Vazzoler V, Luini C, Agosti M, Salvatore S. Risk and Protective Factors for Gastrointestinal Symptoms associated with Antibiotic Treatment in Children: A Population Study. Pediatr Gastroenterol Hepatol Nutr. 2020 Jan;23(1):35-48. doi: 10.5223/pghn.2020.23.1.35.
- Katoch GK, Nain N, Kaur S, Rasane P. Lactose Intolerance and Its Dietary Management: An Update. J Am Nutr Assoc. 2022 May-Jun;41(4):424-434. doi: 10.1080/07315724.2021.1891587.
- Romero-Velarde E, Delgado-Franco D, García-Gutiérrez M, Gurrola-Díaz C, Larrosa-Haro A, Montijo-Barrios E, Muskiet FAJ, Vargas-Guerrero B, Geurts J. The Importance of Lactose in the Human Diet: Outcomes of a Mexican Consensus Meeting. Nutrients. 2019 Nov 12;11(11):2737. doi: 10.3390/nu11112737.
- Марушко Ю.В., Єсипова С.І. Проблема лактазної недостатності: діагностика та підходи до лікування у дітей. Сімейна медицина. Європейські практики. 2023;3(105):29-34. doi: 10.30841/2786-720x.3.2023.289337.
- Shaukat A, Levitt MD, Taylor BC, MacDonald R, Shamliyan TA, Kane RL, Wilt TJ. Systematic review: effective management stra–tegies for lactose intolerance. Ann Intern Med. 2010 Jun 15;152(12):797-803. doi: 10.7326/0003-4819-152-12-201006150-00241.
- Misselwitz B, Butter M, Verbeke K, et al. Update on lactose malabsorption and intolerance: pathogenesis, diagnosis and clinical management. Gut. 2019;68:2080-2091. https://doi.org/10.1136/gutjnl-2019-318404.
- Lactose Intolerance. American College of Gastroenterology. ACG 2024. Available from: https://gi.org/topics/lactose-intolerance-in-children/. Accessed: June 21, 2024.
- Search results. Compendium drug reference book. Available from: https://compendium.com.ua/uk/result/?term = %D0 %BC %D0 %B0 %D0 %BC %D0 %B0 %D0 %BB %D0 %B0 %D0 %BA %20. Accessed: June 25, 2024.
- Hammer HF, Fox MR, Keller J, et al.; European H2-CH4-breath test group. European guideline on indications, performance, and clinical impact of hydrogen and methane breath tests in adult and pediatric patients: European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Neurogastroenterology and Motility, and European Society for Paediatric Gastroenterology Hepatology and Nutrition consensus. United European Gastroenterol J. 2022 Feb;10(1):15-40. doi: 10.1002/ueg2.12133.

/58.jpg)