Журнал «Травма» Том 25, №4, 2024
Вернуться к номеру
Ін’єкційні SYSADOA в системі лікування післятравматичного остеоартриту
Авторы: Бур’янов О.А., Омельченко Т.М.
Національний медичний університет імені О.О. Богомольця МОЗ України, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
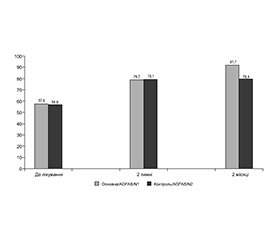
Актуальність. Незважаючи на неоднозначність і дискутабельність сучасних поглядів на застосування у базисній терапії остеоартриту препаратів SYSADOA (Symptomatic Slow Acting Drugs in Osteo-Arthritis), у численних дослідженнях було показано, що раннє призначення цих препаратів є безпечним та ефективним, а в поєднанні з протизапальним лікуванням дає кращий результат і дозволяє запобігти дегенеративному й запальному пошкодженню суглобового хряща. Існують вимоги до SYSADOA для включення їх до рекомендацій і протоколів лікування остеоартриту, дані препарати повинні бути зареєстрованими лікарськими засобами (рецептурними фармакологічними препаратами) з відповідною сертифікацією щодо складу, якості й безпечності при тривалому застосуванні, використанні в пацієнтів з мультиморбідністю, а також при прийомі з іншими ліками. Форма випуску повинна забезпечувати найкращий комплаєнс. Мета: оцінити клінічну ефективність і безпеку застосування ін’єкційної форми SYSADOA, а саме глюкозаміну сульфату, у лікуванні пацієнтів з післятравматичним остеоартрозом надп’ятково-гомілкового суглоба ранніх стадій (І–ІІ за Келлгреном і Лоуренсом) після хірургічного лікування з приводу переломів кісточок гомілки давністю від 6 місяців до 2 років. Матеріали та методи. Проведене клінічне дослідження за дизайном є порівняльним проспективним контрольованим у паралельних групах з рівнем доказовості ІІb. Пацієнти основної групи (N1 = 20) були оперовані з приводу травми і мали рентгенологічно й клінічно підтверджений діагноз: післятравматичний остеоартроз надп’ятково-гомілкового суглоба І–ІІ стадії (за Келлгреном і Лоуренсом). З метою ліквідації явищ загострення остеоартрозу пацієнтам призначався курс нестероїдних протизапальних препаратів (НПЗП) із застосуванням внутрішньом’язового введення мелоксикаму 1,5 мл 1 раз на добу 10 діб. У подальшому призначали внутрішньом’язове введення глюкозаміну сульфату (ампули 200 мг/мл, 2,0 мл) 400 мг 3 рази на тиждень курсом 6 тижнів. У групі порівняння (N2 = 20) пацієнтам був призначений лише аналогічний щодо основної групи курс протизапального лікування із застосуванням НПЗП упродовж 10 діб, а в подальшому проводилися лише спостереження й оцінка функціонального стану ураженого суглоба. Результати лікування оцінювали клінічно через 10 діб і 2 місяці від початку лікування за динамікою зменшення больового синдрому за візуальною аналоговою шкалою (ВАШ) і функціональним станом надп’ятково-гомілкового суглоба (AOFAS), а також на підставі обліку частоти небажаних проявів і побічних реакцій у групах спостереження. Результати. Через 2 тижні інтенсивність больового синдрому за ВАШ у групі N1 становила 18,7 ± 3,2, а в групі N2 — 19,1 ± 2,9 (p > 0,1). Через 2 місяці співвідношення груп N1/N2 становило 12,2 ± 2,3 проти 17,9 ± 1,9 (p < 0,05). Функціональний стан надп’ятково-гомілкового суглоба, оцінений за AOFAS, через 2 тижні в групі N1 становив 78,7 ± 2,3 бала проти 79,1 ± 2,6 бала в групі N2 (p > 0,1). Через 2 місяці оцінка за AOFAS у групах N1 і N2 становила 91,7 ± 2,6 бала проти 79,4 ± 3,2 бала відповідно (p < 0,05). Негативних наслідків, що пов’язані з внутрішньом’язовим введенням препаратів мелоксикам і глюкозаміну сульфат, не було зафіксовано. Висновки. У пацієнтів з ранніми стадіями післятравматичного остеоартриту надп’ятково-гомілкового суглоба 6-тижневий курс лікування із застосуванням ін’єкційної форми глюкозаміну сульфату забезпечує ефективне зменшення больового синдрому і поліпшення функції. Аналіз побічних реакцій після застосування комбінації НПЗП та ін’єкційної форми SYSADOA показав відсутність побічних реакцій у групі клінічного спостереження за умови дотримання рекомендованих дози і режиму застосування, а також урахування і профілактики гастроінтестинальних і кардіоваскулярних ризиків.
Background. Despite the ambiguity and controversy of modern views on the use of symptomatic slow acting drugs for osteoarthritis (SYSADOA) as the basic therapy, numerous studies have shown that the early administration of these drugs is safe and effective, and in combination with anti-inflammatory treatment gives a better result and prevents degenerative and inflammatory damage to articular cartilage. There are requirements for SYSADOA to include them in guidelines and protocols for the treatment of osteoarthritis. These products must be registered medicinal products (prescription pharmaceutical preparations) with appropriate certification regarding the composition, quality and safety for long-term use, use in patients with multimorbidity, as well as when taking with other medicines. The dosage form should ensure the best compliance. The purpose was to evaluate the clinical effectiveness and safety of the injectable form of SYSADOA, namely glucosamine sulfate, in the treatment of patients with post-traumatic osteoarthritis of the ankle joint of the early stages (1–2 according to Kellgren and Lawrence) after surgical treatment for ankle fractures sustained from 6 months to 2 years ago. Material and methods. The design of the clinical research is comparative, prospective, controlled in parallel groups with the level of evidence IIB. Patients of the main group (N1 = 20) were operated for injury and had a radiologically and clinically confirmed diagnosis of post-traumatic osteoarthritis of the ankle joint stage I–II (according to Kellgren and Lawrence). In order to eliminate the phenomena of osteoarthritis exacerbation, patients were prescribed a course of nonsteroidal anti-inflammatory drugs (NSAIDs) with intramuscular injection of meloxicam 1.5 ml once a day for 10 days. Subsequently, intramuscular glucosamine sulfate (ampoules of 200 mg/ml, 2.0 ml) 400 mg 3 times a week was prescribed for 6 weeks. In the comparison group (N2 = 20), the patients received only a course of NSAIDs for 10 days similar to the main group, and subsequently, only observation and assessment of the functional state of the affected joint were carried out. The treatment outcomes were evaluated clinically 10 days and 2 months after the start of the treatment by the dynamics of pain syndrome reduction according to the visual analogue scale and the functional state of the ankle joint (AOFAS), as well as based on the frequency of adverse events and side effects in the observation groups. Results. After 2 weeks, the intensity of the pain syndrome according to the visual analogue scale in the N1 group was 18.7 ± 3.2, and in the N2 group, it was 19.1 ± 2.9 (p > 0.1). After 2 months, the ratio between groups N1/N2 was 12.2 ± 2.3 versus 17.9 ± 1.9 (p < 0.05). The functional state of the ankle joint assessed according to the AOFAS after 2 weeks in the N1 group was 78.7 ± 2.3 points versus 79.1 ± 2.6 points in the N2 group (p > 0.1). After 2 months, the AOFAS score in the groups N1 and N2 was 91.7 ± 2.6 points versus 79.4 ± 3.2 points (p < 0.05). No negative consequences associated with intramuscular administration of meloxicam and glucosamine sulfate were recorded. Conclusions. In patients with early stages of post-traumatic osteoarthritis of the ankle joint, a 6-week treatment with the use of an injectable form of glucosamine sulfate provides effective pain relief and improves function. A combination of NSAIDs and the injectable form of SYSADOA showed no adverse reactions in the clinical observation group, provided that the recommended dose and regimen were followed, as well as consideration and prevention of gastrointestinal and cardiovascular risks.
післятравматичний остеоартроз; надп’ятково-гомілковий суглоб; глюкозаміну сульфат
post-traumatic osteoarthritis; ankle joint; glucosamine sulfate