Проблема адекватної антигіпертензивної терапії актуальна у всьому світі, оскільки артеріальна гіпертензія (АГ) є головним фактором ризику таких тяжких захворювань, як мозковий інсульт, інфаркт міокарда, серцева і ниркова недостатність [1]. Єдиний спосіб запобігання їх розвитку — активний контроль артеріального тиску (АТ). Вірогідно встановлено, що зниження артеріального тиску до рекомендованого рівня (< 140/90 мм рт.ст.) призводить до зниження ризику розвитку серцево-судинних ускладнень. Згідно з результатами великих рандомізованих плацебо-контрольованих досліджень, нормалізація АТ сприяє зниженню ризику розвитку мозкового інсульту на 42 %, ішемічної хвороби серця — на 14 % [2].
Патогенез та патогенетичне лікування АГ: фокус на блокатори рецепторів ангіотензину ІІ
Ключову роль у патогенезі АГ, її ускладнень та метаболічних порушень на всіх етапах серцево-судинного континууму відіграє активація нейрогуморального комплексу ренін-ангіотензин-альдостеронової системи (РААС). Хронічна гіперактивація РААС проявляється збільшенням вмісту в крові і тканинах її головного ефекторного пептиду — ангіотензину ІІ (АТ-ІІ). До числа основних фізіологічних ефектів АТ-ІІ належать вазоконстрикція, посилення синтезу і секреції альдостерону, затримка натрію і води, підвищення тонусу симпатичної нервової системи, посилення вивільнення вазопресину, ендотеліну-1, норадреналіну, стимуляція росту кардіоміоцитів і клітин сполучної тканини в міокарді, проліферація гладком’язових клітин і фібробластів у судинній стінці, а також мезангіальних клітин у ниркових клубочках [3]. Усе це в сукупності сприяє розвитку і прогресуванню АГ та виникненню серйозних ускладнень.
Шкідливий вплив АТ-ІІ на органи-мішені виражається в розвитку гіпертрофії міокарда і міокардіофіброзу, прогресуванні атеросклерозу, підвищенні внутрішньоклубочкового тиску з подальшим розвитком нефросклерозу, патологічної цереброваскулярної реконструкції. Ефекти АТ-ІІ та інших ефекторних пептидів РААС опосередковуються специфічними ангіотензиновими рецепторами, головним чином 1-го і 2-го типів (АТ1 і АТ2) [4]. Однак більшість пов’язаних з активацією РААС функціональних і структурних змін у серці, судинах і нирках обумовлені впливом АТ-ІІ на АТ1-рецептори.
Зниження активності РААС може бути забезпечено двома шляхами — пригніченням синтезу АТ-ІІ або блокадою АТ1-рецепторів. З цією метою застосовують інгібітори ангіотензинперетворюючого ферменту (ІАПФ) та блокатори рецепторів до АТ-ІІ 1-го типу (БРА). ІАПФ та БРА вірогідно знижують ризик серцево-судинних подій (фатального і нефатального інсульту, інфаркту міокарда, серцевої недостатності та інших серцево-судинних причин смерті) у хворих на АГ, що підтверджується численними рандомізованими клінічними дослідженнями.
БРА блокують АТ1-рецептори і послаблюють ефекти АТ-ІІ незалежно від шляхів його утворення. Сприятливі фармакологічні ефекти складаються з прямого блокуючого впливу на АТ1-рецептори і непрямого стимулюючого впливу на АТ2-рецептори. Одним з ефектів стимуляції АТ2-рецепторів є активація кініногену, що сприяє утворенню брадикініну в судинній стінці, а отже, посиленню вивільнення оксиду азоту, простацикліну й ендотеліального фактора гіперполяризації, що мають вазодилатуючі ефекти [5].
Згідно з європейськими рекомендаціями кардіологів ESH/ESC-2024 з лікування АГ, БРА є одним із основних класів антигіпертензивних лікарських засобів, профіль переносимості яких практично порівнянний з плацебо [6]. Серед усіх БРА добре вивченим і широко застосовуваним препаратом є кандесартан, який у великих рандомізованих конт-рольованих дослідженнях переконливо продемонстрував ефективність та безпеку у лікуванні пацієнтів з АГ та її ускладненнями.
Переваги кандесартану в лікуванні АГ
Кандесартану цилексетил є проліками. При всмоктуванні зі шлунково-кишкового тракту він гідролізується в організмі до активної речовини кандесартану, механізм дії якого полягає в селективній блокаді АТ1-рецепторів до АТ-II, що призводить до нейтралізації судинозвужувальних і альдостерон-секретуючих ефектів АТ-II.
Абсолютна біодоступність кандесартану цилексетилу при прийомі всередину становить 42 %. Максимальна концентрація в плазмі крові досягається протягом 3–4 годин. При підвищенні дози в діапазоні 2–32 мг концентрація кандесартану в плазмі крові пропорційно зростає. Кандесартан метаболізується у печінці (20–30 %) за участю цитохрому Р 450 з утворенням неактивного метаболіту, який у незміненому вигляді виводиться із сечею (33 %) та жовчю (67 %). Після одноразового прийому препарату > 90 % дози екскретується протягом 72 год [9].
Препарат не кумулюється в організмі. В осіб похилого віку максимальна концентрація в крові підвищується на 50 %. Стійкий антигіпертензивний ефект розвивається при режимі призначення 1 р/до-бу, що є важливим фактором для пацієнта. Початок антигіпертезивної дії після прийому першої дози кандесартану зазвичай розвивається протягом 2 год. Кандесартан здатний ефективно знижувати артеріальний тиск протягом більше ніж 24 год і запобігати його підйому в ранкові години. При прийомі кандесартану всередину у добовій дозі 16 мг його антигіпертензивний ефект зберігається до 36–48 год [14].
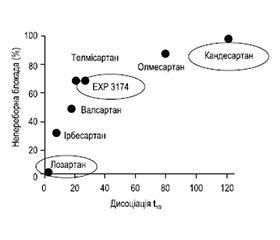
Кандесартан має деякі особливості, що виділяють його серед усіх представників класу БРА. За хімічною структурою кандесартану цилексетил, так само, як і лозартан, є біфеніловим похідним тетразолу, проте його ліпофільність вища, що сприяє більш легкій проникності в тканини і, отже, більш вираженій блокаді не тільки циркулюючих, але і локальних пептидів РААС. Кандесартан є високоселективним і потужним блокатором AT1-рецепторів тривалої дії, що пояснюється наявністю карбоксильної групи в положенні 7 бензимідазольного кільця і наявністю 4 локусів зв’язування з AT1-рецепторами. Показник AT1-селективності у кандесартану перевищує 10 000 : 1, що більше, ніж у лозартану (1000 : 1), телмісартану (3000 : 1) і ірбесартану (> 1000 : 1). Навіть надмірна кількість АТ-II не може витіснити кандесартан зі зв’язку з рецепторами AT1 [7, 8]. Такий тип зв’язку з рецептором отримав назву непереборної блокади (рис. 1). Завдяки йому можливо запобігти несприятливим ефектам АТ-II, а також нівелюються проблеми, пов’язані з пропусками прийому кандесартану.
/20.jpg)
Повільна дисоціація кандесартану у зв’язку з рецепторами сприяє його накопиченню в середовищі і повторному зв’язуванню з AT1-рецепторами. За здатністю витісняти АТ-II зі зв’язку з AT1-рецепторами людини кандесартан перевершує інші БРА. Встановлено, що спорідненість кандесартану до AT1-рецепторів приблизно в 80 разів вища, ніж у лозартану [10, 11], а дисоціація напіввиведення з AT1-рецепторів становить 152 хв для кандесартану і 5 хв для лозартану [12]. При цьому сила витіснення АТ-II у різних представників БРА убуває в такій послідовності: кандесартан > ірбесартан > лозартан [13].
Таким чином, високою спорідненістю до рецепторів, міцністю зв’язування кандесартану з AT1-рецепторами, його повільною дисоціацією зі зв’язку з ними і повторним зв’язуванням пояснюють, чому кандесартан надає більш виражену і більш тривалу антигіпертензивну дію, ніж інші БРА [15].
Доказова база ефективності та безпеки кандесартану в лікуванні АГ
Безсумнівною перевагою кандесартану в лікуванні АГ є значна тривалість його антигіпертензивної дії. Це особливо важливо для реальної клінічної практики, оскільки препарат зберігає свою ефективність навіть при пропуску прийому чергової дози. У дослідженні на групі з 312 хворих на АГ було проведено вивчення тривалості антигіпертензивної дії кандесартану в дозі 8 і 16 мг/добу в монотерапії і при поєднанні з 12,5 мг гідрохлоротіазиду. Дослідження залишкової дії проводилося на тлі 48-годинного пропуску прийому ліків. Така тривала перерва в прийомі препарату, за даними добового моніторування, не супроводжувалася значущим підвищенням артеріального тиску [16].
Висока тривалість дії препарату дозволяє ефективно контролювати за його допомогою нічний АТ. На групі з 254 хворих на АГ проаналізували вплив терапії кандесартаном в дозі 8 мг/добу на рівень нічного АТ. Контроль АТ здійснювався за даними добового моніторування. Виявилося, що терапія кандесартаном викликає вірогідне зниження рівнів нічного АТ і мозкового натрійуретичного пептиду. Нічний АТ знижувався однаково при призначенні кандесартану в ранкові та вечірні години [17].
R. Asmar і S. Nisse-Durgeat [28] було проведено дослідження, в якому оцінювалась ефективність кандесартану у 3013 літніх пацієнтів старше від 65 років (у 99,8 % пацієнтів діагностувалася ізольована систолічна АГ (САТ 163 ± 11 мм рт.ст., ДАТ 92 ± 8 мм рт.ст.)). У дослідження включали пацієнтів, яким раніше не проводилася терапія, або з поганою толерантністю до лікарських засобів, або у яких на тлі лікування не досягалася нормалізація артеріального тиску. Тривалість дослідження становила 8 тижнів, кандесартан призначали в початковій дозі 8 мг/добу одноразово. Якщо до кінця 4-го тижня лікування АТ залишалося на підвищеному рівні, дозу кандесартану збільшували до 16 мг/добу. Первинною кінцевою точкою служило досягнення цільового рівня АТ < 140/90 мм рт.ст. Через 4 тижні лікування цільовий рівень АТ був досягнутий у 1267 (42,9 %), а до кінця 8-го тижня — у 1865 (65,5 %) пацієнтів. Зі збільшенням дози кандесартану число хворих з цільовим рівнем АТ зростало на 22,6 %. Загалом до кінця лікування цільовий рівень АТ реєстрували у 83,7 % пацієнтів, при цьому найбільш виражене зниження артеріального тиску спостерігали в перші 4 тижні терапії (–21/–10 мм рт.ст.), зі збільшенням дози АТ знижувався на –11/–6 мм рт.ст. Слід підкреслити, що ступінь зниження АТ корелював зі стадією АГ. Так, до 4-го тижня лікування нормалізацію артеріального тиску відзначали у 57,5 % хворих з початковою стадією захворювання, при 2-й стадії зниження артеріального тиску реєстрували у 37,1 % і 3-й стадії — у 27,9 %; до кінця 8-го тижня — відповідно у 75,5; 62,6 і 47,4 % пацієнтів. Проведена раніше антигіпертензивна терапія не змінювала ефект кандесартану, він також не залежав від статі і віку хворих, наявності або відсутності ЦД. Це дозволило авторам дійти висновку, що кандесартан є ефективним засобом у лікуванні ізольованої систолічної АГ у літніх пацієнтів.
У відкритому дослідженні S. Minatoguchi et al. оцінювали вплив кандесартану на ранковий підйом АТ [18]. Препарат призначали хворим, у яких протягом дня значення артеріального тиску були в межах норми, проте в ранкові години відзначалося їх підвищення до 135/85 мм рт.ст. і вище. Було сформовано 2 групи лікування: кандесартаном (4 мг/добу) і амлодипіном (2,5 мг/добу). Якщо пацієнт до дослідження приймав інший представник БРА (валсартан, лозартан, телмісартан), його переводили на терапію кандесартаном. Отримані результати показали, що кандесартан запобігав ранковому підвищенню АТ більш ефективно, ніж амлодипін, валсартан, лозартан та телмісартан, через 3, 6, 9 і 12 місяців лікування. Крім того, було встановлено, що на тлі лікування кандесартаном відзначалася тенденція до зниження частоти серцевих скорочень.
Ці результати узгоджуються з даними, отриманими у дослідженні D. Elmfeldt et al. [19]. При порівнянні антигіпертензивної активності лозартану, валсартану, ірбесартану та кандесартану була доведена суттєва перевага кандесартану (рис. 2).
У метааналізі P. Meredith [21], який включав 13 досліджень, порівнювали кандесартан та лозартан як монотерапію або у фіксованій комбінації з гідрохлоротіазидом у пацієнтів з артеріальною гіпертензією. У статистичний аналіз були включені дані 4066 пацієнтів, при цьому середні зміни систолічного і діастолічного АТ порівнювалися для кожного препарату окремо, після стратифікації за дозою й у комбінації з гідрохлоротіазидом. Результати показали безсумнівну користь кандесартану в зниженні САТ, у середньому на 3,22 мм рт.ст., порівняно з лозартаном.
21.jpg)
Ці результати підкріплюються систематичним оглядом та метааналізом Z. Zheng et al. [20]. Метааналіз включав 12 РКД та 3644 пацієнти. Оцінювали вплив кандесартану і лозартану на САТ і ДАТ. Наприкінці періоду спостереження виявлена більш виражена дія кандесартану на САТ (різниця середніх –2,97; 95% ДІ –4,18… –1,77; р < 0,001) і ДАТ (різниця середніх –1,76; 95% ДІ –2,57–0,96; р < 0,001). Частота серйозних побічних ефектів для кандесартану була значно нижчою, ніж для лозартану (ВР = 0,48; 95% ДІ 0,25–0,92; Р = 0,03). Таким чином, кандесартан перевершує лозартан за антигіпертензивною активністю і краще переноситься (викликає менше серйозних побічних ефектів) [20].
У роботі Н. Hasegawa et al. [23] проводилося зіставлення ефективності різних препаратів з групи БРА. При ініціації терапії хворі отримували лікування середньотерапевтичними дозами лозартану, валсартану, телмісартану і олмесартану, а потім проводилася їх заміна на кандесартан у дозі 8 мг/добу.
У результаті зміни терапії на кандесартан відзначено додаткове зниження офісного АТ на 13,1 і 6,2 мм рт.ст. відповідно для САТ і ДАТ. При цьому нормалізація офісного АТ досягнута у 62 % хворих. Отже, за результатами досліджень, кандесартан перевершував за антигіпертензивним ефектом представників свого класу.
У метааналізі D. Zhao et al. [24], опублікованому в 2019 р., порівнювався антигіпертензивний ефект кандесартану 8 мг, валсартану 80 мг та телмісартану 40 мг протягом трьох місяців у 308 пацієнтів з АГ та ЦД 2-го типу. Було виявлено, що антигіпертензивна ефективність кандесартану перевершує таку лозартану, валсартану і телмісартану [25]. У дослідженні P.R. Conlin кандесартан був більш ефективним у зниженні САТ і ДАТ порівняно з епросартаном і ірбесартаном [26].
У метааналізі L. Hansson, у якому також порівнювали антигіпертензивну активність різних сартанів (кандесартан, ірбесартан, валсартан та лозартан), було показано, що кандесартан має найбільшу активність [28]. Дози кандесартану 4, 8 і 16 мг/добу виявилися ефективнішими порівняно з ірбесартаном 75, 150 і 300 мг/добу, валсартаном 40, 80 і 160 мг/до-
бу і лозартаном 25, 50 і 100 мг/добу. Кандесартан призводив до найбільшого зниження діастолічного АТ (–8,1 мм рт.ст.) порівняно з ірбесартаном (–7,1 мм рт.ст.), валсартаном (–6,4 мм рт.ст.) і лозартаном (–5,2 мм рт.ст.). Слід зазначити, що всі дослідження, включені в цей метааналіз, виконували із застосуванням фіксованих доз в паралельних групах подвійним сліпим плацебо-контрольованим методом, їх тривалість становила ≥ 4 тижні. Результати цього метааналізу ще раз підкреслюють значення тривалої афінності до рецепторів АТ1 і її роль у розвитку антигіпертензивного ефекту.
Ефективність кандесартану в лікуванні пацієнтів з АГ та серцево-судинними ускладненнями
У лікуванні пацієнтів з АГ важливо не тільки досягнення цільових рівнів АТ, але і захист органів-мішеней, що саме по собі є самостійною метою терапії. У багатоцентровому проспективному рандомізованому подвійному сліпому дослідженні CATCH вивчали здатність кандесартану (8–16 мг 1 раз на добу) та ІАПФ еналаприлу (10–20 мг 1 раз на добу) зменшувати масу міокарда у пацієнтів з артеріальною гіпертензією та ехокардіографічними ознаками гіпертрофії лівого шлуночка (ГЛШ). В обох групах були досягнуті цільові рівні САТ і ДАТ, при цьому нормалізація маси міокарда лівого шлуночка відзначена у більшої кількості пацієнтів у групі кандесартану порівняно з групою еналаприлу (36,3 і 28,6 % відповідно) [29].
У проспективному багатоцентровому рандомізованому відкритому з паралельними групами дослідженні CASE-J порівнювали ефективність кандесартану і блокатора кальцієвих каналів амлодипіну у пацієнтів з АГ. Обидва препарати забезпечували однакове зниження частоти серцево-судинних подій, однак у пацієнтів з початковою ГЛШ кандесартан призводив до вірогідно більш вираженого, порівняно з амлодипіном, зменшення маси міокарда лівого шлуночка. Крім того, кількість нових випадків серцево-судинних подій була значно меншою серед пацієнтів, які приймали кандесартан [30].
У дослідженні SARA прийом кандесартану також сприяв зменшенню вираженості електрокардіографічних ознак ГЛШ у хворих на АГ, зокрема із супутнім метаболічним синдромом [31].
Кандесартан є одним із БРА, рекомендованих для лікування хронічної серцевої недостатності (ХСН) [21]. Підставою для його внесення до відповідних рекомендацій послужило дослідження CHARM [33]. Програма CHARM складалася з трьох окремих РКД. Перше — CHARM-Added включало 2548 хворих на ХСН з фракцією викиду лівого шлуночка (ФВ) < 40 % (у середньому 28 %), яким призначали стандартну терапію ІАПФ. Додатково до цього лікування хворі отримували кандесартан або плацебо. У другій гілці програми — CHARM-Alternative 2028 хворих на ХСН з ФВ < 40 % (у середньому 30 %), які з різних причин не могли приймати ІАПФ, були також рандомізовані на групи кандесартану і плацебо. 3025 хворих на ХСН зі збереженою ФВ (> 40 %, у середньому 54 %), які приймали або не приймали ІАПФ, стали учасниками третьої гілки — CHARM-Preserved. Вони також були рандомізовані на групи кандесартану та плацебо. Первинною кінцевою точкою програми була загальна смертність, а для кожної з її гілок — серцево-судинна смерть або госпіталізація внаслідок декомпенсації ХСН. Тривалість спостереження становила в середньому 37,7 місяця. Доза кандесартану титрувалася до 32 мг/добу. Цільової дози вдалося досягти 63 % хворих. Показник загальної смертності у групі кандесартану був меншим, ніж у групі плацебо (886 (23 %) та 945 (25 %) відповідно, або 0,91; 95% ДІ 0,83–1,00; p = 0,055). Первинна кінцева точка в CHARM-Added в групі кандесартану була меншою на 15 % (p = 0,01) [33], у CHARM-Alternative — на 23 % (p < 0,0001) [23]. У CHARM-Preserved в групі кандесартану також відзначалося зниження цього показника (на 11 %), але воно залишалося на рівні тенденції (p = 0,051) [24]. Автори дослідження дійшли висновку, що застосування кандесартану високоефективно при серцевій недостатності з систолічною дисфункцією лівого шлуночка. Додатковою перевагою кандесартану є зменшення відносного ризику розвитку фібриляції передсердь порівняно з плацебо: на 19 % у загальній групі та на 22 % — у пацієнтів із ФВ < 40 % [33].
Здатність кандесартану ефективно та безпечно знижувати серцево-судинний ризик у пацієнтів з АГ порівняно з лозартаном показана в великому ретроспективному дослідженні REAL LIFE, проведеному у 72 клінічних центрах Швеції. Результати цього дослідження показали, що лікування кандесартаном порівняно з лозартаном вірогідно знижує ризик розвитку серцево-судинних ускладнень і смерті від них на 14,4 %. Більше зниження ризику серцево-судинних ускладнень при лікуванні кандесартаном було пов’язано з меншим ризиком розвитку серцевої недостатності (–36 %) і порушень ритму серця (–20 %) порівняно з лозартаном. Цей факт свідчить про значний вплив фармакологічних відмінностей на здатність препаратів одного класу знижувати ризик розвитку серцево-судинних ускладнень і смерті від них [34].
Таким чином, кандесартан є ефективним, тривалодіючим та безпечним засобом у лікуванні АГ і ХСН.
Нейропротективні властивості кандесартану
Інсульт є частою причиною летальності та інвалідизації хворих [35]. Серед факторів ризику інсульту в усьому світі виділяється АГ [36], тому зниження і підтримання АТ на оптимальному рівні запобігає його розвитку.
J. Schrader et al. [37] було проведено рандомізоване подвійне сліпе плацебо-контрольоване дослідження ACCESS, у якому оцінювалась ефективність кандесартану в ранньому лікуванні хворих на артеріальну гіпертензію та гострий ішемічний інсульт. Першу групу становили 173 пацієнти (середній вік 68,3 ± 9,3 року), яким у перший день призначали кандесартан в дозі 4 мг/добу, на другий день дозу збільшували до 8 або 16 мг/добу в разі САТ > 160 мм рт.ст. або ДАТ > 100 мм рт.ст. До другої групи входили 166 хворих (середній вік 67,8 ± 9,4 року), які отримували плацебо. Тривалість лікування становила 7 днів. На підставі отриманих результатів автори дійшли висновку, що лікування кандесартаном хворих на гострий ішемічний інсульт протягом перших 7 днів значно зменшує серцево-судинну захворюваність і летальність, можливо, через зниження більшою мірою нейрогуморальної активності (рівнів альдостерону, катехоламінів, вазоконстрикції, судинного запалення).
У дослідженні SCOPE [38] оцінювали вплив кандесартану (1-ша група) порівняно з плацебо (2-га група) на частоту фатального і нефатального інсульту, серцево-судинних подій, зниження когнітивної функції і розвитку деменції у літніх хворих з незначним або помірним підвищенням артеріального тиску. Дослідження було проведено в 527 центрах 15 країн з включенням 4964 хворих віком 70–89 років і рівнем САТ 160–179 мм рт.ст. та/або ДАТ 90–99 мм рт.ст. До кінця дослідження (у середньому через 3,7 року) в 1-й групі АТ знижувався на 21,7/10,8 мм рт.ст., у 2-й групі — на 18,5/9,2 мм рт.ст. Кандесартан знижував частоту нефатального інсульту на 27,8 %, а всіх інсультів — на 23,6 %. Крім того, було встановлено, що кандесартан вірогідно знижує серцево-судинну летальність і захворюваність у старих і дуже старих хворих з м’якою і помірною АГ. При цьому лікування кандесартаном супроводжується вірогідним поліпшенням когнітивних функцій і позитивним впливом на якість життя пацієнтів.
Нефропротективна дія кандесартану
АГ є основним фактором ризику розвитку і прогресування хронічної хвороби нирок (ХХН), незалежно від причин її виникнення. Хворих на ХХН, резистентну та масковану АГ об’єднують загальні патогенетичні механізми, асоційовані з нижчим рівнем розрахункової швидкості клубочкової фільтрації (рШКФ), підвищеним рівнем альбумінурії та ураженням органів-мішеней [41, 42].
Ефективність кандесартану при захворюваннях нирок щодо запобігання їх прогресуванню і поліпшення виживання на сьогодні не викликає сумніву. Сприятливими є ефекти кандесартану, пов’язані як з блокадою АТ1-рецепторів, так і зі стимуляцією АТ2-рецепторів. Блокада АТ1-рецепторів в еферентних артеріолах ниркових клубочків призводить до зниження в них гідравлічного тиску, а стимуляція АТ2-рецепторів в аферентних і еферентних артеріолах ниркових клубочків супроводжується збільшенням ефективного ниркового плазмотоку.
У низці досліджень була показана здатність кандесартану зменшувати протеїнурію і сповільнювати погіршення фільтраційної функції при ХХН IV–V стадій і рШКФ < 30 мл/хв/1,73 м2 [37]. Перше плацебо-контрольоване дослідження, у якому оцінювали протеїнурію при призначенні БРА, показало, що при прийомі кандесартану в дозі 8–16 мг/добу протягом 12 тижнів екскреція протеїну із сечею знижується, а в групі плацебо вірогідно зростає. Крім того, при використанні кандесартану було встановлено вірогідне зниження креатиніну сироватки крові, розвитку термінальній стадії хронічної ниркової недостатності та смертності на 20 % порівняно з плацебо [39, 40].
У міжнародному багатоцентровому рандомізованому дослідженні SECRET оцінювали нефропротективний ефект кандесартану порівняно з плацебо у хворих після трансплантації нирок. SECRET було зупинено достроково, оскільки первинна частота подій в групі кандесартану була набагато нижчою за очікувану. Крім ефективного контролю АТ, доброї переносимості та безпеки, препарат показав здатність вірогідно зменшувати протеїнурію у пацієнтів після трансплантації нирок [43].
Застосування кандесартану у хворих на ЦД
Пацієнти з ЦД і АГ мають найбільш високий ризик серцево-судинних ускладнень. При лікуванні цієї групи хворих необхідно вибирати препарати з хорошою антигіпертензивною ефективністю, органопротективними властивостями та відсутністю несприятливих метаболічних реакцій. Усім цим критеріям відповідає кандесартан. Здатність кандесартану чинити нефропротективний вплив і зменшувати прояви протеїнурії у хворих на ЦД була показана у дослідженнях CALM I та CALM II [44]. Крім того, у 48 хворих, які брали участь у дослідженні CALM II, була проведена оцінка стану глікемічного контролю та ГЛШ протягом 1 року терапії. Вираженість ГЛШ оцінювалася за допомогою тканинного допплерівського дослідження, контроль глікемії — за рівнем глікозильованого гемоглобіну та фруктозаміну. Виявлено, що зменшення ГЛШ не залежало від ступеня зниження АТ, але було пов’язано з контролем глікемії. У групі хворих, у яких глікемічний конт-роль поліпшився, зменшення ГЛШ було вірогідно більш вираженим [45].
У хворих на ЦД та протеїнурію порівнювали ефективність монотерапії кандесартаном та комбінованої терапії кандесартаном і амлодипіном. Хворі отримували спочатку кандесартан в дозі 8 мг/добу. Потім доза кандесартану збільшувалася до 12 мг/до-бу або до терапії додавався амлодипін 2,5 мг/добу. У групі монотерапії за 12 тижнів лікування альбумінурія зменшилася на 40 %, у групі комбінованої терапії — на 9 %. Таким чином, монотерапія кандесартаном виявилася більш ефективною профілактикою нефропатії [46].
У подвійному сліпому рандомізованому дослідженні ALPINE у 392 пацієнтів з виявленою нелікованою, слабко вираженою або помірно вираженою АГ порівнювали ефекти кандесартану цилексетилу в дозі 16 мг/добу і його комбінації з фелодипіном у дозі 2,5–6 мг/добу з ефектами при лікуванні гідрохлоротіазидом у дозі 25 мг/добу або з ефектами комбінації гідрохлоротіазиду з атенололом у дозі 50–100 мг/добу. При цьому контролювали електроліти крові, рівень глюкози, показники ліпідного профілю та якість життя [47]. Було встановлено, що монотерапія кандесартаном або застосування його в комбінації з фелодипіном супроводжується не тільки корекцією АТ, але і поліпшенням метаболічного статусу у пацієнтів на відміну від небажаних змін ліпідів плазми і зниження чутливості до інсуліну при лікуванні АГ з використанням гідрохлоротіазиду.
Висновки
— У патогенезі АГ та розвитку її ускладнень важливу роль відіграє активація нейрогуморального комплексу РААС. Зниження активності РААС може бути забезпечено блокадою АТ1-рецепторів, що досягається призначенням БРА, які, згідно з європейськими рекомендаціями кардіологів ESH/ESC-2024 з лікування АГ, є одним із основних класів антигіпертензивних лікарських засобів.
— Кандесартан має явні переваги порівняно з іншими препаратами БРА за показниками взаємодії з АТ1-рецепторами у вигляді більшої сили зв’язку та повільної дисоціації з рецепторами, що відповідає тривалому необоротному блокуванню рецепторів АТ1. Показник AT1-селективності у кандесартану перевищує 10 000 : 1, що більше, ніж у лозартану (1000 : 1), телмісартану (3000 : 1) і ірбесартану (> 1000 : 1). Завдяки цьому кандесартан надає більш виражену і тривалу антигіпертензивну дію (до 36 год), ніж інші БРА.
— У багатьох дослідженнях продемонстрована висока антигіпертензивна ефективність та безпека кандесартану. При порівнянні антигіпертензивної активності лозартану, валсартану, ірбесартану та кандесартану доведена суттєва перевага кандесартану.
— Кандесартан забезпечує органопротекцію, оскільки не тільки знижує АТ, але і зменшує ГЛШ, ризик розвитку фібриляції передсердь та серцевої недостатності.
— Кандесартан знижує частоту нефатального інсульту на 27,8 %, а всіх інсультів — на 23,6 %. Забезпечує вірогідне поліпшення когнітивних функцій і чинить позитивний вплив на якість життя пацієнтів.
— У низці досліджень була показана здатність кандесартану зменшувати протеїнурію і сповільнювати погіршення фільтраційної функції при ХХН IV–V стадій з рШКФ < 30 мл/хв/1,73 м2, що демонструє нефропротективну дію препарату.
— Призначення кандесартану пацієнтам з ЦД призводить не тільки до корекції АТ, зменшення протеїнурії, але і супроводжується поліпшенням метаболічного статусу, що доведено у великій кількості РКД.
Список литературы
1. Lewington S., Clarke R., Qizilbash N., et al. Prospective Studies Collaboration Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet, 2002, 360(9349): 1903-1913.
2. Collins R., Peto R., MacMahon S., et al. Blood pressure, stroke, and coronary heart disease. Part 2, Short-term reductions in blood pressure: overview of randomised drug trials in their epidemiological context. Lancet, 1990, 335(8693): 827-838.
3. Burnier M. Pathophysiological and clinical implications of AT (1) and AT (2) angiotensin II receptors in essential hypertension. Drugs, 2002, 62(1): 21-29.
4. Dzau V., et al. Heterogenity of angiotensin synthetic pathways and receptor subtypes: physiological and pharmacological implications. J. Hypertens., 1993, 11(3): 11-18.
5. Jackson E.K., Garrison J.C. Renin and Angiotensin. In Goodman & Gilman’ s The Pharmacological Basis of Therapeutics. 10th edition. New York: McGraw Hill, 2003: 744.
6. McEvoy J.W., McCarthy C.P., Bruno R.M., et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J. Published online August 30, 2024. doi: 10.1093/eurheartj/ehae178.
7. Morsing P., Adler G., Brandt U., et al. Mechanistic Diffe-rences of various AT1-receptor blockers in isolated vessele of different origin. Hypertension, 1999; 33: 140613.
8. Ojima M., Inada Y., Shibouta Y., et al. Candesartan (CV-11974) dissociates slowly from the angiotensin AT1-receptor. Eur J Pharmacol., 1997; 319: 137-46.
9. Hubner R., Hogemann A.M., Sunzel M., Riddell J.C. Pharmacokinetics of candesartan after single and repeated doses of candesartan cilexetil in young and elderly healthy volunteers. J. Hum. Hypertens., 1997, 11 (Suppl. 2): S19-S25.
10. Abrahamsson Т., Karp L., Brabdl-Eliasson I.I., el al. Candesartan causes long-last antagonism of angiotensin II receptor-mediated contractile effects in isolated vascular preparations: a comparison with irbesartan, losartan and its active metabolite (EXP-3174). Blood Pressure, 2000, 9: 1-52.
11. Linger T. Differences among angiotensin II type 1 receptor blockers: characterization of candesartan cilexetil. Blood Pressure, 2000, 9 (Suppl. 1): 14-18.
12. Vanderheyden P.M.L., Fierens F.L.P., De Backer J.P., Vauquelin G. Reversible and syntopic interaction between angiotensin receptor antagonists on Chinese hamster ovary cells expressing human angiotensin II type I receptors. Biochem. Pharmacol., 2000, 59: 927-935.
13. van Liefde I., Vauquelin G. Sartan-AT1 receptor interactions: in vitro evidence for insurmountable antagonism and inverse agonism. Mol. Cell Endocrinol., 2009, 302 (2): 237-243.
14. Lacourcière Y., Asmar R. A comparison of the efficacy and duration of action of candesartan cilexetil and losartan as assessed by clinic and ambulatory blood pressure after a missed dose, in truly hypertensive patients: a placebo-controlled, forced titration study. Candesartan/Losartan study investigators. Am J Hypertens., 1999, 12, 12, рt. 1–2: 1181-118.
15. McClellan K.J., Goa K.L. Candesartan cilexetil. A review of its use in essential hypertension. Drugs, 1998, 56: 847-869.
16. Weisser B., Gerwe M., Braun M., Funken C. Investigations of the antihypertensive long-term action of candesartan cilexetil in different dosages under the influence of therapy-free intervals. Arzneimittelforschung, 2005, 55 (9): 505-13.
17. Shimizu M., Ishikawa J., Yano Y., Hoshide S., Eguchi K., Ishikawa S., Shimada K., Kario K. Association between asleep blood pressure and brain natriuretic peptide during antihypertensive treatment: the Japan Morning Surge-Target Organ Protection (J-TOP) study. J. Hypertens., 2012, 30 (5): 1015-21.
18. Minatoguchi S., Aoyama T., Kawai N. Comparative effect of candesartan and amlodipine, and effect of switching from valsartan, losartan, telmisartan and olmesartan to candesartan, on early morning hypertension and heart rate. Blood Press., 2013, 013; 22 (Suppl. 1): 29-37.
19. Elmfeldt D., Olofsson B., Meredith P. The relationships between dose and antihypertensive effect of four AT1-receptor blockers. Differences in potency and efficacy. Blood Press., 2002, 11: 293-301.
20. Zheng Z., Shi H., Jia J. A systematic review and meta-analysis of candesartan and losartan in the management of essential hypertension. Journal of the Renin-Angiotensin-Aldosterone System, 2011, 12, 3: 365-374.
21. Meredith P. Comparative ARB pharmacology. Br J Cardiol., 2010, 17: 3-5.
22. Kario K., Hoshide S., Shimizu M., et al. Effect of dosing time of angiotensin II receptor blockade titrated by self-measured blood pressure recordings on cardiorenal protection in hypertensives: the Japan Morning Surge-Target Organ Protection (J-TOP) study. J Hypertens., 2010; 28 (7): 1574-83.
23. Hasegawa H., Takano H., Kameda Y., et al. Effect of switching from telmisartan, valsartan, olmesartan, or losartan to candesartan on morning hypertension. Clin Exp Hypertens., 2012, 34(2): 86-91.
24. Zhao D., Liu H., Dong P.A. Meta-analysis of antihypertensive effect of telmisartan versus candesartan in patients with essential hypertension. Clin. Exp. Hypertens., 2019, 41, 1: 75-79.
25. Elmfeldt D., Olofsson B., Meredith P. The relationships between dose and antihypertensive effect of four AT1-receptor blockers. Differences in potency and efficacy. Blood Press., 2002, 11, 5: 293-301.
26. Conlin P.R. Angiotensin II antagonists in the treatment of hypertension: more similarities than differences J. Clin. Hypertens. (Greenwich)., 2000, 2, 4: 253-257.
27. Asmar R., Nisse-Durgeat S. A large scale study of angiotensin II inhibition therapy in elderly population: the CHANCE study. Vasc. Health Risk Manag., 2006; 2(3): 317-23.
28. Hansson L. The relationship between dose and antihypertensive effect for different AT1-receptor blockers. Blood Press., 2001; 10(suppl 3): 33-9.
29. Cuspidi C., Muiesan M.L., Valagussa L. et al.; CATCH investigators. Comparative effects of candesartan and enalapril on left ventricular hypertrophy in patients with essential hypertension: the candesartan assessment in the treatment of cardiac hypertrophy (CATCH) study. J. Hypertens., 2002, 20(11): 2293-2300.
30. Ogihara T., Fujimoto A., Nakao K., Saruta T.; CASE-J Trial Group. ARB candesartan and CCB amlodipine in hypertensive patients: the CASE-J trial. Expert Rev. Cardiovasc. Ther., 2008, 6(9): 1195-1201.
31. Escobar C., Barrios V., Calderón A. et al. Electrocardiographic left ventricular hypertrophy regression induced by an angiotensin receptor blocker-based regimen in hypertensive patients with the metabolic syndrome: data from the SARA Study. J. Clin. Hypertens. (Greenwich), 2008, 10(3): 208-214.
32. Lithell H., Hansson L., Skoog I., et al.; SCOPE Study Group. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J. Hypertens., 2003, 21(5): 875-886.
33. Pfeffer M.A., Swedberg K., Granger C.B., et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet, 2003, 362: 759-66.
34. Kjeldsen S.E., Stalhammar J., Hasvold P., Bodegard J., Olsson U., Russell D. Effects of losartan vs candesartan in reducing cardiovascular events in the primary treatment of hypertension. J. Hum. Hypertens., 2010, 24(4): 263-73.
35. Lawes C.M., Vander Hoorn S., Rodgers A. International Society of Hypertension. Global burden of blood-pressure-related disease. Lancet, 2008, 371: 1513-8.
36. Graham D.I., McGeorge A., Fitch W., Jones J.V., Mac-Kenzie E.T. Ischemic brain damage induced by rapid lowering of arterial pressure in hypertension. J. Hypertens., 1984, 2: 297-304.
37. Schrader J., Luders S., Kulschewski A., Berger J., Zidek W., Treib J., Einhäupl K., Diener H.C., Dominiak P.; Acute Candesartan Cilexetil Therapy in Stroke Survivors Study Group. The ACCESS Study. Evaluation of acute candesartan cilexetil therapy in stroke survivors. Stroke, 2003, 34: 1699-1703.
38. Lithell H., Hansson L., Skoog I., Elmfeldt D., Hofman A., Olofsson B., Trenkwalder P., Zanchetti A.; SCOPE Study Group. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of randomized double-blind interventional trial. J. Hypertens., 2003; 21: 875-86.
39. Blood Pressure Lowering Treatment Trialists Collaboration. Effects of blood-pressure-lowering regimens on major cardiovascular events: results of prоspectively designed overviews of randomised trials. Lancet, 2003, 362: 1527-35.
40. Burgess E., Muirhead N., de Cotret P.R., et al. SMART (Supra Maximal Atacand Renal Trial) Investigators. Supramaximal dose of candesartan in proteinuric renal disease. J Am Soc Nephrol., 2009, 20: 893-900.
41. Drawz P.E., Alper A.B., Anderson A.H., et al. Chronic Renal Insufficiency Cohort Study Investigators. Masked hypertension and elevated nighttime blood pressure in CKD: prevalence and association with target organ damage. Clin J Am Soc Nephrol., 2016, 11: 642-52. doi: 10.2215/CJN.08530815.
42. Rossignol P., Massy Z.A., Azizi M., et al., ERA-EDTA EURECA-m Working Group, Red de Investigation Renal (REDINREN) Network, Cardiovascular and Renal Clinical Trialists (F-CRIN INI-CRCT) Network. The double challenge of resistant hypertension and chronic kidney disease. Lancet, 2015, 386: 1588-98. doi: 10.1016/S0140-6736(15)00418-3.
43. Song J.H., Cha S.H., Lee H.J., et al. Effect of low-dose dual blockade of renin-angiotensin system on urinary TGF-beta in type 2 diabetic patients with advanced kidney disease. Nephro–logy Dialysis Transplantation., 2006; 21(3): 683-9. doi: 10.1093/ndt/gfi310.
44. Andersen N.H., Poulsen P.L., Knudsen S.T., et al. Long-term dual blockade with candesartan and lisinopril in hypertensive patients with diabetes: the CALM II study. Diabetes Care, 2005; 28 (2): 273-7.
45. Andersen N.H., Poulsen S.H., Poulsen P.L., et al. Effects of blood pressure lowering and metabolic control on systolic left ventricular function in Type II diabetes mellitus. Clin Sci (Lond), 2006; 111 (1): 53-9.
46. Okura T., Kojima M., Machida H., et al. Effects of up-titration of candesartan versus candesartan plus amlodipine on kidney function in type 2 diabetic patients with albuminuria. J Hum Hypertens., 2012; 26 (4): 214-9.
47. Lindholm L.H., Person M., Alaupovic P., et al. Metabolic outcome in newly detected hypertensives: results of the Antihypertensive Treatment and Lipid Profile in North of Sweden Efficacy Evaluation (ALPINE). J Hypertension, 2003; 21: 1563-74.
/20.jpg)
/21.jpg)
21.jpg)