Резюме
Актуальність. Кардіоренометаболічний синдром (КРМС) — це сукупність патологічних станів, які поєднують метаболічні порушення, серцево-судинну дисфункцію та ураження нирок, формуючи взаємопов’язану систему ускладнень. Особливу роль у розвитку та прогресуванні цього синдрому відіграє ендотеліальна дисфункція — ранній маркер судинного ураження, що асоціюється з порушенням вазодилатації, хронічним запаленням та проатерогенними змінами. Водночас зниження показника розрахункової швидкості клубочкової фільтрації (рШКФ) відображає не лише функціональний стан нирок, а й загальний ризик серцево-судинних подій та смертності. У контексті старіння популяції та зростання поширеності КРМС серед осіб різного віку, особливо середнього й похилого, актуальним стає вивчення взаємозв’язку між дисфункцією ендотелію та зниженням рШКФ. Рання діагностика цих порушень дозволить не лише виявити осіб з високим кардіоренальним ризиком, а й впровадити підходи до профілактики, ранньої діагностики та лікування. Мета: оцінити функціональний стан нирок і судинного ендотелію в осіб різного віку з ознаками КРМС та з’ясувати можливості корекції виявлених змін застосуванням екстракту леспедези головчастої (дієтична добавка Лібера, ТОВ «Біхелс», Україна) як потенційного засобу нефро- та ангіопротекції. Матеріали та методи. Первинно обстежено 152 особи різного віку. Згідно з критеріями включення було виключено 58 осіб за різними причинами. Комплексне обстеження проведено у 94 осіб різного віку (середній вік становив 54,82 ± 0,97 року), з яких у більшості виявлено зниження рШКФ, підвищення співвідношення альбумін/креатинін (САК) у сечі та зниження функції ендотелію. Для корекції виявлених змін на фоні проведення стандартної антигіпертензивної терапії було додано до лікування Lespedeza capitata (Лібера, ТОВ «Біхелс», Україна), яку призначали по 1 капсулі 3 рази на добу незалежно від прийому їжі протягом 1 місяця попередньо обстеженим особам (n = 39). Критеріями ефективності лікування були: динаміка рШКФ, САК у сечі та показники функціонального стану ендотелію (приріст кровотоку при проведенні проби з реактивною гіперемією). Термін спостереження за пацієнтами становив 1 місяць. Обстеження проводили з використанням стандартних клінічних, антропометричних, лабораторних і інструментальних методів. Результати. З віком відмічається тенденція до зниження показника рШКФ з 79,73 ± 1,91 мл/хв/1,73 м2 у середньому віці (47,28 ± 0,72 року) до 64,01 ± 2,21 мл/хв/1,73 м2 у похилому віці (67,18 ± 0,49 року). В осіб середнього віку (100 %) рШКФ знаходиться в межах категорії G2 (60–89 мл/хв/1,73 м2), водночас у 46 % осіб похилого віку рШКФ знижується до категорії G3а (45–59 мл/хв/1,73 м2). Нормальна або висока рШКФ (категорія G1, ≥ 90 мл/хв/1,73 м2) зберігається лише у 10 % обстежених похилого віку. Серед осіб середнього віку із незначним зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) виявлено підвищення показника САК у третини обстежених, тоді як в осіб похилого віку превалює зниження рШКФ до 40–59 мл/хв/1,73 м2, яке розцінюється як хронічна хвороба нирок (ХХН) у межах категорії G3а, що супроводжується підвищенням показника САК у 25 % осіб. При оцінці функціонального стану ендотелію великих судин виявлено, що серед обстежених осіб (n = 94) з різними категоріями рШКФ (G1, G2, G3а) ознаки ендотеліальної дисфункції спостерігалися у 54 хворих (57,45 %). Із них у 19 пацієнтів (35,18 %) зафіксовано крайній ступінь порушення — вазоспастичну реакцію при проведенні проби за методикою D.S. Celermajer, що свідчить про виражене порушення ендотелійзалежної вазодилатації. Серед обстежених осіб із дисфункцією ендотелію великих судин у 70,4 % (38 осіб) показник САК виявився < 30 мг/г, в 29,6 % (16 осіб) виявилося підвищене САК (у 10 осіб — 30–300 мг/г, а у 6 осіб — понад 300 мг/г). Водночас у групі осіб із збереженою функцією ендотелію були такі показники: у 65 % (26 осіб) САК виявлено на рівні < 30 мг/г, у 14 осіб САК становило 30–300 мг/г, не виявлено осіб з САК понад 300 мг/г. Таким чином, лише серед пацієнтів з ендотеліальною дисфункцією зафіксовано САК > 300 мг/г (у 5 осіб, або 9,2 %), що демонструє вірогідну статистичну різницю (χ2 = 0,01, p = 0,03). Серед осіб зі зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) та G3а (45–59 мл/хв/1,73 м2) відмічено зниження ендотеліальної функції судин мікроциркуляторної ланки у 84 % обстежених, при цьому САК < 30 мг/г виявлено у 50,00 %, САК в межах 30–300 мг/г виявлено у 43,75 %, САК понад 300 мг — у 6,25 % порівняно з групою осіб (16 %) зі збереженою функцією судин мікроциркуляторної ланки: 33,30; 66,70 % відповідно за відсутності осіб із САК понад 300 мг/г. Ця тенденція невірогідна (χ2 = 0,08, р = 0,13), проте повторює таку ж тенденцію щодо наявності показника САК понад 300 мг/г в осіб із порушенням функціонального стану ендотелію великих судин. Потрібно відмітити наявність феномену взаємообтяження в осіб зі зниженою рШКФ в межах 45–89 мл/хв/1,73 м2. Так, 56,25 % обстежених мають поєднання дисфункції ендотелію великих та дрібних судин, з них у 44,44 % відмічено показник САК 30–300 мг/г і у 11,11 % — САК понад 300 мг/г. Відсутність осіб із рівнем САК > 300 мг/г серед пацієнтів зі збереженою ендотеліальною функцією (як у середньому, так і в похилому віці) свідчить про тісний зв’язок між значною альбумінурією та ендотеліальною дисфункцією. Імовірно, САК > 300 мг/г можна розглядати як індикатор значного пошкодження судинної стінки, який відображає наявність системної ендотеліальної дисфункції. З метою корекції виявлених змін 39 особам різного віку з проявами КРМС до стандартної антигіпертензивної терапії було призначено дієтичну добавку Лібера (ТОВ «Біхелс», Україна). У всіх обстежених пацієнтів через 1 місяць стандартної терапії, доповненої дієтичною добавкою Лібера, збільшився показник приросту кровотоку, що свідчить про відновлення функціонального стану ендотелію великих судин та судин мікроциркуляторної ланки. На фоні відновлення функціонального стану ендотелію відмічена стійка тенденція до збільшення частки осіб із показником САК< 30 мг/г (χ2 = 0,04, р = 0,07), що свідчить про відновлення функціонального стану нирок при застосуванні Лібери (ТОВ «Біхелс», Україна). Такий ефект зумовлений тим, що екстракти з пагонів леспедези головчастої характеризуються доведеною нефропротекторною дією, що дозволяє використовувати їх для профілактики та лікування ХХН. Висновки. У осіб різного віку з проявами КРМС наявний феномен взаємообтяження: у понад половини пацієнтів із рШКФ 45–89 мл/хв/1,73 м2 (56,25 %) виявлено поєднану дисфункцію ендотелію як дрібних, так і великих судин, що супроводжується підвищеним рівнем САК (у 11,11 % — > 300 мг/г). Отримані дані свідчать про важливу роль підвищення показника САК як потенційного маркера ендотеліальної дисфункції на ранніх стадіях зниження функції нирок: високий рівень САК може виступати маркером наявного пошкодження ендотелію, тоді як низькі чи помірні значення (САК < 30 мг/г або 30–300 мг/г) ще можуть спостерігатися на фоні збереженої функції ендотелію. З метою ангіо- та нефропротекції в осіб з КРМС доцільно до стандартної антигіпертензивної терапії додавати леспедезу головчасту (дієтична добавка Лібера, ТОВ «Біхелс», Україна).
Background. Cardio-renal-metabolic syndrome (CRMS) is a cluster of pathological conditions that combine metabolic disorders, cardiovascular dysfunction, and kidney damage, forming an interconnected system of complications. Endothelial dysfunction plays a key role in the development and progression of this syndrome as an early marker of vascular damage associated with impaired vasodilation, chronic inflammation, and pro-atherogenic changes. At the same time, a decrease in the estimated glomerular filtration rate (eGFR) reflects not only kidney function but also the overall risk of cardiovascular events and mortality. Given the population aging and the increasing prevalence of CRMS among individuals of various age groups, especially middle-aged and elderly, studying the relationship between endothelial dysfunction and reduced eGFR is highly relevant. Early diagnosis of these changes may allow timely identification of individuals at high cardiorenal risk and implementation of approaches to the prevention, early detection, and treatment. The purpose was to assess kidney function and vascular endothelial status in individuals of different age groups with signs of CRMS and to evaluate the potential for correction of the detected changes using Lespedeza capitata extract (Libera dietary supplement, Behealth LLC, Ukraine) as a potential nephro- and angioprotective agent. Materials and methods. A total of 152 individuals of various ages were initially examined. Based on inclusion criteria, 58 people were excluded for various reasons. Comprehensive examination was carried out in 94 individuals (mean age of 54.82 ± 0.97 years), most of them demonstrated decreased eGFR, elevated urinary albumin-to-creatinine ratio (UACR), and impaired endothelial function. To correct these changes, Lespedeza capitata extract (Libera, Behealth LLC, Ukraine) was added to standard antihypertensive therapy. The supplement was administered at a dose of one capsule three times daily regardless of meals, for one month, to pre-screened individuals (n = 39). Effectiveness criteria included changes in eGFR, UACR, and markers of endothelial function (flow-mediated dilation assessed by reactive hyperemia). The observation period was one month. The examination included standard clinical, anthropometric, laboratory, and instrumental methods. Results. With age, a tendency toward decreased eGFR was observed: from 79.73 ± 1.91 mL/min/1.73 m2 in middle-aged individuals (47.28 ± 0.72 years) to 64.01 ± 2.21 mL/min/1.73 m2 in the elderly (67.18 ± 0.49 years). Among middle-aged people, eGFR was within G2 category (60–89 mL/min/1.73 m2) in 100 % of cases, while in 46 % of elderly individuals, it had decreased to G3a category (45–59 mL/min/1.73 m2). Normal or high eGFR (G1 category, ≥ 90 mL/min/1.73 m2) was preserved in only 10 % of elderly participants. Among middle-aged individuals with a slight decrease in eGFR within the G2 category (60–89 mL/min/1.73 m2), increased UACR was found in a third of the examined people, while in the elderly, a decrease in eGFR to 40–59 mL/min/1.73 m2 prevails, which is considered as chronic kidney disease within the G3a category accompanied by an increase in the UACR in 25 % of individuals. When assessing the functional state of the endothelium of large vessels, it was found that among the examined participants (n = 94) with different categories of eGFR (G1, G2, G3a), signs of endothelial dysfunction were observed in 54 (57.45 %).Of these, 19 patients (35.18 %) demonstrated severe impairment characterized by a vasospastic response to reactive hyperemia (by D.S. Celermajer method), indicating impaired endothelium-dependent vasodilation. Among individuals with endothelial dysfunction in large vessels, 70.4 % (n = 38) had UACR < 30 mg/g, 29.6 % (n = 16) had increased UACR: 10 people — at the level of 30–300 mg/g, and 6 people had UACR > 300 mg/g. At the same time, among individuals with preserved endothelial function, 65 % (n = 26) had UACR < 30 mg/g, 14 individuals had UACR of 30–300 mg/g, and none had UACR > 300 mg/g. Thus, UACR > 300 mg/g was recorded exclusively among patients with endothelial dysfunction (5 people, 9.2 %), showing a statistically significant difference (χ2 = 0.01; p = 0.03). Among individuals with eGFR reduced within categories G2 (60–89 mL/min/1.73 m2) and G3a (45–59 mL/min/1.73 m2), there was a decrease in microvascular endothelial function in 84 %. Among them, UACR < 30 mg/g was observed in 50.00 %, 30–300 mg/g — in 43.75 %, and > 300 mg/g — in 6.25 %. In participants with preserved microvascular endothelial function (16 %), the distribution was 33.3 % (< 30 mg/g) and 66.7 % (30–300 mg/g), with no individuals having UACR > 300 mg/g. Though this trend was not statistically significant (χ2 = 0.08, p = 0.13), it mirrored the association of UACR > 300 mg/g with large-vessel endothelial dysfunction. Importantly, a mutual burden phenomenon was observed in individuals with eGFR 45–89 mL/min/1.73 m2, with 56.25 % having combined large- and small-vessel endothelial dysfunction. Among them, 44.44 % had UACR of 30–300 mg/g and 11.11 % had UACR > 300 mg/g. The absence of UACR > 300 mg/g among patients with preserved endothelial function in both middle-aged and elderly groups confirms a strong association between significant albuminuria and endothelial dysfunction. UACR > 300 mg/g may indicate severe vascular wall damage and systemic endothelial dysfunction. To correct the detected changes, 39 individuals of various ages with manifestations of CRMS were prescribed Libera (Behealth LLC, Ukraine) in addition to standard antihypertensive therapy. After one month of treatment, all patients showed an increase in flow-mediated dilation, indicating restored endothelial function in both large and microcirculatory vessels. Restoration of endothelial function was accompanied by a stable trend toward increased proportion of people with UACR < 30 mg/g (χ2 = 0.04, p = 0.07), suggesting improved kidney function with Libera (Behealth LLC, Ukraine) supplementation. This effect is likely due to the proven nephroprotective action of Lespedeza capitata extract, making it a promising agent for the prevention and treatment of chronic kidney disease. Conclusions. Individuals of different age groups with CRMS demonstrated a mutual burden phenomenon: more than half of patients with eGFR of 45–89 mL/min/1.73 m2 (56.25 %) had both macro- and microvascular endothelial dysfunction, often accompanied by elevated UACR (> 300 mg/g in 11.11 %). These findings highlight the importance of UACR as a potential early marker of endothelial dysfunction during the initial stages of renal function decline. Elevated UACR may reflect existing endothelial injury, while low or moderate levels (UACR < 30 or 30–300 mg/g) may still be observed in patients with preserved endothelial function. For nephro- and angioprotection in individuals with CRMS, the addition of Lespedeza capitata (Libera dietary supplement, Behealth LLC, Ukraine) to standard antihypertensive therapy is advisable.
Вступ
Однією із сучасних світових тенденцій є стрімке старіння населення розвинених країн із збільшенням середньої тривалості життя. За прогнозами Всесвітньої організації охорони здоров’я (ВООЗ), у 2025 році кількість людей старше 60 років має збільшитись у шість разів порівняно з 1950 роком. Експерти ООН прогнозують, що до 2050 р. кількість осіб похилого віку становитиме третину від загальної кількості населення планети. Глобальне старіння населення — це дійсно серйозна проблема, яка становить виклик для суспільства в цілому, оскільки збільшення частки людей похилого віку призводить до багатьох негативних наслідків, включаючи зростання навантаження на систему охорони здоров’я за рахунок збільшення частки осіб із вікасоційованими захворюваннями [1]. Поряд із такою тенденцією також за даними ВООЗ, що ґрунтуються на результатах масштабного епідеміологічного дослідження STEPS (2019) в Україні, відмічено, що стандартизований за віком показник поширеності артеріальної гіпертензії (АГ) серед дорослих віком 30–79 років становить 43 % з розподілом за статтю 45 і 42 % відповідно у чоловіків і жінок [2]. Це становить близько 13,2 млн дорослих з АГ у зазначеному віковому діапазоні. Крім того, практично половина пацієнтів з АГ (49 %) отримує антигіпертензивну терапію, але лише 14 % мають контрольований артеріальний тиск (АТ) < 140/90 мм рт.ст. Такий вкрай низький показник ефективності контролю АТ у популяції є ключовим чинником серцево-судинної смерті, за яким Україна віднесена до категорії країн з дуже високим серцево-судинним ризиком, а АГ розглядається як найвпливовіший фактор ризику розвитку атеросклеротичних серцево-судинних захворювань і смерті від них [2].
Відомо, що АГ є однією з основних причин розвитку хронічної хвороби нирок (ХХН), коли розвивається пошкодження нефронів, канальцевого епітелію та ендотелію судин нирок. Згідно з актуальними європейськими рекомендаціями, ХХН визначається як аномалії структури або функції нирок, які наявні протягом щонайменше 3 місяців і мають наслідки для здоров’я [3, 4]. Класифікується ХХН за категорією швидкості клубочкової фільтрації (ШКФ) (G1–G5) і категорією альбумінурії (A1–A3). Для діагностики застосовують два основні показники: розрахункову швидкість клубочкової фільтрації (рШКФ), що розраховується на основі рівня креатиніну в сироватці крові за формулою Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI), а також співвідношення альбумін/креатинін (САК) у сечі. Протягом тривалого часу, особливо на початкових стадіях (G1–G2), ХХН залишалася недостатньо діагностованою, попри її значний внесок у підвищення серцево-судинної захворюваності та смертності. Зниження рШКФ відіграє ключову роль у патофізіології взаємозв’язку між ураженням нирок і кардіоваскулярними подіями, і, окрім інших факторів ризику, ХХН сама по собі є одним з найсильніших факторів ризику смерті від серцево-судинних захворювань (ССЗ) [5]. Так, у 2016 році ХХН була 13-ю у списку причин смерті. Прогнозується, що у 2040 році вона стане 5-ю причиною смерті [6].
Поєднання старіння, ХХН та гіпертензії створює замкнене коло, де кожен фактор погіршує інші, що призводить до підвищеного ризику ускладнень серцево-судинної системи (ССС). Клінічним проявом такої патофізіологічної взаємодії між факторами ризику АГ, ХХН і ССС є кардіоренометаболічний синдром (КРМС) [7]. Як наслідок, КРМС пов’язаний із більшою ймовірністю виникнення ускладнень — ІХС, інсульту, серцевої недостатності та раптової серцевої смерті [8]. Характерно, що КРМС стосується тих, хто має ризик ССЗ, та тих, хто вже має ССЗ. Як наслідок, вчасна рання діагностика та ефективне лікування з досягненням та утриманням АТ в межах цільового діапазону, а також вплив на фактори ризику здатні значно зменшити ризик розвитку фатальних та нефатальних ускладнень — мозкового інсульту, інфаркту міокарда та серцево-судинної смерті. Крім того, ефективний контроль АТ зменшує ризик розвитку фібриляції передсердь, серцевої недостатності та ХХН [2]. Сучасні дослідження акцентують увагу на важливості виявлення навіть помірного зниження функції нирок для своєчасного втручання у пацієнтів з групи ризику. За рекомендаціями 2024 року потрібно розглядати можливість початку лікування ХХН при першому ж прояві зниження рШКФ або підвищення САК [9].
З огляду на те, що на сьогодні недостатньо досліджено характер змін САК у сечі та їх взаємозв’язок із коливаннями рШКФ у пацієнтів із АГ, що поєднується з дисфункцією ендотелію, залишається важливим питання оцінки ранніх маркерів прогресування ураження нирок в осіб з АГ середнього та літнього віку.
Мета: оцінити функціональний стан нирок і судинного ендотелію в осіб різного віку з ознаками КРМС та з’ясувати можливості корекції виявлених змін із застосуванням екстракту леспедези головчастої (дієтична добавка Лібера, ТОВ «Біхелс», Україна) як потенційного засобу нефро- та ангіопротекції.
Матеріали та методи
Дослідження проведено у відділі фармакотерапії вікзалежних захворювань ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України». Протокол роботи був ухвалений Комітетом з медичної етики при ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України» № 2/25 від 24.02.2025 р. Клінічне дослідження проведено відповідно до чинного законодавства України і принципів Гельсінської декларації з прав людини.
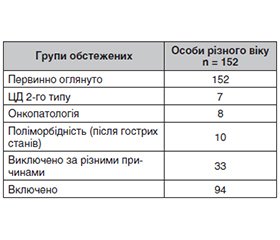
Первинно було обстежено 152 особи різного віку. Після ретельного відбору було виключено 58 осіб (табл. 1). Отже, проведено комплексне обстеження 94 осіб різного віку (середній вік 54,82 ± 0,97 року), з них чоловіків було 29 (30,85 %), жінок — 65 (69,15 %).
Групу осіб середнього віку (47,11 ± 0,78 року) становили 55 осіб: 20 чоловіків (36,36 %) та 35 жінок (63,63 %), похилого віку (67,18 ± 0,81 року) — 39 осіб, з яких було 8 чоловіків (20,51 %) та 31 жінка (79,50 %).
Таким чином, дослідження базується на результатах первинного обстеження 94 осіб різного віку та статі.
Критеріями включення в дослідження були: чоловіки і жінки віком 40–74 роки з помірним, високим і дуже високим ризиком розвитку ССЗ за шкалою SCORE-2 та АГ 2-го ступеня, порушеннями функції нирок (САК 30–300 мг/г та понад 300 мг/г, рШКФ 45–89 мл/хв/1,73 м2). Обов’язковою була здатність пацієнта до адекватного співробітництва та підписана ним письмова згода на участь у дослідженні.
Обстежені мали фактори серцево-судинного ризику та ознаки метаболічного синдрому за критеріями АТР III [10]: окружність талії ≥ 102 см у чоловіків і ≥ 88 см у жінок; холестерин ліпопротеїдів високої щільності < 1,03 ммоль/л у чоловіків і 1,29 ммоль/л у жінок; тригліцериди ≥ 1,7 ммоль/л; рівень артеріального тиску ≥ 130/85 мм рт.ст.; рівень глюкози натще ≥ 6,1 ммоль/л.
Обстеження проводили з використанням стандартних клінічних, антропометричних та лабораторних і інструментальних методів. Діагностику АГ та визначення ССЗ проводили відповідно до чинних європейських та національних рекомендацій [2, 11, 12]. Наявність ХХН та категорії змін рШКФ і альбумінурії оцінювали згідно з європейськими рекомендаціями [3, 4].
Стан вуглеводного обміну оцінювали за рівнями глікемії натще, постпрандіальної глікемії, визначеними ферментативним методом з використанням аналізатора Respons 920 (Німеччина), та рівнем глікованого гемоглобіну (HbA1c), визначеним імунотурбідиметричним тестом, посиленим частинками HbA1c.
Для оцінки стану ліпідного обміну визначали рівні загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) та низької щільності (ХС ЛПНЩ), тригліцеридів (ТГ) у сироватці венозної крові за стандартними біохімічними методиками на автоматичному біохімічному аналізаторі Respons 920 (Німеччина).
Рівні ЗХC визначали ферментативним фотометричним тестом CHOD-PAP, ТГ — ферментативним фотометричним тестом з гліцерол-3-фосфат–оксидазою, ХС ЛПВЩ — однорідним імунотестом із визначенням комплексів АГ-АТ, вміст ХС ЛПНЩ розраховували за формулою Фрідвальда (ХС ЛПНЩ = ЗХС – (ХС ЛПВЩ + ТГ/2,2), ммоль/л) [13]. Індекс атерогенності вираховувався як співвідношення ЗХС і ХС ЛПВЩ.
Щоб визначити ризик розвитку серцево-судинних захворювань, розраховували показник серцево-судинного ризику — індекс Castelli — як співвідношення ЗХС/ХС ЛПВЩ, та описане Boizel співвідношення ТГ і ХС ЛПВЩ > 3, що теж корелює з розвитком гострих коронарних ускладнень, а також використовувалась оновлена шкала SCORE-2 [14, 15].
Визначення рШКФ проводили за формулою CKD-EPI з урахуванням рівнів креатиніну сироватки крові (https://www.mdapp.co/egfr-calculator-by-ckd-epi-79/) [16–18]. Альбумін-креатинінове співвідношення сечі визначали на аналізаторі сечі M7 URISCAN Optima (YD Diagnostics Corp., Корея, постачальник в Україні ТОВ «МЕД ЕК СЕРВІС»).
Оцінку функціонального стану ендотелію мікросудинного русла проводили на двоканальному лазерному доплерівському флоуметрі BLF-21D (Transonic Systems Inc, США) у вихідному стані спокою, а також після проведення функціональної проби зі створенням реактивної гіперемії [19].
Функцію ендотелію великих судин визначали із застосуванням проби D.S. Celermajer, з постоклюзійною реактивною гіперемією за загальноприйнятою методикою на ультразвуковому апараті iE33 Philips, датчик L 11-3 (4,0 МГц) [20, 21].
Включеним у дослідження пацієнтам на додаток до стандартної антигіпертензивної терапії відповідно до уніфікованих клінічних протоколів було призначено дієтичну добавку Лібера (ТОВ «Біхелс», Україна) з метою корекції функціонального стану нирок та ендотелію в осіб різного віку з КРМС [2, 4]. Одна капсула дієтичної добавки Лібера (ТОВ «Біхелс», Україна) містить: екстракт стебла і листя леспедези головчастої (Lespedeza capitata) порошкоподібний 300 мг. Екстракт стебла і листя леспедези головчастої (Lespedeza capitata) містить флавоноїди, зокрема флавоноли — рутин; флавони, катехіни та інші біологічно активні речовини. Комплекс біологічно активних речовин стебла й листя леспедези головчастої збільшує діурез, зменшує азотемію, підвищує виділення натрію й меншою мірою калію, сприяє збільшенню ниркової фільтрації, прискорює виведення азотистих шлаків із сечею.
При виконанні статистичної обробки отриманих даних застосовані такі методи: розрахунок середнього арифметичного та його середньої похибки (М ± m), оцінка вірогідності різниці отриманих результатів у порівнюваних групах за допомогою критерію Стьюдента. Для порівняння частоти фіксації якісних показників застосовували критерій χ2 Пірсона для таблиць сполученості з поправкою Єйтса.
Результати та обговорення
Результати аналізу показали, що серед усіх учасників дослідження значно переважали жінки (69,15 %), тоді як чоловіків було лише 30,85 %. Особи середнього віку (47,11 ± 0,78 року) становлять більшість (62 % вибірки) з помітним переважанням жінок (63,63 %). У групі похилого віку (67,18 ± 0,81 року) частка чоловіків значно нижча (лише 20,51 %), що може бути пов’язано зі специфікою тривалості життя та захворюваності серед чоловіків. Можна помітити, що у групі середнього віку частка чоловіків ще відносно висока (36,36 %), але у старшій групі вона значно знижується до 20,51 %.
Це узгоджується із загальною тенденцією до старіння населення, за якої жінки мають довшу тривалість життя, та вказує на певні демографічні особливості вибірки, зокрема тривалість життя серед жінок, яка зазвичай є вищою.
У роботі підтверджено загальні тенденції старіння населення, коли кількість жінок похилого віку перевищує кількість чоловіків через біологічні та соціальні фактори.
Результати аналізу функції нирок за даними змін показника рШКФ (за рівнем креатиніну в сироватці крові) у обстежених свідчать про її зниження у більшості осіб старшого віку (67,18 ± 0,81 року) порівняно із особами середнього віку (47,11 ± 0,78 року) — 64,01 ± 2,21 мл/хв/1,73 м2 та 79,73 ± 1,91 мл/хв/1,73 м2 відповідно. Так, незначне зниження рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) притаманне всім обстеженим середнього віку (100 % випадків), тоді як в осіб похилого віку в 46 % випадків виявлено вірогідне зниження рШКФ у межах категорії G3а (45–59 мл/хв/1,73 м2) (χ2 = 0,0006, p = 0,0002). Лише у незначної частини обстежених (10 %) спостерігається нормальна або висока рШКФ у межах категорії G1 (≥ 90 мл/хв/1,73 м2).
Аналіз змін показника САК сечі показав, що у 71 % обстежених цей показник залишався в межах категорії альбумінурії А1 (< 30 мг/г), що свідчить про його нормальний або незначно підвищений рівень. Зміни показника САК сечі в межах категорії А2 (30–300 мг/г) та А3 (понад 300 мг/г) виявлено у 29 % обстежених — 24 та 5 % відповідно, що свідчить про наявне ураження нирок як органа-мішені.
Проаналізувавши отримані результати, можна розподілити обстежених на три клінічні групи за показником рШКФ та САК: 1-ша група — із показниками рШКФ 60–89 мл/хв/1,73 м2 та САК < 30 мг/г; 2-га група — рШКФ 60–89 мл/хв/1,73 м2 та САК 30–300 мг/г; 3-тя група — рШКФ 45–59 мл/хв/1,73 м2 та САК 30–300 мг/г та вище (табл. 2).
При ретельному аналізі виділених груп виявлено, що серед осіб середнього віку (1-ї та 2-ї груп) із незначним зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) виявлено підвищення показника САК у третини обстежених, тоді як в осіб похилого віку превалює зниження рШКФ 40–59 мл/хв/1,73 м2, яке розцінюється як ХХН у межах категорії G3а (табл. 3).
Потрібно зазначити, що у всіх підгрупах обстежених з різними категоріями рШКФ (G1, G2 та G3a) виявлялись особи з нормальним або незначно підвищеним рівнем альбумінурії в межах категорії А1 (< 30 мг/г). Найбільша частота таких хворих була в підгрупах осіб середнього віку з категоріями рШКФ G1 та G2.
Серед осіб похилого віку з категорією рШКФ G3a підвищення САК визначено в 25 % осіб. Однак відсоток осіб похилого віку із рШКФ G3a був вірогідно більшим (p < 0,05), ніж відсоток хворих з помірним підвищенням САК сечі порівняно з особами середнього віку.
Зниження функції нирок, що визначається за показником рШКФ, асоціюється з підвищеним ризиком серцево-судинної захворюваності та загальної смертності, і цей показник можна розглядати як фактор серцево-судинного ризику [22, 23]. Деякі дані свідчать про те, що ендотеліальна дисфункція наявна на ранніх стадіях ниркової недостатності, але недостатньо даних про її можливу роль у прогресуванні захворювання нирок [24, 25].
При оцінці функціонального стану ендотелію виявлено, що серед обстежених пацієнтів (n = 94) з різними категоріями рШКФ (G1, G2, G3а) ознаки ендотеліальної дисфункції спостерігалися у 54 осіб (57,45 %). Із них у 19 пацієнтів (35,18 %) зафіксовано крайній ступінь порушення — вазоспастичну реакцію при проведенні проби за методикою D.S. Celermajer, що свідчить про виражене порушення ендотелійзалежної вазодилатації.
Серед обстежених із дисфункцією ендотелію великих судин у 70,4 % (38 осіб) показник САК виявився < 30 мг/г, в 29,6 % (16 осіб) — 30–300 мг/г (10 осіб) та понад 300 мг/г (6 осіб). У групі осіб із збереженою функцією ендотелію: у 65 % (26 осіб) САК виявився < 30 мг/г; у 14 осіб САК виявився 30–300 мг/г; відсутні особи з САК понад 300 мг/г. Таким чином, лише серед пацієнтів з ендотеліальною дисфункцією зафіксовано САК > 300 мг/г (у 5 осіб, або 9,2 %), що демонструє вірогідну статистичну різницю (χ2 = 0,01; p = 0,03) (табл. 4).
Так, в осіб з дисфункцією ендотелію великих судин та зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) та G3а (45–59 мл/хв/1,73 м2) відмічене підвищення показника САК вище 300 мг/г (χ2 = 0,01, р = 0,03) порівняно з групою обстежених із збереженою функцією ендотелію. Порівняно з групою пацієнтів із збереженою ендотеліальною функцією це підсилює гіпотезу про зв’язок між порушенням ендотеліальної функції, прогресуванням зниження рШКФ та мікроальбумінурією.
В осіб зі зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) та G3а (45–59 мл/хв/1,73 м2) відмічено зниження ендотеліальної функції судин мікроциркуляторної ланки у 84 % випадків, при цьому САК < 30 мг/г виявлено у 50,00 %, САК в межах 30–300 мг/г виявлено у 43,75 % та САК понад 300 мг — у 6,25 % осіб порівняно з групою осіб (16 %) із збереженою функцією судин мікроциркуляторної ланки: 33,30; 66,70 % відповідно за відсутності осіб із САК понад 300 мг/г. Ця тенденція невірогідна (χ2 = 0,08, р = 0,13), проте вона повторює таку ж тенденцію щодо наявності показника САК понад 300 мг/г в осіб із порушенням функціонального стану ендотелію великих судин. Потрібно відмітити наявність феномену взаємообтяження в осіб зі зниженою рШКФ в межах 40–89 мл/хв/1,73 м2. Так, 56,25 % обстежених мають поєднання дисфункції ендотелію великих та дрібних судин, з них у 44,44 % відмічено показник САК 30–300 мг/г, у 11,11 % — понад 300 мг/г.
Таким чином, в результаті проведеного дослідження можна відокремити певні фенотипи пацієнтів зі зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) та G3а (45–59 мл/хв/1,73 м2): за віком — середнього та похилого віку, за показником САК — < 30 мг/г, 30–300 мг/г та понад 300 мг/г, з порушенням функції ендотелію великих судин та/або дрібних судин.
Відсутність осіб із рівнем САК > 300 мг/г серед пацієнтів зі збереженою ендотеліальною функцією (як у середньому, так і в похилому віці) свідчить про тісний зв’язок між значною альбумінурією та ендотеліальною дисфункцією. Імовірно, САК > 300 мг/г можна розглядати як індикатор значного пошкодження судинної стінки, який відображає наявність системної ендотеліальної дисфункції. Інакше кажучи, високий рівень САК може виступати маркером наявного пошкодження ендотелію, тоді як низькі чи помірні значення (САК < 30 мг/г або 30–300 мг/г) ще можуть спостерігатися на фоні збереженої функції ендотелію. Ці результати підкреслюють цінність комплексної оцінки як функції нирок, так і функціонального стану ендотелію для стратифікації серцево-судинного ризику, особливо в осіб із початковим зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) на фоні кардіоренометаболічного синдрому.
Отже, проведене обстеження дозволило сформулювати концепцію щодо потреби ранньої діагностики та корекції функціонального стану нирок та ендотелію в осіб різного віку з проявами КРМС. Відомо, що Lespedeza capitata (леспедеза головчаста), Lespedeza bicolor та інші представники виду Lespedeza sp., діючи як інгібітори ангіотензинперетворювального ферменту (АПФ), можуть мати ангіопротекторний та нефропротекторний ефекти. Показано, що проантоціанідини з L. capitata інгібують АПФ in vitro. Декілька європейських клінічних досліджень показали, що ін’єкції очищеного флавоноїду та екстракту проантоціанідину з L. capitata сприятливо вплинули на людей із ХХН [26, 27].
Відібраним в ході дослідження 39 особам різного віку з проявами КРМС (табл. 5) до стандартної антигіпертензивної терапії було призначено дієтичну добавку Лібера (ТОВ «Біхелс», Україна).
Як ми можемо бачити, всі включені в дослідження особи мали високий ризик серцево-судинних ускладнень, про що свідчить показник індексу Castelli: ЗХС/ХС ЛПВЩ, який перевищує 3, та показник SCORE-2. Це особи, більшість з яких досягла оптимального рівня систолічного та діастолічного артеріального тиску, проте вони мають порушення функціонального стану нирок та ендотелію на фоні гіперглікемії та дисліпідемії. Лібера призначалася як додаткове джерело біологічно активних речовин з метою покращення функціонального стану нирок та ендотелію по 1 капсулі 3 рази на добу незалежно від прийому їжі протягом 1 місяця. Характеристики пацієнтів, включених в дослідження, що отримували дієтичну добавку Лібера, вказані в табл. 5.
/19.jpg)
Зіставлення вихідних показників рШКФ, САК та функції ендотелію через 1 місяць динамічного спостереження при застосуванні Лібери (ТОВ «Біхелс», Україна) виявило, що показник рШКФ лишається незмінним (67,42 ± 4,39 мл/хв/1,73 м2) порівняно з вихідними даними (р > 0,05) в усіх обстежених пацієнтів через 1 місяць стандартної терапії, доповненої дієтичною добавкою Лібера, проте вірогідно зросла функція ендотелію великих судин та судин мікроциркуляторної ланки (табл. 6). На фоні відновлення функціонального стану ендотелію відмічене збільшення частки осіб із показником САК < 30 мг/г (χ2 = 0,04, р = 0,07), що свідчить про тенденцію до відновлення функціонального стану нирок при застосуванні Лібери (ТОВ «Біхелс», Україна). Такий ефект зумовлений тим, що екстракти з пагонів леспедези головчастої та з трави леспедези двоколірної близькі за хімічним складом і фармакологічними властивостями, а їх етанолові екстракти мають тривалу історію застосування і характеризуються доведеною нефропротекторною дією, що дозволяє їх використовувати для профілактики та лікування ХХН [28–30].
Результати дослідження продемонстрували, що включення дієтичної добавки Лібера до стандартного лікування є безпечним для ниркової функції, а також потенційно ефективним у покращенні системної ендотеліальної функції. Ці зміни можуть відігравати роль у запобіганні подальшому погіршенню стану судин та нирок, що особливо актуально для пацієнтів з початковими ознаками ендотеліальної дисфункції та проявами КРМС.
Висновки
1. Результати аналізу демографічної вибірки показали, що частка жінок вдвічі (69 %) більша за частку включених у дослідження чоловіків (31 %). Ця тенденція зберігається як серед осіб середнього (47,11 ± 0,78 року: жінки — 63 %, чоловіки — 37 %), так і похилого віку (67,18 ± 0,81 року: жінки — 79,5 %, чоловіки — 20,5 %). Вибірка підтверджує загальні демографічні тенденції: жінки переважають, а їх частка значно зростає з віком. Частка чоловіків у похилому віці значно знижена (20,5 %), що може бути пов’язано з вищою смертністю серед чоловіків: вони мають коротшу середню тривалість життя та схильність до серцево-судинних захворювань у більш ранньому віці.
2. Виявлена вірогідна різниця (χ2 = 0,0006, p = 0,0002) між віковими групами, що підтверджує тенденцію до прогресуючого зниження рШКФ у міру старіння: з віком відмічене зниження рШКФ, що свідчить про поступове погіршення функції нирок — в осіб середнього віку (100 %) рШКФ перебуває в ме–жах категорії G2 (60–89 мл/хв/1,73 м2), тоді як у 46 % осіб похилого віку рШКФ знижується до категорії G3а (45–59 мл/хв/1,73 м2). Нормальна або висока рШКФ (категорія G1, ≥ 90 мл/хв/1,73 м2) зберігається лише у 10 % обстежених.
З віком не лише вірогідно зростає частка осіб зі зниженням рШКФ у межах категорії G3а (45–59 мл/хв/1,73 м2), а й відмічається тенденція до зниження показника рШКФ з 79,73 ± 1,91 мл/хв/1,73 м2 у середньому віці (47,28 ± 0,72 року) до 64,01 ± 2,21 мл/хв/1,73 м2 у похилому віці (67,18 ± 0,49 року).
3. При оцінці функціонального стану ендотелію крупних судин виявлено, що серед обстежених пацієнтів (n = 94) з різними категоріями рШКФ (G1, G2, G3а) ознаки ендотеліальної дисфункції спостерігалися у 54 осіб (57,45 %). В осіб з дисфункцією ендотелію та зниженням рШКФ у межах категорії G2 (60–89 мл/хв/1,73 м2) та G3а (45–59 мл/хв/1,73 м2) відмічене підвищення показника САК більше за 300 мг/г (χ2 = 0,01, р = 0,03) порівняно з групою обстежених зі збереженою функцією ендотелію.
4. В осіб зі зниженим рівнем рШКФ у межах категорій G2–G3а (45–89 мл/хв/1,73 м2) виявлено тенденцію до порушення ендотеліальної функції судин мікроциркуляторного русла, що супроводжується збільшенням частоти альбумінурії. У 84 % таких осіб зафіксовано дисфункцію ендотелію, причому у 6,25 % — з високим рівнем САК (> 300 мг/г), на відміну від групи із збереженою мікросудинною функцією, у якій показник САК був у межах < 300 мг/г. Хоча виявлені відмінності статистично невірогідні (χ2 = 0,08; p = 0,13), спостерігається повторення подібної закономірності і для порушень ендотелію магістральних судин. Важливою є наявність феномена взаємообтяження: у понад половини пацієнтів із рШКФ 40–89 мл/хв/1,73 м2 (56,25 %) виявлено поєднану дисфункцію ендотелію як дрібних, так і крупних судин, що супроводжується підвищеним рівнем САК (у 11,11 % — > 300 мг/г). Отримані дані підкреслюють важливу роль підвищення показника САК як потенційного маркера ендотеліальної дисфункції на ранніх стадіях зниження функції нирок.
5. Додавання дієтичної добавки Лібера до стандартної терапії в осіб з КРМС протягом 1 місяця сприяє поліпшенню функції ендотелію судин з тенденцією до зростання частки пацієнтів з нормалізованим рівнем САК. Це вказує на потенційні кардіо- та нефропротекторні властивості Лібери й обґрунтовує доцільність її застосування у комплексній терапії КРМС.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 14.05.2025
Рецензовано/Revised 23.06.2025
Прийнято до друку/Accepted 26.06.2025
Список литературы
1. Ukraine-Human-Capital-Chartbook-2025. https://kse.ua/wp-content/uploads/2025/05/Ukraine-Human-Capital-Chartbook-2025.pdf.
2. Уніфікований клінічний протокол первинної та спеціалізованої медичної допомоги «Гіпертонічна хвороба (артеріальна гіпертензія)». https://www.dec.gov.ua/wp-ontent/uploads/2024/09/ykpmd_1581_12092024_dod.pdf.
3. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidneys. 2024;13(2):140-171. https://doi.org/10.22141/2307-1257.13.2. 2024.456.
4. Kalantar-Zadeh K, Jafar TH, Nitsch D, Neuen BL, Perko–vic V. Chronic kidney disease. Lancet. 2021 Aug 28. 398(10302). 786-802. doi: 10.1016/S0140-6736(21)00519-5. Epub 2021 Jun 24. PMID: 34175022.
5. Nath KA, Grande JP, Farrugia G, Croatt AJ, Belcher JD, Hebbel RP, et al. Age sensitizes the kidney to heme protein-induced acute kidney injury. Am J Physiol Renal Physiol. 2013;304:F317-F325. doi: 10.1152/ajprenal.00606.2012.
6. Sundström J, Bodegard J, Bollmann A, Vervloet MG, Mark PB, Karasik A, et al.; CaReMe CKD Investigators. Prevalence, outcomes, and cost of chronic kidney disease in a contemporary population of 2.4 million patients from 11 countries: the CaReMe CKD study. Lancet Reg Health Eur. 2022;20:100438, doi: 10.1016/j.lanepe.2022.100438.
7. Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory from the American Heart Association. Circulation. 2023;148:1606-1635. doi: 10.1161/CIR.0000000000001184.
8. Powell-Wiley TM, Poirier P, Burke LE, Després J-P, Gordon-Larsen P, Lavie CJ, et al.; on behalf of the American Heart Association Council on Lifestyle and Cardiometabolic Health; Council on Cardiovascular and Stroke Nursing; Council on Clinical Cardio–logy; Council on Epidemiology and Prevention; and Stroke Council. Obesity and cardiovascular disease: a scientific statement from the American Heart Association. Circulation. 2021;143:e984-e1010. doi: 10.1161/CIR.0000000000000973.
9. Yingying Zhang, Chen Yu, Xiaogang Li. Kidney Aging and Chronic Kidney Disease. Int J Mol Sci. 2024 Jun 14;25(12):6585. doi: 10.3390/ijms25126585. Affiliations expand PMID: 38928291; PMCID: PMC11204319.
10. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al.; American Heart Association, National Heart, Lung, and Blood Institute. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005;(112):2735-2752. https://doi.org/10.1161/CIRCULATIONAHA.105.169404.
11. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe; Free SCORE2 working group and ESC Cardiovascular risk collaboration. Eur Heart J. 2021 July 1;42(Iss 25):2439-2454. https://doi.org/10.1093/eurheartj/ehab309.
12. ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023 Dec 1;41(12):1874-2071. https://pubmed.ncbi.nlm.nih.gov/37345492/; doi: 10.1097/HJH.0000000000003480. Epub 2023 Sep 26.
13. Friedewald WT, Kevy IR, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem. 1972;18(6):499-502.
14. Baez-Duarte BG, Gínez IZ, Duarte RG, Rasgado ET, Vi–vanco GR, Fuentes RP. The Multidisciplinary Research Group оf Diabetes Celis Triglyceride/high-density Lipoprotein Cholesterol (TG/HDL-C) Index as a Reference Criterion of Risk for Metabolic Syndrome (MetS) and Low Insulin Sensitivity in Apparently Healthy Subjects. Gac Med Mex. 2017;153(2):152-158.
15. Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al., ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC). European Heart Journal. 2021 Sept 7;42(Iss 34):3227-3337. https://doi.org/10.1093/eurheartj/ehab484.
16. Matsushita K, Selvin E, Bash LD, Astor BC, Coresh J. Risk implications of the new CKD Epidemiology Collaboration (CKD-EPI) equation compared with the MDRD Study equation for estimated GFR: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Kidney Dis. 2010;55(4):648-59.
17. Mathew TH, Johnson DW, Jones GR. Chronic kidney disease and automatic reporting of estimated glomerular filtration rate: revised recommendations. The Medical Journal of Australia. 2007;187(8):459-63.
18. Johnson DW, Jones GR, Mathew TH, Ludlow MJ, Doogue MP, Jose MD, et al.; Australasian Creatinine Consensus Working Group. Chronic kidney disease and automatic reporting of estimated glomerular filtration rate: new developments and revised recommendations. Med J Aust. 2012;197(4):224-5.
19. Пат. 46415А України, МПК 6 А 61 В 5/00, А 61 В 10/00. Спосіб визначення функціонального стану ендотелію мікросудин у осіб похилого віку. Коркушко О.В., Лішневська В.Ю., Дужак Г.В.; заявник і патентовласник Інститут геронтології АМН України. № 2001074868; заявл. 11.07.2001; опубл. 15.05.2002. Бюл. № 5.
20. Deanfield J, Halcox JP, Rabelin TJ. Endothelial functionand dysfunction testing and clinical relevance. Circulation. 2007;15:1285-1295.
21. Thijssen DH, Black MA, Pyke KE, et al. Assessment of flow-mediated dilation in humans: a methodological and physiological guideline. Am. J. Physiol. Heart Circ. Physiol. 2011;300(1):2-12.
22. Reffelmann Th, Krebs A, Ittermann T, Empen K, Hummel A, Dörr M, Völzke H, Felix SB. Mild renal dysfunction as a non-traditional cardiovascular risk factor? Association of cystatin C-based glomerular filtration rate with flow-mediated vasodilation. Atherosclerosis. 2010 Aug;211(2):660-6. doi: 10.1016/j.atherosclerosis.2010.03.023. Epub 2010 Mar. Affiliations Expand MID: 20399428.
23. Perticone F, Maio R, Perticone M, Sciacqua A, Shehaj E, Naccarato P, Sesti G. Endothelial dysfunction and subsequent decline in glomerular filtration rate in hypertensive patients. Circulation. 2010 Jul 27;122(4):379-84. doi: 10.1161/CIRCULATIONAHA.110.940932. Epub 2010 Jul 12.
24. Bolton CH, Downs LG, Victory JGG, Dwight JF, Tomson CR, Mackness MI, Pinkney JH. Endothelial dysfunction in chronic renal failure: roles of lipoprotein oxidation and pro-inflammatory cytokines. Nephrol Dial Transplant. 2001;16:1189-1197.
25. Stam F, van Guldener C, Schalkwijk CG, ter Wee PM, Don–ker AJM, Stehouwer CDA. Impaired renal function is associated with markers of endothelial dysfunction and increased inflammatory acti–vity. Nephrol Dial Transplant. 2003;18:892-898.
26. Yarnell E. Botanical medicines for the urinary tract. World J. Urol. 2002;20(5):285-93. doi: 10.1007/s00345-002-0293-0. PMID: 12522584.
27. Yarnell E.L. Botanical medicines used for kidney disease in the United States. Iran. J. Kidney Dis. 2012;6(6):407-18. PMID: 23146977.
28. Зайченко Г., Кисличенко В., Процька В., Федосов А., Сімонов П. Перспективи застосування нефропротекторів рослинного походження на основі леспедези двоколірної. Сімейна медицина. Європейські практики. 2024;2:55-61. DOI: https://doi.org/10.30841/2786-720X.2.2024.307535.
29. Prospects for the use of Lespedeza preparations (Lespedeza sp.) for the treatment of kidney pathology and other diabetic complications. International Journal оf Endocrinology (Ukraine). 2023 Sept;19(5):6-15.
30. Серебровська З.О., Толстун Д.О., Сикало Н.В., Фархідінов І.О., Кропива В., Мигован С.А. та ін. Синергічний вплив екстрактів леспедези та артишоку в терапії хронічного захворювання нирок: механізми та перспективи. Нирки. 2025;14(1). doi: http://dx.doi.org/10.22141/2307-1257.14.1.2025.499.
/15.jpg)

/17.jpg)
/18.jpg)
/19.jpg)