Журнал «Почки» Том 14, №2, 2025
Вернуться к номеру
Особливості корекції дефіциту вітаміну D у пацієнтів із діабетичною хворобою нирок: роль вітамін-D-зв’язуючого білка
Авторы: Єрохович В.М., Карпенко О.В., Ільків Є.І., Кобиляк Н.М., Палієнко І.А., Красюк І.В., Комісаренко Ю.І.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
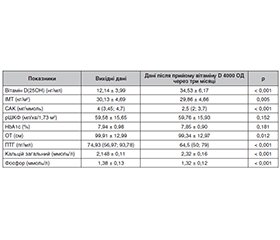
Актуальність. Актуальність проблеми ураження нирок при цукровому діабеті (ЦД) полягає у прогресуючих темпах зростання кількості пацієнтів щороку. Кістково-мінеральні розлади у таких пацієнтів зустрічаються з високою частотою та вимагають ранньої діагностики та своєчасної корекції. Метаболізм вітаміну D залежить від низки факторів, зокрема від рівня транспортних білків крові, таких як вітамін-D-зв’язуючий білок (ВДЗБ). Останнім часом дедалі більша увага приділяється ВДЗБ як причині кістково-мінеральних розладів і їх патогенетичному зв’язку з ураженням нирок у осіб із ЦД 2-го типу. Мета: оцінити особливості фосфорно-кальцієвого обміну в пацієнтів із діабетичною хворобою нирок і роль рівня ВДЗБ у корекції дефіциту вітаміну D. Матеріали та методи. У першому етапі дослідження взяли участь 84 особи з ЦД 2-го типу із хронічними хворобами нирок I–III стадій, розподілені на три групи згідно з розрахунковою швидкістю клубочкової фільтрації (рШКФ), у яких була проведена оцінка вихідних показників фосфорно-кальцієвого обміну. На другому етапі дослідження оцінювалися результати корекції дефіциту вітаміну D у 32 осіб при динамічному спостереженні після прийому препарату холекальциферолу протягом трьох місяців. Результати. Медіана показників вітаміну D(25OH) відповідала рівню дефіциту незалежно від рівня рШКФ, причому найнижче значення було у третьої групи пацієнтів — 13 (8,48–16,4) нг/мл, що відрізнялося від медіани показників першої (16,38 (13,88–19,83) нг/мл) та другої груп (18 (12,8–20,74) нг/мл), р < 0,05. Аналіз показника ВДЗБ у сироватці крові залежав від рШКФ: найнижчий спостерігався у першої групи — 93,6 (68,17–109,67) нг/мл і збільшувався відповідно зі зниженням рШКФ: 101,07 (75,34–132,84) нг/мл — друга група, 132,82 (97,3–168,8) нг/мл — третя, причому перша і друга суттєво відрізнялися (р < 0,01). Оцінка ефективності проведеної корекції дефіциту вітаміну D в обстежених виявилася кращою у пацієнтів із нижчим рівнем ВДЗБ крові. Так, рівень ВДЗБ був вірогідно вищим у підгрупі пацієнтів, які не досягли оптимального рівня вітаміну D (25(OH)D) через три місяці (31 %), порівняно з тими, у кого рівень 25(OH)D досягнув ≥ 30 нг/мл. Висновки. ВДЗБ є важливим фактором у процесах метаболізму вітаміну D, його рівень потрібно враховувати при корекції кістково-мінеральних розладів у пацієнтів із діабетичною хворобою нирок. Відзначається підвищення рівня ВДЗБ сироватки крові з прогресуванням хронічної хвороби нирок на фоні ЦД 2-го типу. Ефективність лікування залежить від рівня ВДЗБ сироватки крові у таких пацієнтів. У разі підвищення рівня ВДЗБ сироватки крові ефективність лікування нижча, ймовірно, через зменшення біодоступності вільного вітаміну D та його активну конверсію, оскільки активний 1,25(OH)2D посилено зв’язується із ВДЗБ.
Background. The relevance of the problem of kidney damage in diabetes mellitus (DM) lies in the annual progressive growth in the number of affected people. Bone mineral disorders occur with high frequency in such patients and require early diagnosis and timely correction. Vitamin D metabolism depends on some factors, including the level of blood transport proteins, such as vitamin D-binding protein (VDBP). Recently, increasing attention has been paid to the role of VDBP among the causes of bone mineral disorders and their pathogenetic relationship with kidney damage in people with type 2 DM. The purpose of the work is to assess the features of phosphorus-calcium metabolism in patients with diabetic kidney disease and the role of VDBP level in the correction of vitamin D deficiency. Materials and methods. In the first stage of the study, 84 people with type 2 DM and chronic kidney disease stages I–III participated, they were divided into 3 groups according to the estimated glomerular filtration rate (eGFR), and underwent assessment of baseline indicators of phosphorus-calcium metabolism. In the second stage, the results of the vitamin D deficiency correction were evaluated in 32 people during dynamic observation after taking cholecalciferol for 3 months. Results. The median vitamin D (25OH) values corresponded to the level of deficiency regardless of the eGFR, with the lowest value in group 3 — 13 (8.48–16.4) ng/ml, which differed from the median indicators of groups 1 (16.38 (13.88–19.83) ng/ml) and 2 (18 (12.8–20.74) ng/ml),
p < 0.05. Analysis of the serum VDBP depended on eGFR: the lowest level was observed in group 1 — 93.6 (68.17–109.67) ng/ml and increased in accordance with a decrease in eGFR: 101.07 (75.34–132.84) ng/ml in group 2, 132.82 (97.3–168.8) ng/ml in group 3, with significant difference between groups 1 and 2 (p < 0.01). The effectiveness of the vitamin D deficiency correction appeared to be better in patients with lower blood level of VDBP. Thus, it was significantly higher in the subgroup of patients who did not reach the optimal content of vitamin D (25(OH)D) after 3 months (31 %) compared to those who reached 25(OH)D ≥ 30 ng/ml. Conclusions. VDBP is an important factor in the processes of vitamin D metabolism, its level should be taken into account when correcting bone and mineral disorders in patients with diabetic kidney disease. The study showed that there is an increase in the serum VDBP with the progression of chronic kidney disease on the background of type 2 DM. The effectiveness of treatment depends on the blood level of VDBP in such patients. In case of serum VDBP increase, the effectiveness of treatment is lower, probably due to reduced bioavailability of free vitamin D and its active conversion since active 1,25(OH)2D binds more strongly to VDBP.
ЦД 2-го типу; хронічна хвороба нирок; кістково-мінеральні розлади; вітамін-D-зв’язуючий білок; вітамін D
type 2 diabetes mellitus; chronic kidney disease; bone and mineral disorders; vitamin D-binding protein; vitamin D