Международный эндокринологический журнал Том 21, №5, 2025
Вернуться к номеру
Сучасні аспекти комплексного лікування пацієнтів з нейроішемічною формою діабетичної стопи
Авторы: Приступюк М., Трембовецька Ю., Чемоданов П., Якимів Д.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
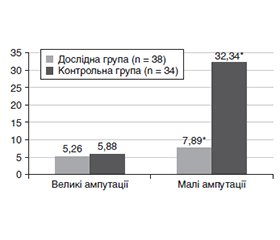
Актуальність. Нейроішемічна форма діабетичної стопи (ДС) характеризується поєднаним ураженням периферичних судин і нервів, що призводить до хронічних виразок, больового синдрому та високого ризику ампутацій. Пошук додаткових методів поліпшення периферичної перфузії є актуальним. Цилостазол — інгібітор фосфодіестерази III з вазодилатуючими й антиагрегантними властивостями — потенційно здатний поліпшувати мікроциркуляцію та перебіг нейропатії при цукровому діабеті (ЦД). Мета: оцінити клінічну ефективність додавання цилостазолу до стандартної терапії у пацієнтів з нейроішемічною формою діабетичної стопи, зокрема вплив на больовий синдром, частоту ампутацій та ризик шлунково-кишкових кровотеч. Матеріали та методи. Проведено відкрите рандомізоване дослідження за участю 72 пацієнтів із цукровим діабетом 2-го типу (ЦД2) та нейроішемічною формою ДС. Дослідна група (n = 38) додатково до стандартної антитромбоцитарної терапії отримувала цилостазол 100 мг/добу, контрольна група (n = 34) — лише стандартну терапію (ацетилсаліцилова кислота в поєднанні з клопідогрелем). Тривалість лікування — 6 місяців. Оцінювали інтенсивність больового синдрому за візуальною аналоговою шкалою (ВАШ), частоту малих та великих ампутацій нижніх кінцівок, випадки шлунково-кишкових кровотеч. Результати. Додавання цилостазолу сприяло суттєвому полегшенню болю: вже через 2 місяці у 84,2 % пацієнтів основної групи інтенсивність болю зменшилася до ≤ 3 бали за ВАШ без потреби в додаткових аналгетиках, тоді як у контролі — лише у 11,76 % (p < 0,001). За 6 місяців частка пацієнтів, яким виконано малі ампутації, була значно нижчою у групі цилостазолу (7,89 проти 32,35 %, p = 0,018). Частота великих ампутацій не відрізнялася (приблизно 5 % в обох групах). Випадки шлунково-кишкових кровотеч були поодинокими (5,26 проти 5,88 %, p > 0,05). Значущих побічних ефектів терапії цилостазолом не виявлено. Висновки. У пацієнтів із нейроішемічною формою діабетичної стопи додавання цилостазолу до стандартної терапії вірогідно зменшує хронічний біль та потребу в малих ампутаціях, не підвищуючи ризику шлунково-кишкових кровотеч. Цилостазол можна розглядати як ефективний і відносно безпечний препарат у комплексному лікуванні діабетичної стопи.
Background. The neuroischemic form of diabetic foot is characterized by combined damage to peripheral vessels and nerves, leading to chronic ulcers, pain syndrome, and a high risk of amputations. The search for additional methods to improve peripheral perfusion remains relevant. Cilostazol, a phosphodiesterase III inhibitor with vasodilatory and antiplatelet properties, has the potential to improve microcirculation and the course of neuropathy in diabetes mellitus. The purpose of the study was to evaluate the clinical efficacy of adding cilostazol to standard therapy in patients with neuroischemic form of diabetic foot syndrome, in particular the effect on pain syndrome, amputation rate, and risk of gastrointestinal bleeding. Materials and methods. An open randomized study was conducted involving 72 patients with type 2 diabetes mellitus and the neuroischemic form of diabetic foot. The study group (n = 38) received cilostazol 100 mg/day in addition to standard antiplatelet therapy, while the control group (n = 34) received standard therapy alone (acetylsalicylic acid combined with clopidogrel). The treatment duration was 6 months. Pain intensity was assessed using the Visual Analogue Scale, along with the frequency of minor and major lower limb amputations and cases of gastrointestinal bleeding. Results. The addition of cilostazol significantly relieved pain: in 2 months, 84.2 % of patients in the main group experienced pain reduction to ≤ 3 points on the Visual Analogue Scale without the need for additional analgesics, compared to only 11.76 % in the control group (p < 0.001). After 6 months, the proportion of patients who underwent minor amputations was significantly lower in the cilostazol group (7.89 vs. 32.35 %; p = 0.018). The frequency of major amputations did not differ (approximately 5 % in both groups). Cases of gastrointestinal bleeding were rare (5.26 vs. 5.88 %, p > 0.05). No significant adverse effects of cilostazol therapy were identified. Conclusions. In patients with the neuroischemic form of diabetic foot, the addition of cilostazol to standard therapy significantly reduces chronic pain and the need for minor amputations without increasing the risk of gastrointestinal bleeding. Cilostazol can be considered an effective and relatively safe agent in the comprehensive treatment of diabetic foot.
діабетична стопа; мікроциркуляція; ангіопротектор; антиагрегантна терапія; цукровий діабет; нейроішемія; ампутація; біль; Плестазол
diabetic foot syndrome; microcirculation; angioprotector; antiplatelet therapy; diabetes mellitus; neuroischemia; amputation; pain
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Armstrong DG, Boulton AJM, Bus SA. Diabetic foot ulcers and their recurrence. New England Journal of Medicine. 2017;376(24):2367-2375. https://doi.org/10.1056/NEJMra1615439.
- International Working Group on the Diabetic Foot. Definitions and criteria for diabetes-related foot disease. 2019. Retrieved from: https://iwgdfguidelines.org.
- Kim MJ, Park KG, Lee KM, Lee MK. Cilostazol improves endothelial function in hyperglycemia via activation of AdipoR1/SIRT1/AMPK signaling [Abstract 1587]. Diabetes. 2021;70(Suppl 1).
- Tseng SY, Chang HY, Li YH, Chao TH. Effects of cilostazol on angiogenesis in diabetes through adiponectin/AdipoR1/Sirtuin1 signaling pathway. International Journal of Molecular Sciences. 2022;23(23):14839. https://doi.org/10.3390/ijms232314839.
- Cha JJ, Cho JY, Lim S, et al. Effect of cilostazol on patients with diabetes who underwent endovascular treatment for peripheral artery disease. Journal of the American Heart Association. 2023;12(12):e027334. https://doi.org/10.1161/JAHA.122.027334.
- Desai K, Han B, Kuziez L, et al. Literature review and meta-analysis of the efficacy of cilostazol on limb salvage rates after infrainguinal endovascular and open revascularization. Journal of Vascular Surgery. 2021;73(2):711-721.e3. https://doi.org/10.1016/j.jvs.2020.08.125.
- Aboyans V, Ricco JB, Bartelink MEL, et al.; ESC Scientific Document Group. 2017 ESC Guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS). European Heart Journal. 2018;39(9):763-816. https://doi.org/10.1093/eurheartj/ehx095.
- Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 AHA/ACC guideline on the management of patients with lower extremity peripheral artery disease: A report of the American Heart Association/American College of Cardiology Task Force on clinical practice guidelines. Circulation. 2017;135(12):e726-e779. https://doi.org/10.1161/CIR.0000000000000470.
- Hingorani A, LaMuraglia GM, Henke P, et al. The management of diabetic foot: A clinical practice guideline by the Society for Vascular Surgery in collaboration with the American Podiatric Medical Association. Journal of Vascular Surgery. 2016;63(2 Suppl):3S-21S. https://doi.org/10.1016/j.jvs.2015.10.003.
- de Franciscis S, Gallelli L, Battaglia L, et al. Cilostazol prevents foot ulcers in diabetic patients with peripheral vascular disease: A randomized trial. International Wound Journal. 2015;12(3):250-253. https://doi.org/10.1111/iwj.12085.
- Canonico ME, Piccolo R, Avvedimento M, et al. Antithrombotic therapy in peripheral artery disease: Current evidence and future directions. Journal of Cardiovascular Development and Disease. 2023;10(4):164. https://doi.org/10.3390/jcdd10040164.
- Tseng SY, Chao TH, Li YH, et al. Cilostazol improves high glucose-induced impaired angiogenesis in human endothelial progenitor cells and vascular endothelial cells as well as enhances vasculoangiogenesis in hyperglycemic mice via the AMPK pathway. Journal of Vascular Surgery. 2016;63(4):1051-1062.e3. https://doi.org/10.1016/j.jvs.2014.10.103.
- Musial DC, Ajita ME, Bomfim GHS. Benefits of cilostazol’s effect on vascular and neuropathic complications caused by diabetes. Medical Sciences. 2025;13(1):1. https://doi.org/10.3390/medsci13010001.
- Chiu HW, Shih CC, Huang HJ, et al. Cilostazol attenuates vascular inflammation via the regulation of TICAM1/IRF3 signaling pathway. Biomedicine & Pharmacotherapy. 2025;189:118275.
- Chang L-L, Wu Y-M, Wang H-C, et al. Cilostazol ameliorates motor dysfunction and Schwann cell impairment in streptozotocin-induced diabetic rats. International Journal of Molecular Sciences. 2024;25(14):7847. https://doi.org/10.3390/ijms25147847.
- Petrenko O, Badziukh S, Korsa V, et al. Topical application of autologous plasma-derived plasminogen accelerates healing of chronic foot ulcers in type 2 diabetes patients. The International Journal of Lower Extremity Wounds. 2024. Advance online publication. https://doi.org/10.1177/15347346241256025.
- Kolosovych IV, Hanol IV. Hemocoagulation factors of hemor–rhagic complications in acute pancreatitis. Fiziologichnyi Zhurnal. 2022;68(1):56-61. https://doi.org/10.15407/fz68.01.056.
- Prystupiuk M. The use of inhaled analgesic Umerox (methoxyflurane) in a surgical inpatient setting. PRMD [Internet]. 2025 Jun 17;8(1):15-20. Available from: https://perioperative.org.ua/index.php/prtmdc/article/view/132.