Международный эндокринологический журнал Том 21, №5, 2025
Вернуться к номеру
Інтеграція дапагліфлозину в багатокомпонентну терапевтичну стратегію вторинної профілактики у пацієнтів із цукровим діабетом 2-го типу після перенесеного інфаркту міокарда
Авторы: Кузьменко Л.А., Кобиляк Н.М.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
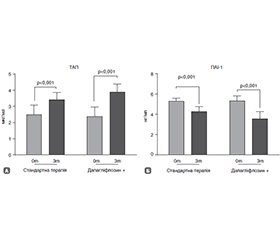
Актуальність. Постінфарктний кардіосклероз (ПІКС) у пацієнтів з цукровим діабетом 2-го типу (ЦД2) супроводжується пришвидшеним ремоделюванням міокарда, дисбалансом металопротеїназ та системи фібринолізу, що підвищує ризик повторних серцево-судинних подій. Оптимізація медикаментозної корекції цих змін є ключовим завданням для підвищення ефективності вторинної профілактики ішемічної хвороби серця (ІХС). Мета: оцінити вплив додавання дапагліфлозину до стандартної терапії у пацієнтів з ПІКС та супутнім ЦД2 на ліпідний профіль, біомаркери судинного ремоделювання (MMP-2, MMP-9) та запалення (IЛ-1β, ФНП-α, ПAI-1, ТАП). Матеріали та методи. Проспективне дослідження включило вибірку з 50 хворих на ЦД2 з інфарктом міокарда в анамнезі. Пацієнти були розподілені на дві групи: перша група (n = 24) отримувала стандартну терапію ІХС, друга група (n = 26) — стандартну терапію з додаванням інгібітора натрійзалежного котранспортера глюкози 2-го типу (НЗКТГ-2). Усім хворим проведено клініко-інструментальне та лабораторне обстеження: 24-годинне холтерівське моніторування ЕКГ, трансторакальну ехокардіографію (ЕхоКГ), ліпідний профіль, визначення матриксних металопротеїназ (ММП-2 та ММП-9), плазміноген-активаторного інгібітора 1 (ПAI-1), тканинного активатора плазміногену (ТАП), інтерлейкіну 1β (ІЛ-1β) та фактора некрозу пухлини α (ФНП-α). Результати. Після трьох місяців терапії в обох групах статистично значуще зниження рівня ліпідів у сироватці крові спостерігалося лише у внутрішньогруповому аналізі. Біомаркери MMP-2, MMP-9, ІЛ-1β, ФНП-α та ПАІ-1, ТАП змінились більш виражено та статистично значуще у пацієнтів, які отримували дапагліфлозин, порівняно з групою стандартного лікування. Висновки. Дисбаланс ферментів позаклітинного матриксу у пацієнтів із ПІКС та ЦД 2-го типу визначає патогенетичні механізми прогресуючого ремоделювання міокарда та формування несприятливого прогнозу. Доповнення стандартної терапії інгібітором НЗКТГ-2 асоціюється з нормалізацією профілю біомаркерів ремоделювання та потенційним підвищенням ефективності заходів вторинної профілактики у цієї категорії хворих.
Background. Post-infarction cardiosclerosis (PICS) in patients with type 2 diabetes mellitus (T2DM) is associated with accelerated myocardial remodeling, imbalance of matrix metalloproteinases (MMP) and the fibrinolytic system, which increases the risk of recurrent cardiovascular events. Optimizing the pharmacological correction of these changes is a key objective for enhancing the effectiveness of secondary prevention of coronary artery disease. The purpose was to assess the effect of adding dapagliflozin to standard therapy in patients with PICS and concomitant T2DM on lipid profile, biomarkers of vascular remodeling (MMP-2, MMP-9) and inflammation (interleukin (IL) 1β, tumor necrosis factor α (TNF-α), plasminogen activator inhibitor 1 (PAI-1), thrombin activatable fibrinolysis inhibitor (TAFI)). Materials and methods. A prospective study included a sample of 50 patients with T2DM and a history of myocardial infarction. Patients were divided into two groups: group 1 (n = 24) received standard coronary artery disease therapy; group 2 (n = 26) received standard therapy with the addition of a sodium glucose cotransporter 2 (SGLT2) inhibitor. All patients underwent clinical, instrumental, and laboratory examinations: 24-hour Holter ECG monitoring, transthoracic echocardiography, assessment of lipid profile (total cholesterol, triglycerides, low- and high-density lipoprotein cholesterol), MMP-2 and MMP-9, PAI-1, tissue plasminogen activator, IL-1β, and TNF-α. Results. After 3 months of therapy, significant reduction in the serum levels of lipids in both groups were observed only in the intra-group analysis. Changes in biomarkers of vascular remodeling (MMP-2, MMP-9), inflammation (IL-1β, TNF-α) and proteolytic cascade activation (PAI-1, TAFI) were more pronounced and significant in patients receiving dapagliflozin as compared to standard therapy group. Conclusions. Imbalance of extracellular matrix enzymes in patients with PICS and T2DM contributes to the pathogenesis of progressive myocardial remodeling and an unfavorable prognosis. Supplementation of standard therapy with a SGLT2 inhibitor is associated with normalization of remodeling biomarker profiles, improvement in cardiovascular functional status, and potentially increased effectiveness of secondary prevention in this patient population.
постінфарктний кардіосклероз; генералізований атеросклероз; ішемічна хвороба серця; цукровий діабет 2-го типу; матриксні металопротеїнази; інтерлейкін 1β; плазміноген-активаторний інгібітор 1; тканинний активатор плазміногену; фактор некрозу пухлини α; комбінована терапія; інгібітор натрійзалежного котранспортера глюкози 2-го типу (дапагліфлозин); вторинна профілактика
post-infarction cardiosclerosis; generalized atherosclerosis; coronary artery disease; type 2 diabetes mellitus; matrix metalloproteinases 2, 9; interleukin 1β; plasminogen activator inhibitor 1; tissue plasminogen activator; tumor necrosis factor α; combined therapy; sodium glucose cotransporter 2 inhibitor (dapagliflozin); secondary prevention
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Nedkoff L, Briffa T, Zemedikun D, Herrington S, Wright FL. Global Trends in Atherosclerotic Cardiovascular Disease. Clin Ther. 2023 Nov 1;45(11):1087-91. doi: 10.1016/j.clinthera.2023.09.020.
- Joglekar AA, Vyas MK, Bhojani MK. Recent advances in diag–nosis and management of ischemic heart diseases in perspective of contemporary and Ayurveda medicine — a comprehensive review. J Indian Syst Med. 2023 Jan;11:41-50. doi: 10.4103/jism.jism_92_22.
- Pandey A, Khan MS, Patel KV, Bhatt DL, Verma S. Predicting and preventing heart failure in type 2 diabetes. Lancet Diabetes Endocrinol. 2023 Aug 1;11(8):607-24. doi: 10.1016/S2213-8587(23)00128-6.
- Aponte Ribero V, Efthimiou O, Abolhassani N, Alwan H, Bauer DC, Henrard S, et al. Diabetes and the risk of cardiovascular events and all-cause mortality among older adults: an individual participant data analysis of five prospective studies. Eur J Clin Invest. 2025 Feb 1;55(2). doi: 10.1111/eci.14340.
- van der Pol A, Peters MC, Jorba I, Smits AM, van der Kaaij NP, Goumans MJ, et al. Preclinical extracellular matrix-based treatment strate–gies for myocardial infarction: a systematic review and meta-ana–lysis. Commun Med. 2025 Dec 1;5(1):1-16. doi: 10.1038/s43856-025-00812-y.
- Wang X, Yu S, Xie L, Xiang M, Ma H. The role of the extracellular matrix in cardiac regeneration. Heliyon. 2025 Jan 15;11(1). doi: 10.1016/j.heliyon.2024.e41157.
- Hamze J, Broadwin M, Stone C, Muir KC, Sellke FW, Abid MR. Developments in Extracellular Matrix-Based Angiogenesis Therapy for Ischemic Heart Disease: A Review of Current Strategies, Methodologies and Future Directions. BioTech. 2025 Mar 1;14(1). doi: 10.3390/biotech14010023.
- Bräuninger H, Krüger S, Bacmeister L, Nyström A, Eyerich K, Westermann D, et al. Matrix metalloproteinases in coronary artery disease and myocardial infarction. Basic Res Cardiol. 2023 Dec 1;118(1):18. doi: 10.1007/s00395-023-00987-2.
- Zhang H, Dhalla NS. The Role of Pro-Inflammatory Cytokines in the Pathogenesis of Cardiovascular Disease. Int J Mol Sci. 2024 Jan 16;25(2):1082. doi: 10.3390/ijms25021082.
- Katkenov N, Mukhatayev Z, Kozhakhmetov S, Sailybayeva A, Bekbossynova M, Kushugulova A. Systematic Review on the Role of IL-6 and IL-1β in Cardiovascular Diseases. J Cardiovasc Dev Dis. 2024 Jul 1;11(7):206. doi: 10.3390/jcdd11070206.
- Shaikh SB, Balaya RDA, Dagamajalu S, Bhandary YP, Unwalla H, Prasad TSK, et al. A signaling pathway map of plasminogen activator inhibitor-1 (PAI-1/SERPINE-1): a review of an innovative frontier in molecular aging and cellular senescence. Cell Commun Signal. 2024 Dec 1;22(1). doi: 10.1186/s12964-024-01910-5.
- Khoddam A, Vaughan D, Wilsbacher L. Role of plasminogen activator inhibitor-1 (PAI-1) in age-related cardiovascular pathophysiology. J Cardiovasc Aging. 2025;5:8. http://dx.doi.org/10.20517/jca.2024.38.
- Feng YF, Su MY, Xu HX, Zhang SZ, Ma YF, Chen HP. Plasma tissue plasminogen activator-inhibitor complex levels in acute myocardial infarction patients: an observational study. BMC Cardiovasc Disord. 2024 Dec 1;24(1):722. doi: 10.1186/s12872-024-04406-9.
- Xu Z, Huang Y. Blood PAI-1 and cardiovascular and metabolic risk factors among the middle-aged women from SWAN study. Sci Rep. 2024 Dec 1;14(1). doi: 10.1038/s41598-024-71908-z.
- Vrints C, Andreotti F, Koskinas KC, Rossello X, Adamo M, Ainslie J, et al. 2024 ESC Guidelines for the management of chronic coronary syndromes. Eur Heart J. 2024 Sep 21;45(36):3415-537. https://doi.org/10.1093/eurheartj/ehae177.
- Writing Committee Members, Virani SS, Newby LK, Arnold SV, Bittner V, Brewer LC, et al. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the Management of Patients With Chro–nic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2023 Aug 29;82(9):833-955. https://doi.org/10.1161/CIR.0000000000001168.
- Zhang R, Xie Q, Lu X, Fan R, Tong N. Research advances in the anti-inflammatory effects of SGLT inhibitors in type 2 diabetes mellitus. Diabetol Metab Syndr. 2024 May 12;16(1):1-15. doi: 10.1186/s13098-024-01325-9.
- Rykova EY, Klimontov VV, Shmakova E, Korbut AI, Merkulova TI, Kzhyshkowska J. Anti-Inflammatory Effects of SGLT2 Inhibitors: Focus on Macrophages. Int J Mol Sci. 2025 Feb 15;26(4):1670. doi: 10.3390/ijms26041670. PMID: 40004134; PMCID: PMC11854991.
- James S, Erlinge D, Storey RF, McGuire DK, de Belder M, Eriksson N, Andersen K, et al. Dapagliflozin in Myocardial Infarction without Diabetes or Heart Failure. NEJM Evid. 2024 Feb;3(2):EVIDoa2300286. doi: 10.1056/EVIDoa2300286. Epub 2023 Nov 11. PMID: 38320489.
- Наказ МОЗ України від 23.12.2021 р. № 2857 «Про затвердження Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Стабільна ішемічна хвороба серця» [cited 2025 Jul 27]. Available from: https://moz.gov.ua/uk/decrees/nakaz-moz-ukraini-vid-23122021--2857-pro-zatverdzhennja-unifikovanogo-klinichnogo-protokolu-pervinnoi-vtorinnoi-specializovanoi-ta-tretinnoi-visokospecializovanoi-medichnoi-dopomogi-stabilna-ishemichna-hvoroba-sercja.
- Professional Performance Guidelines [Internet]. [cited 2025 Aug 26]. Available from: https://www.svu.org/practice-resources/professional-performance-guidelines/?utm_source.
- Fukada H, Kon K, Yaginuma R, Uchiyama A, Morinaga M, Ishizuka K, et al. Effectiveness and risks of dapagliflozin in treatment for metabolic dysfunction-associated steatotic liver disease with type 2 diabetes: a randomized controlled trial. Front Med. 2025;12:1542741. doi: 10.3389/fmed.2025.1542741.
- Bechmann LE, Emanuelsson F, Nordestgaard BG, Benn M. SGLT2-inhibition increases total, LDL, and HDL cholesterol and lo–wers triglycerides: Meta-analyses of 60 randomized trials, ove–rall and by dose, ethnicity, and drug type. Atherosclerosis. 2024 Jul 1;394:117236. doi: 10.1016/j.aterosclerosis.2023.117236.
- Lipid Luminations: The Impact of Sodium-Glucose Co-Transporter 2 Inhibitors on Lipid Profile [Internet]. [cited 2025 Aug 27]. Available from: https://www.lipid.org/lipid-spin/spring-2022/lipid-luminations-impact-sodium-glucose-co-transporter-2-inhibitors-lipid?utm_source DOI: 10.1016/j.aterosclerosis.2023.117236.
- Hayashi T, Fukui T, Nakanishi N, Yamamoto S, Tomoyasu M, Osamura A, et al. Dapagliflozin decreases small dense low-density lipoprotein-cholesterol and increases high-density lipoprotein 2-cholesterol in patients with type 2 diabetes: Comparison with sitagliptin. Cardiovasc Diabetol. 2017 Jan 13;16(1):1-13. doi: 10.1186/s12933-016-0491-5.
- Miller E, Shubrook JH. Sodium glucose co-transporter 2 inhibitors in the treatment of type 2 diabetes mellitus. Osteopath Fam Physician. 2015 Sep 1;7(5):10-30. doi: 10.1177/0145721715607643.
- Ye Y, Bajaj M, Yang HC, Perez-Polo JR, Birnbaum Y. SGLT-2 Inhibition with Dapagliflozin Reduces the Activation of the Nlrp3/ASC Inflammasome and Attenuates the Development of Diabetic Cardiomyopathy in Mice with Type 2 Diabetes. Further Augmentation of the Effects with Saxagliptin, a DPP4 Inhibitor. Cardiovasc Drugs Ther. 2017 Apr 1;31(2):119-32. doi: 10.1007/s10557-017-6725-2.
- Bryk-Wiązania AH, Undas A. Hypofibrinolysis in type 2 diabetes and its clinical implications: from mechanisms to pharmacological modulation. Cardiovasc Diabetol. 2021 Dec 1;20(1):191. doi: 10.1186/s12933-021-01372-w.
- Dziewierz A, Zabojszcz M, Natorska J, Ślusarczyk-Dolecka M, Kuleta M, Siudak Z. Dapagliflozin reduces plasma concentration of plasminogen activator inhibitor-1 in patients with heart failure with preserved ejection fraction and type 2 diabetes. Polish Arch Intern Med. 2022 Dec 21;132(12). doi: 10.20452/pamw.16383.