Международный эндокринологический журнал Том 21, №7, 2025
Вернуться к номеру
Порівняльна характеристика ліпідного спектра у пацієнтів з кардіоренометаболічним синдромом залежно від його стадії та цукровим діабетом 2-го типу
Авторы: Чмир Н.В., Дутка Р.Я., Дроник І.С., Абрагамович Х.Я., Діденко О.З., Дробінська Н.В., Федечко М.Й., Кобак Л.О., Івасівка Р.С., Леонт’єва З.Р., Матущак О.М., Базилевич А.Я.
ДНП «Львівський національний медичний університет імені Данила Галицького», м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
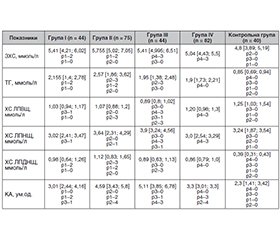
Актуальність. Кардіоренометаболічний синдром (КРМС) — мультифакторний патологічний стан, у патогенезі якого поєднуються взаємопосилювальні механізми серцево-судинних, ниркових та метаболічних порушень, що суттєво підвищує ризик прогресування ішемічної хвороби серця (ІХС), цукрового діабету 2-го типу (ЦД2) та хронічної хвороби нирок (ХХН). Мета дослідження: провести порівняльну характеристику ліпідного спектра у пацієнтів з кардіоренометаболічним синдромом залежно від його стадії та наявності цукрового діабету 2-го типу. Матеріали та методи. Усім пацієнтам з КРМС проведено загальноклінічне обстеження з підтвердженням діагнозу ЦД2 та ІХС. Пацієнтів розподілено на шість основних клінічних груп залежно від наявності/відсутності ІХС та ЦД2 (з урахуванням ступеня компенсації), а також на контрольну групу. Дослідження проводилося у чотири етапи: аналіз показників ліпідного обміну у пацієнтів з КРМС без ІХС і ЦД2, вивчення ліпідного спектра у хворих з КРМС за наявності ІХС, оцінка ліпідного профілю у пацієнтів з КРМС та ЦД2, аналіз змін ліпідного обміну при КРМС за наявності ІХС та ЦД2. Результати. У пацієнтів із КРМС без ІХС та ЦД2 спостерігається вірогідне підвищення рівнів тригліцеридів (ТГ), холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ), що свідчить про ранню активацію процесів атерогенезу. При поєднанні КРМС з ІХС зміни ліпідного обміну є більш вираженими — зростають рівні загального холестерину (ЗХС), ХС ЛПНЩ, а рівень ХС ЛПВЩ знижується. У пацієнтів з КРМС і ЦД2 незалежно від рівня компенсації виявлено підвищення ТГ, ЗХС та ХС ЛПДНЩ порівняно з контрольною групою, при цьому найвищі значення цих показників виявлені при декомпенсації ЦД2 у поєднанні з ІХС. За наявності КРМС відбуваються неспецифічні атерогенні зміни ліпідного спектра, які прогресують при приєднанні ІХС та/або ЦД2, що формує високу проатеросклеротичну загрозу. Висновки. У хворих на КРМС без ІХС і ЦД2 виявляються порушення ліпідного спектра крові у вигляді вірогідного підвищення рівнів ТГ, ХС ЛПДНЩ та коефіцієнта атерогенності, що свідчить про початок атерогенезу. У пацієнтів з КРМС та ІХС прогресування інсулінорезистентності супроводжується більш вираженими порушеннями ліпідного обміну — вірогідним зростанням ТГ і ХС ЛПДНЩ, а також підвищенням ЗХС на 12,7 % (p = 0,001), ХС ЛПНЩ на 20,37 % (p = 0,002) та зниженням ХС ЛПВЩ на 28,8 % (p = 0,0009). Наявність ЦД2 у пацієнтів з КРМС, незалежно від ступеня його компенсації, супроводжується вірогідним підвищенням ТГ, ЗХС, ХС ЛПДНЩ і коефіцієнта атерогенності. Для пацієнтів з КРМС характерна залежність ступеня атерогенних змін ліпопротеїнів від наявності та тяжкості ІХС, а також від стану компенсації ЦД2.
Background. Cardiovascular-kidney-metabolic syndrome (CKMS) is a multifactorial pathological condition, the pathogenesis of which combines mutually reinforcing mechanisms of cardiovascular, renal and metabolic disorders that significantly increases the risk of progression of coronary heart disease (CHD), type 2 diabetes mellitus (T2DM) and chronic kidney disease (CKD). The aim of the study was to compare blood lipids in patients with cardiovascular-kidney-metabolic syndrome depending on its stage and the presence of type 2 diabetes mellitus. Materials and methods. All patients with CKMS underwent a general clinical examination with confirmation of the diagnosis of T2DM and CHD. They were divided into six main clinical groups depending on the presence/absence of CHD and T2DM (taking into account the degree of compensation), as well as a control group. The study was conducted in four stages: analysis of lipid metabolism in patients with CKMS without CHD and T2DM, study of blood lipids in patients with CKMS in the presence of CHD, assessment of lipid profile in patients with CKMS and T2DM, analysis of changes in lipid metabolism in CKMS in the presence of CHD and T2DM. Results. In patients with CKMS without CHD and T2DM, there was a significant increase in triglycerides (TG), very low-density lipoprotein (VLDL) cholesterol, indicating an early activation of atherogenesis. In the combination of CKMS with CHD, changes in lipid metabolism are more pronounced — total and low-density lipoprotein (LDL) cholesterol increases, and high-density lipoprotein (HDL) cholesterol decreases. In patients with CKMS with T2DM, regardless of the level of compensation, there was an increase in TG, total and VLDL cholesterol compared to the control group, with the highest values of these parameters noted in T2DM decompensation combined with CHD. In the presence of CKMS, nonspecific atherogenic changes in the lipid levels occur, which progress with the addition of CHD and/or T2DM that creates a high proatherosclerotic threat. Conclusions. In patients with CKMS without CHD and T2DM, lipid disorders are detected in the form of a significant increase in TG, VLDL cholesterol and atherogenic index, which indicates the activation of atherogenesis. In patients with CKMS and CHD, the progression of insulin resistance is accompanied by more pronounced disorders of lipid metabolism — a significant increase in TG and VLDL cholesterol, as well as an increase in total cholesterol by 12.7 % (p = 0.001), LDL cholesterol by 20.37 % (p = 0.002) and a decrease in HDL cholesterol by 28.8 % (p = 0.0009). The presence of T2DM in patients with CRMS, regardless of the degree of its compensation, is associated with a probable increase in TG, total and VLDL cholesterol, and atherogenic index. Patients with CKMS are characterized by the dependence of the degree of atherogenic changes in lipoproteins on the presence and severity of CHD, as well as on the state of T2DM compensation.
кардіоренометаболічний синдром; цукровий діабет 2-го типу; ліпідний обмін
cardiovascular-kidney-metabolic syndrome; type 2 diabetes mellitus; lipid metabolism
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Mutruc V, Bologa C, Șorodoc V, Ceasovschih A, Morărașu BC, Șorodoc L, et al. Cardiovascular-Kidney-Metabolic Syndrome: A New Paradigm in Clinical Medicine or Going Back to Basics? J Clin Med. 2025 Apr 19;14(8):2833. doi: 10.3390/jcm14082833. PMID: 40283662; PMCID: PMC12028252.
- Sebastian SA, Padda I, Johal G. Cardiovascular-Kidney-Meta–bolic (CKM) syndrome: A state-of-the-art review. Curr Probl Cardiol. 2024 Feb;49(2):102344. doi: 10.1016/j.cpcardiol.2023.102344. Epub 2023 Dec 14. PMID: 38103820.
- Kadowaki T, Maegawa H, Watada H, Yabe D, Node K, Muro–hara T, Wada J. Interconnection between cardiovascular, renal and metabolic disorders: A narrative review with a focus on Japan. Diabetes Obes Metab. 2022 Dec;24(12):2283-2296. doi: 10.1111/dom.14829. Epub 2022 Aug 25. PMID: 35929483; PMCID: PMC9804928.
- Marassi M, Fadini GP. The cardio-renal-metabolic connection: a review of the evidence. Cardiovasc Diabetol. 2023 Jul 31;22(1):195. doi: 10.1186/s12933-023-01937-x. PMID: 37525273; PMCID: PMC10391899.
- Young JB, Eknoyan G. Cardiorenal Syndrome: An Evolutionary Appraisal. Circ Heart Fail. 2024 Jun;17(6):e011510. doi: 10.1161/CIRCHEARTFAILURE.123.011510. Epub 2024 May 17. PMID: 38757274.
- Bungau SG. Cardio-Renal Metabolic Syndrome: Interdiscipli–nary Diagnostic Methods. Diagnostics (Basel). 2023 Jan 11;13(2):265. doi: 10.3390/diagnostics13020265. PMID: 36673075; PMCID: PMC9858236.
- Toth PP, Granowitz C, Hull M, Liassou D, Anderson A, Phi–lip S. High Triglycerides Are Associated with Increased Cardiovascular Events, Medical Costs, and Resource Use: A Real-World Administrative Claims Analysis of Statin-Treated Patients With High Residual Cardiovascular Risk. J Am Heart Assoc. 2018 Aug 7;7(15):e008740. doi: 10.1161/JAHA.118.008740. PMID: 30371242; PMCID: PMC6201477.
- Serhiyenko A, Baitsar M, Sehin V, Serhiyenko L, Kuznets V, Serhiyenko V. Post-traumatic stress disorder, insomnia, heart rate varia–bility and metabolic syndrome (narrative review). Proc Shevchenko Sci Soc Med Sci. 2024;73(1):1-10. doi: 10.25040/ntsh2024.01.07.
- Ndumele CE, Rangaswami J, Chow SL, Neeland IJ, Tuttle KR, Khan SS, Coresh J, et al.; American Heart Association. Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory from the American Heart Association. Circulation. 2023 Nov 14;148(20):1606-1635. doi: 10.1161/CIR.0000000000001184. Epub 2023 Oct 9. Erratum in: Circulation. 2024 Mar 26;149(13):e1023. doi: 10.1161/CIR.0000000000001241. PMID: 37807924.
- Serhiyenkо V, Chemerys O, Pankiv V, Serhiyenko A. Type 2 Diabetes Mellitus, Cerebral Small Vessel Disease and Depressive Disorders. International Neurological Journal. 2025;21(3):226-37, doi: 10.22141/2224-0713.21.3.2025.1178.
- Liu QK. Mechanisms of action and therapeutic applications of GLP-1 and dual GIP/GLP-1 receptor agonists. Front Endocrinol (Lausanne). 2024 Jul 24;15:1431292. doi: 10.3389/fendo.2024.1431292. PMID: 39114288; PMCID: PMC11304055.
- American Diabetes Association Professional Practice Committee. 2. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes-2025. Diabetes Care. 2025 Jan 1;48(1 Suppl 1):S27-S49. doi: 10.2337/dc25-S002. PMID: 39651986; PMCID: PMC11635041.
- Cosentino F, Grant PJ, Aboyans V, Bailey CJ, Ceriello A, Delgado V, et al.; ESC Scientific Document Group. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020 Jan 7;41(2):255-323. doi: 10.1093/eurheartj/ehz486.
- Banks WA, Farr SA, Salameh TS, Niehoff ML, Rhea EM, Morley JE, et al. Triglycerides cross the blood-brain barrier and induce central leptin and insulin receptor resistance. Int J Obes (Lond). 2018 Mar;42(3):391-397. doi: 10.1038/ijo.2017.231. Epub 2017 Oct 9. PMID: 28990588; PMCID: PMC5880581.
- Didushko OM, Herych PR, Cherniavska IV, Yatsyshyn RI, Pankiv VI. Influence of the complex treatment of hypothyroidism on the leptin level in patients with primary hypothyroidism. World of Medicine and Biology. 2018;3(65):59-63. DOI: 10.26724/2079-8334-2018-3-65-59-63.
- Lui DTW, Tan KCB. High-density lipoprotein in diabetes: Structural and functional relevance. J Diabetes Investig. 2024 Jul;15(7):805-816. doi: 10.1111/jdi.14172. Epub 2024 Feb 28. PMID: 38416054; PMCID: PMC11215696.
- Roever L, Resende ES, Diniz ALD, Penha-Silva N, O’Connell JL, Gomes PFS, et al.; Brazilian Network of Research in Meta-analysis (BRAMETIS). High-density lipoprotein-cholesterol functionality and metabolic syndrome: Protocol for review and meta-analysis. Medicine (Baltimore). 2018 Jun;97(24):e11094. doi: 10.1097/MD.0000000000011094. PMID: 29901625; PMCID: PMC6023647.
- Rohatgi A, Westerterp M, Eckardstein A von, Remaley A, Rye KA. HDL in the 21st Century. Circulation. 2021;143(23):2293-309. doi.org/10.1161/CIRCULATIONAHA.120.044221.
- Yalcinkaya M, Kerksiek A, Gebert K, Annema W, Sibler R, Radosavljevic S, et al. HDL inhibits endoplasmic reticulum stress-induced apoptosis of pancreatic β-cells in vitro by activation of Smoothened. J Lipid Res. 2020 Apr;61(4):492-504. doi: 10.1194/jlr.RA119000509. Epub 2020 Jan 6. PMID: 31907205; PMCID: PMC7112150.
- Ben-Aicha S, Badimon L, Vilahur G. Advances in HDL: Much More than Lipid Transporters. Int J Mol Sci. 2020 Jan 22;21(3):732. doi: 10.3390/ijms21030732. PMID: 31979129; PMCID: PMC7037660.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al.; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 Jan 1;41(1):111-188. doi: 10.1093/eurheartj/ehz455. Erratum in: Eur Heart J. 2020 Nov 21;41(44):4255. doi: 10.1093/eurheartj/ehz826. PMID: 31504418.
- Borén J, Chapman MJ, Krauss RM, Packard CJ, Bentzon JF, Binder CJ, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2020 Jun 21;41(24):2313-2330. doi: 10.1093/eurheartj/ehz962. PMID: 32052833; PMCID: PMC7308544.
- Fotakis P, Kothari V, Thomas DG, Westerterp M, Molusky MM, Altin E, et al. Anti-Inflammatory Effects of HDL (High-Density Lipoprotein) in Macrophages Predominate Over Proinflammatory Effects in Atherosclerotic Plaques. Arterioscler Thromb Vasc Biol. 2019 Dec;39(12):e253-e272. doi: 10.1161/ATVBAHA.119.313253. Epub 2019 Oct 3. PMID: 31578081; PMCID: PMC6879856.
- Heydarzadeh F, Mohammadi F, Yadegar A, Mohammadi Naeini A, Nabipoorashrafi SA, Rabizadeh S, et al. Increased high-density lipoprotein cholesterol in patients with type 2 diabetes and its correlates: a cross-sectional, matched case-control survey. Eur J Med Res. 2024 Jul 2;29(1):355. doi: 10.1186/s40001-024-01950-0. PMID: 38956709; PMCID: PMC11218062.
- Siam NH, Snigdha NN, Tabasumma N, Parvin I. Diabetes Mellitus and Cardiovascular Disease: Exploring Epidemiology, Pathophysiology, and Treatment Strategies. Rev Cardiovasc Med. 2024 Dec 11;25(12):436. doi: 10.31083/j.rcm2512436. PMID: 39742220; PMCID: PMC11683709.
- Costantino S, Mohammed SA, Paneni F. Endothelial dysfunction in patients with type 2 diabetes: the truth is in the blood. J Clin Invest. 2025 May 15;135(10):e193128. doi: 10.1172/JCI193128. PMID: 40371651; PMCID: PMC12077886.
- Karakasis P, Theofilis P, Patoulias D, Vlachakis PK, Antoniadis AP, Fragakis N. Diabetes-Driven Atherosclerosis: Upda–ted Mechanistic Insights and Novel Therapeutic Strategies. Int J Mol Sci. 2025 Feb 28;26(5):2196. doi: 10.3390/ijms26052196. PMID: 40076813; PMCID: PMC11900163.
- Jonas RA, Crabtree TR, Jennings RS, Marques H, Katz RJ, Chang HJ, et al. Diabetes, Atherosclerosis, and Stenosis by AI. Diabetes Care. 2023 Feb 1;46(2):416-424. doi: 10.2337/dc21-1663. PMID: 36577120; PMCID: PMC9887618.