Международный эндокринологический журнал Том 21, №7, 2025
Вернуться к номеру
Порівняльний аналіз PSMA, PCA3 та TMPRSS2-ERG як діагностичних і прогностичних біомаркерів у хворих на рак передміхурової залози
Авторы: Thikra Majid Muhammed (1), Aliaa Hashim Farag (2), Zina Lafta Hassan (3), Osama A. Mohsein (4)
(1) - College of Education for Pure Sciences, University of Anbar, Iraq
(2) - Uruk Private University, Dentistry College, Iraq
(3) - College of Applied Sciences, University of Samarra, Iraq
(4) - Thi-Qar Health Directorate, Al Habbobi Teaching Hospital, Thi-Qar, Iraq
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
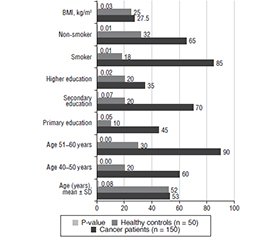
Актуальність. Рак передміхурової залози є одним із найпоширеніших злоякісних новоутворень у чоловіків та значною глобальною проблемою охорони здоров’я. Існуючі методи діагностики цієї хвороби, як-от ректальне дослідження, біопсія та візуалізація, часто обмежені з точки зору інвазивності, вартості і мінливості результатів. Таким чином, ідентифікація мінімально інвазивних, чутливих біомаркерів може поліпшити ранню діагностику, оцінку прогнозу й моніторинг ефектів лікування. Мета: порівняти діагностичну точність рівнів PSMA та PSA щодо поліпшення раннього виявлення та прийняття клінічних рішень. Матеріали та методи. Перехресне дослідження було проведено в лікарні Al Habbobi з травня 2024 року до березня 2025 року за участю 150 пацієнтів із раком передміхурової залози та 50 здорових чоловіків контрольної групи (вік 40–60 років, індекс маси тіла (ІМТ) 22–30 кг/м2). Експресію PSMA оцінювали за допомогою імуногістохімічного методу, рівні PSA — з використанням імуноферментного аналізу, PCA3 та TMPRSS2-ERG у сечі — транскрипційно-опосередкованої ампліфікації. Результати. Середній вік суттєво не відрізнявся між пацієнтами (53,0 ± 5,2 року) та контрольною групою (52,0 ± 4,8 року), P = 0,08. Хворі мали вищий ІМТ (P = 0,03), нижчий рівень освіти (P = 0,02) та вищі показники куріння (P = 0,01). Уміст біомаркерів (PSA, PSMA, PCA3, TMPRSS2-ERG) був значно підвищений в онкологічних пацієнтів (P < 0,001). До поширених симптомів належали часте сечовипускання (80 %), біль у ділянці таза (67 %) та утруднене сечовипускання (60 %), P < 0,01. Гормональна терапія тривала довше (14,0 ± 3,5 місяця), ніж променева (8,5 ± 2,2 місяця), P < 0,01. Висновки. PSMA, PSA, PCA3 та TMPRSS2-ERG демонструють значний діагностичний потенціал при раку передміхурової залози. Підвищений ІМТ та куріння можуть збільшити ризик раку через запальні й гормональні механізми. Гормональна терапія продемонструвала більш тривалу дію, що свідчить про вищу терапевтичну ефективність. Довша гормональна терапія вказує на її роль у стійкому контролі захворювання. Ці результати підкреслюють важливість раннього скринінгу на основі біомаркерів та зміни способу життя при лікуванні раку передміхурової залози.
Background. Prostate cancer is one of the most common male malignancies and a significant global health concern. Existing prostate cancer diagnosis methods, like digital rectal exams, biopsy, and imaging, are often limited in term-s of invasiveness, cost, and variability of results. Thus, identifying minimally invasive, sensitive biomarkers may aid in improving early diagnosis, prognosis evaluation, and treatment effects monitoring. This study purposed to compare the diagnostic accuracy of PSMA and PSA levels to improve early detection and clinical decision-making. Materials and methods. A cross-sectional study was conducted at Al Habbobi Teaching Hospital from May 2024 to March 2025, including 150 prostate cancer patients and 50 healthy male controls (aged 40–60 years, body mass index (BMI) 22–30 kg/m2). PSMA expression was assessed using immunohistochemistry, PSA levels via enzyme-linked immunosorbent assay, urinary PCA3 and TMPRSS2-ERG using transcription-mediated amplification. Results. Mean age did not differ significantly between patients (53.0 ± 5.2 years) and controls (52.0 ± 4.8 years), P = 0.08. Patients had higher BMI (P = 0.03), lower education levels (P = 0.02), and higher smoking rates (P = 0.01). Biomarkers (PSA, PSMA, PCA3, TMPRSS2-ERG) were significantly elevated in cancer patients (P < 0.001). Common symptoms included frequent urination (80 %), pelvic pain (67 %), and difficulty urinating (60 %), P < 0.01. Hormone therapy lasted longer (14.0 ± 3.5 months) than radiation therapy (8.5 ± 2.2 months), P < 0.01. Conclusions. PSMA, PSA, PCA3, and TMPRSS2-ERG show strong diagnostic potential for prostate cancer. Elevated BMI and smoking may increase cancer risk via inflammatory and hormonal mechanisms. Hormone therapy demonstrated longer duration, suggesting superior therapeutic efficacy. Longer hormone therapy duration indicates its role in sustained disease control. These findings highlight the importance of early biomarker-based screening and lifestyle modifications in prostate cancer management.
рак передміхурової залози; біомаркери; PSMA; PSA; PCA3; TMPRSS2-ERG
prostate cancer; biomarkers; PSMA; PSA; PCA3; TMPRSS2-ERG
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Gandaglia G, Leni R, Bray F, Fleshner N, Freedland SJ, et al. Epidemiology and Prevention of Prostate Cancer. Eur Urol Oncol. 2021 Dec;4(6):877-892. doi: 10.1016/j.euo.2021.09.006.
- Bilal M, Javaid A, Amjad F, Youssif TA, Afzal S. An overview of prostate cancer (PCa) diagnosis: Potential role of miRNAs. Transl Oncol. 2022 Dec;26:101542. doi: 10.1016/j.tranon.2022.101542.
- Merriel SWD, Pocock L, Gilbert E, Creavin S, Walter FM, et al. Systematic review and meta-analysis of the diagnostic accuracy of prostate-specific antigen (PSA) for the detection of prostate cancer in symptomatic patients. BMC Med. 2022 Feb 7;20(1):54. doi: 10.1186/s12916-021-02230-y.
- Ferraro S, Bussetti M, Bassani N, Rossi RS, Incarbone GP, et al. Definition of Outcome-Based Prostate-Specific Antigen (PSA) Thresholds for Advanced Prostate Cancer Risk Prediction. Cancers (Basel). 2021 Jul 6;13(14):3381. doi: 10.3390/cancers13143381.
- Jiang Z, Kadeerhan G, Zhang J, Guo W, Guo H, Wang D. Advances in prostate-specific membrane antigen-targeted theranostics: from radionuclides to near-infrared fluorescence techno–logy. Front Immunol. 2025 Jan 10;15:1533532. doi: 10.3389/fimmu.2024.1533532.
- Corpetti M, Müller C, Beltran H, de Bono J, Theurillat JP. Prostate-Specific Membrane Antigen-Targeted Therapies for Prostate Cancer: Towards Improving Therapeutic Outcomes. Eur Urol. 2024 Mar;85(3):193-204. doi: 10.1016/j.eururo.2023.11.018.
- McGrath CB, Shreves AH, Shanahan MR, Guard HE, Nhliziyo MV, et al. Etiology of prostate cancer with the TMPRSS2:ERG fusion: A systematic review of risk factors. Int J Cancer. 2025 May 15;156(10):1898-1908. doi: 10.1002/ijc.35279.
- Kobelyatskaya AA, Pudova EA, Snezhkina AV, Fedorova MS, Pavlov VS, et al. Impact TMPRSS2-ERG Molecular Subtype on Prostate Cancer Recurrence. Life (Basel). 2021 Jun 21;11(6):588. doi: 10.3390/life11060588.
- Fang L, Li D, Yin J, et al. TMPRSS2-ERG promotes the initiation of prostate cancer by suppressing oncogene-induced senescence. Cancer Gene Ther. 2022;29:1463-1476. doi: 10.1038/s41417-022-00454-5.
- Dejous C, Krishnan UM. Sensors for diagnosis of prostate cancer: Looking beyond the prostate specific antigen. Biosens Bioelectron. 2021;173:112790. doi: 10.1016/j.bios.2020.112790.
- Sánchez-Salcedo R, et al. Electrochemical sensors using oligonucleotides as recognition ligands for liquid biopsy in prostate cancer. Biosens Bioelectron X. 2022;12:100227. doi: 10.1016/j.biosx.2022.100227.
- Teoh JYC, Hirai HW, Ho JMW, Chan FCH, Tsoi KKF, Ng CF. Global incidence of prostate cancer in developing and deve–loped countries with changing age structures. PLoS One. 2019 Oct 24;14(10):e0221775. doi: 10.1371/journal.pone.0221775.
- Bleyer A, Spreafico F, Barr R. Prostate cancer in young men: An emerging young adult and older adolescent challenge. Cancer. 2020;126(1):46-57. doi: 10.1002/cncr.32498.
- Van Poppel H, Roobol MJ, Chapple CR, Catto JWF, N’Dow J, et al. Prostate-specific Antigen Testing as Part of a Risk-Adapted Early Detection Strategy for Prostate Cancer: Euro–pean Association of Urology Position and Recommendations for 2021. Eur Urol. 2021 Dec;80(6):703-711. doi: 10.1016/j.eururo.2021.07.024.
- Pernar CH, Ebot EM, Wilson KM, Mucci LA. The Epidemio–logy of Prostate Cancer. Cold Spring Harb Perspect Med. 2018 Dec 3;8(12):a030361. doi: 10.1101/cshperspect.a030361.
- Foerster B, Pozo C, Abufaraj M, Mari A, Kimura S, et al. Association of Smoking Status with Recurrence, Metastasis, and Mortality Among Patients With Localized Prostate Cancer Undergoing Prostatectomy or Radiotherapy: A Systematic Review and Meta-analysis. JAMA Oncol. 2018 Jul 1;4(7):953-961. doi: 10.1001/jamaoncol.2018.1071.
- Jochems SHJ, Fritz J, Häggström C, Järvholm B, Stattin P, Stocks T. Smoking and Risk of Prostate Cancer and Prostate Cancer Death: A Pooled Study. Eur Urol. 2023 May;83(5):422-431. doi: 10.1016/j.eururo.2022.03.033.
- Adesunloye BA. Mechanistic insights into the link between obesity and prostate cancer. Int J Mol Sci. 2021;22(8):3935. doi: 10.3390/ijms22083935.
- Schiffmann J, Karakiewicz PI, Rink M, Manka L, Salomon G, et al. Obesity paradox in prostate cancer: increased body mass index was associated with decreased risk of metastases after surgery in 13,667 patients. World J Urol. 2018 Jul;36(7):1067-1072. doi: 10.1007/s00345-018-2240-8.
- Ilic D, Djulbegovic M, Jung JH, Hwang EC, Zhou Q, et al. Prostate cancer screening with prostate-specific antigen (PSA) test: a systematic review and meta-analysis. BMJ. 2018 Sep 5;362:k3519. doi: 10.1136/bmj.k3519.
- Nativ O, Malshy K, Kastin A, Kravtzov A, Sabo E, et al. Association between PSA density and pathologically significant prostate cancer: The impact of prostate volume. Prostate. 2020 Dec;80(16):1444-1449. doi: 10.1002/pros.24078.
- Tikkinen KAO, Dahm P, Lytvyn L, Heen AF, Vernooij RWM, et al. Prostate cancer screening with prostate-specific antigen (PSA) test: a clinical practice guideline. BMJ. 2018 Sep 5;362:k3581. doi: 10.1136/bmj.k3581.
- Wang F, Li Z, Feng X, Yang D, Lin M. Advances in PSMA-targeted therapy for prostate cancer. Prostate Cancer Prostatic Dis. 2022 Mar;25(1):11-26. doi: 10.1038/s41391-021-00394-5.
- Hupe MC, Philippi C, Roth D, Kümpers C, Ribbat-Idel J, et al. Expression of Prostate-Specific Membrane Antigen (PSMA) on Biopsies Is an Independent Risk Stratifier of Prostate Cancer Patients at Time of Initial Diagnosis. Front Oncol. 2018 Dec 20;8:623. doi: 10.3389/fonc.2018.00623.
- Chen F, Jiang J, Peng Y, Wang L, Lan J, et al. A machine learning model incorporating 18F-prostate-specific membrane antigen-1007 positron emission tomography/computed tomography and multiparametric magnetic resonance imaging for predicting prostate-specific antigen persistence in patients with prostate cancer after radical prostatectomy. Quant Imaging Med Surg. 2025 Jan 2;15(1):30-41. doi: 10.21037/qims-24-1149.
- Kim SJ, Lee SW, Ha HK. Diagnostic performance of radiolabeled PSMA PET/CT for primary lymph node staging in newly diagnosed intermediate to high-risk prostate cancer patients: a systematic review and meta-analysis. Urol Int. 2019;102(1):27-36. doi: 10.21037/qims-24-1149.
- Zhou E, Zhang B, Zhu K, Schaafsma E, Kumar RD, Cheng C. A TMPRSS2-ERG gene signature predicts prognosis of patients with prostate adenocarcinoma. Clin Transl Med. 2020 Dec;10(8):e216. doi: 10.1002/ctm2.216.
- Song C, Chen H. Predictive significance of TMPRSS2-ERG fusion in prostate cancer: a meta-analysis. Cancer Cell Int. 2018;18:12. doi: 10.1186/s12935-018-0672-2.
- Xu Z, Wang Y, Xiao ZG, Zou C, Zhang X, et al. Nuclear receptor ERRα and transcription factor ERG form a reciprocal loop in the regulation of TMPRSS2:ERG fusion gene in prostate cancer. Oncogene. 2018 Nov;37(48):6259-6274. doi: 10.1038/s41388-018-0409-7.
- Matuszczak M, Schalken JA, Salagierski M. Prostate cancer liquid biopsy biomarkers’ clinical utility in diagnosis and prognosis. Cancers. 2021;13(13):3373. doi: 10.3390/cancers13133373.
- Lorenzin F, Demichelis F. Past, current, and future stra–tegies to target ERG fusion-positive prostate cancer. Cancers. 2022;14(5):1118. doi: 10.3390/cancers14051118.
- Hong SS, Bae SH, Hwang J, Lee EJ. Transperineal versus transrectal prostate fiducial insertion in radiation treatment of prostate cancer: a systematic review and meta-analysis. Ultrasonography. 2024 Jul;43(4):229-237. doi: 10.14366/usg.23229.
- Liu Y, Mikrani R, Xie D, Wazir J, Shrestha S, et al. Chro–nic prostatitis/chronic pelvic pain syndrome and prostate cancer: study of immune cells and cytokines. Fundam Clin Pharmacol. 2020 Apr;34(2):160-172. doi: 10.1111/fcp.12517.
- Cicero AFG, Allkanjari O, Busetto GM, Cai T, Larganà G, et al. Nutraceutical treatment and prevention of benign prostatic hyperplasia and prostate cancer. Arch Ital Urol Androl. 2019 Oct 2;91(3). doi: 10.4081/aiua.2019.3.139.
- Malling B, Røder MA, Lindh M, Frevert S, Brasso K, Lönn L. Palliative Prostate Artery Embolization for Prostate Cancer: A Case Series. Cardiovasc Intervent Radiol. 2019 Oct;42(10):1405-1412. doi: 10.1007/s00270-019-02227-4.
- Desai K, McManus JM, Sharifi N. Hormonal therapy for prostate cancer. Endocr Rev. 2021;42(3):354-373. doi: 10.1210/endrev/bnab002.
- Tucci M, Leone G, Buttigliero C, Zichi C, Di Stefano RF, et al. Hormonal treatment and quality of life of prostate cancer patients: new evidence. Minerva Urol Nefrol. 2018 Apr;70(2):144-151. doi: 10.23736/S0393-2249.17.03066-1.
- De Crevoisier R, Bayar MA, Pommier P, Muracciole X, Pêne F, et al. Daily Versus Weekly Prostate Cancer Image Guided Radiation Therapy: Phase 3 Multicenter Randomized Trial. Int J Radiat Oncol Biol Phys. 2018 Dec 1;102(5):1420-1429. doi: 10.1016/j.ijrobp.2018.07.2006.
- Michalski JM, Moughan J, Purdy J, Bosch W, Bruner DW, et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-risk Prostat Cancer: The NRG Onco–logy RTOG 0126 Randomized Clinical Trial. JAMA Oncol. 2018 Jun 14;4(6):e180039. doi: 10.1001/jamaoncol.2018.0039.
- Guldvik IJ. LRG1 as a non-invasive biomarker for improved precision in prostate cancer assessment. 2022. doi: 10.1016/j.euros.2022.09.002.