Международный эндокринологический журнал Том 21, №7, 2025
Вернуться к номеру
Оцінка гістопатологічної відповіді на неоад’ювантне лікування аденокарциноми прямої кишки
Авторы: Zainab Khalid Shehab Almukhtar
College of Medicine, University of Baghdad, Iraq
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
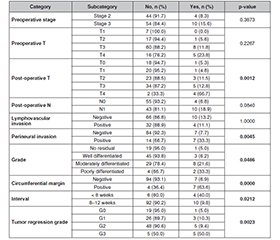
Актуальність. Існує велика варіабельність гістопатологічної відповіді в осіб із раком прямої кишки, яким проведено неоад’ювантну терапію і тотальну мезоректальну резекцію. Пацієнти, які досягли повної гістопатологічної відповіді, зазвичай мають кращі показники виживання й меншу частоту рецидивів. Тому точна оцінка відповіді на лікування є важливою для прийняття подальших терапевтичних рішень, включно зі стратегією збереження органа або локальною резекцією. Мета: оцінити гістопатологічну відповідь у кореляції з декількома клініко-патологічними прогностичними факторами в осіб із раком прямої кишки, які отримували неоад’ювантну терапію з подальшою тотальною мезоректальною резекцією. Матеріали та методи. Ретроспективне дослідження включало пацієнтів із локалізованим раком прямої кишки, які отримували неоад’ювантну терапію з подальшою тотальною мезоректальною резекцією. Застосовано логістичну регресію між пухлиною як залежною змінною величиною та клініко-патологічними ознаками як предикторами. Значення p < 0,05 вважалося статистично значущим. Результати. Під спостереженням перебувало 112 пацієнтів, 64 % з них — чоловіки. Середній вік становив 61,1 року (стандартне відхилення 12,0). Повна гістопатологічна відповідь спостерігалася в 17,86 % випадків. Установлено вірогідний зв’язок між ступенем регресування пухлини й станом циркулярного краю резекції (p = 0,009), патогістологічним ступенем (p = 0,001), післяопераційною Т-стадією (p = 0,001), периневральною інвазією (p = 0,001) та доопераційною Т-стадією (p = 0,008). Рецидив спостерігався у 12,5 % пацієнтів із вірогідним зв’язком для постнеоад’ювантної Т-стадії (p = 0,001), стану циркулярного краю резекції (p < 0,0001), патогістологічного ступеня (p = 0,04), периневральної інвазії (p = 0,004), інтервалу лікування (p = 0,02) та ступеня регресування пухлини (p = 0,002). Висновки. Стан циркулярного краю резекції, патогістологічний ступінь, периневральна інвазія, доопераційна Т-стадія та постнеоад’ювантна Т-стадія є значущими незалежними предикторами різних патологічних відповідей.
Background. There is a significant variability in histopathologic response in patients with rectal carcinoma treated by neoadjuvant therapy and total mesorectal excision. Patients achieving pathologic complete response generally have improved survival outcomes and reduced recurrence rates. Accurate assessment of treatment response is therefore essential to guide subsequent therapeutic decisions, including organ-preserving strategies or local excision. The purpose of this retrospective study is to assess histopathologic response in correlation with several clinicopathologic prognostic factors in patients with rectal carcinoma who received neoadjuvant therapy followed by total mesorectal resection. Materials and methods. A retrospective study included patients with localized rectal carcinoma treated by neoadjuvant therapy followed by total mesorectal excision. Multinomial logistic regression was performed with tumor regression grade as the dependent variable and clinicopathologic features as predictors. A p-value < 0.05 was considered statistically significant. Results. A total of 112 patients were encompassed, 64 % were men. The mean age was 61.1 years (SD 12.0). Pathologic complete response was observed in 17.86 % of patients. Significant associations were found between tumor regression grade and circumferential margin status (p = 0.009), histologic grade (p = 0.001), post-operative T stage (p = 0.001), perineural invasion (p = 0.001), and preoperative T stage (p = 0.008). Recurrence was seen in 12.5 % of patients, with significant associations for post-neoadjuvant T stage (p = 0.001), circumferential margin status (p < 0.0001), histological grade (p = 0.04), perineural invasion (p = 0.004), treatment interval (p = 0.02), and tumor regression grade (p = 0.002). Conclusions. Circumferential margin status, histologic grade, perineural invasion, preoperative T stage, and post-neoadjuvant T stage are significant independent predictors of different pathologic responses.
рак прямої кишки; повна гістопатологічна відповідь; неоад’ювантна терапія; патологічні прогностичні фактори
rectal cancer; pathologic complete response; neoadjuvant therapy; pathologic prognostic factors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Fazeli MS, Keramati MR. Rectal cancer: a review. Med J Islam Repub Iran. 2015 Jan 31;29:171.
- Ferlay J, Colombet M, Soerjomataram I, Parkin DM, Piñeros M, et al. Cancer statistics for the year 2020: An overview. Int J Cancer. 2021 Apr 5. doi: 10.1002/ijc.33588.
- Alhamadani SRS, Almukhtar ZKS. Immunohistochemical Expression of MLH1, PMS2 and P53 in Colorectal Carcinoma with Clini–copathologic Correlation. Al-Rafidain Journal of Medical Sciences. 2025;9(1):222-229. doi: 10.54133/ajms.v9i1.2181.
- Benson AB, Venook AP, Al-Hawary MM, Azad N, Chen YJ, et al. Rectal Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Oct;20(10):1139-1167. doi: 10.6004/jnccn.2022.0051.
- Xynos E, Tekkis P, Gouvas N, et al. Clinical practice guidelines for the surgical treatment of rectal cancer: a consensus statement of the Hellenic Society of Medical Oncologists (HeSMO). Ann Gastroenterol. 2016;29(2):103-126. doi: 10.20524/aog.2016.0003.
- Li Y, Wang J, Ma X, Tan L, Yan Y, Xue C, Hui B, et al. A Review of Neoadjuvant Chemoradiotherapy for Locally Advanced Rectal Cancer. International Journal of Biological Sciences. 2016;12(8):1022-1031. doi: 10.7150/ijbs.15438.
- Shahabi F, Ansari M, Najafi Ghobadi K, et al. Significant Pathologic Response Following Neoadjuvant Therapy and Curative Resection in Patients with Rectal Cancer: Surgical and Oncological Outcomes From a Retrospective Cohort Study. Cancer Rep (Hoboken). 2024;7(11):e70041. doi: 10.1002/cnr2.70041.
- Stefanou AJ, Dessureault S, Sanchez J, Felder S. Clinical Tools for Rectal Cancer Response Assessment following Neoadjuvant Treatment in the Era of Organ Preservation. Cancers. 2023;15:5535. doi: 10.3390/cancers15235535.
- Amin MB, Greene FL, Edge SB, Compton CC, Gershenwald JE, et al. The Eighth Edition AJCC Cancer Staging Ma–nual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA Cancer J Clin. 2017 Mar;67(2):93-99. doi: 10.3322/caac.21388.
- Hav M, Libbrecht L, Ferdinande L, Geboes K, Pattyn P, Cuvelier CA. Pathologic Assessment of Rectal Carcinoma after Neoadjuvant Radio(chemo)therapy: Prognostic Implications. Biomed Res Int. 2015;2015:574540. doi: 10.1155/2015/574540.
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010 Jun;17(6):1471-4. doi: 10.1245/s10434-010-0985-4.
- Al-Kubati W. Vascular Invasion without Lymphatic Dissemination is an Independent Predictive Indicator of Relapse and Remote Metastasis in Colorectal Malignancy. World Journal of Colorectal Surgery. 2025;14(2):40-47. doi: 10.4103/wjcs.wjcs_3_25.
- Dilek ON, Arslan Kahraman Dİ, Kahraman G. Carcinoembryonic antigen in the diagnosis, treatment, and follow-up of focal liver lesions. World J Gastrointest Surg. 2024;16(4):999-1007. doi: 10.4240/wjgs.v16.i4.999.
- James J, Teo M, Ramachandran V, Law M, Stoney D, Cheng M. A critical review of the chest CT scans performed to detect asym–ptomatic synchronous metastasis in new and recurrent breast cancers. World J Surg Oncol. 2019;17(1):40. doi: 10.1186/s12957-019-1584-x.
- White A, Ironmonger L, Steele RJC, Ormiston-Smith N, Crawford C, Seims A. A review of sex-related differences in colorectal cancer incidence, screening uptake, routes to diagnosis, cancer stage and survival in the UK. BMC Cancer. 2018;18(1):906. doi: 10.1186/s12885-018-4786-7.
- Barna R, Dema A, Jurescu A, Văduva AO, Lăzureanu D-C, et al. The Relevance of Sex and Age as Non-Modifiable Risk Factors in Relation to Clinical-Pathological Parameters in Colorectal Cancer. Life 2025;15:156. doi: 10.3390/life15020156.
- Cadili L, Loree JM, Peacock M, et al. Pathologic complete response after neoadjuvant therapy for locally advanced rectal cancer in a real-world setting: a population-based study. Front Oncol. 2025;15:1573819. doi: 10.3389/fonc.2025.1573819.
- Tan Y, Fu D, Li D, Kong X, Jiang K, et al. Predictors and Risk Factors of Pathologic Complete Response Following Neoadjuvant Chemoradiotherapy for Rectal Cancer: A Population-Based Analysis. Front Oncol. 2019 Jun 13;9:497. doi: 10.3389/fonc.2019.00497.
- Rullier A, Gourgou-Bourgade S, Jarlier M, Bibeau F, Chassagne-Clément C, et al. Predictive factors of positive circumferential resection margin after radiochemotherapy for rectal cancer: the French randomised trial ACCORD12/0405 PRODIGE 2. Eur J Cancer. 2013 Jan;49(1):82-9. doi: 10.1016/j.ejca.2012.06.028.
- Zhou L, Cao G, Shi L, Fei C, Lao W. Risk factors of pathologic complete response for neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Front Oncol. 2025;15:1483065. doi: 10.3389/fonc.2025.1483065.
- Gauci C, Ravindran P, Pillinger S, Lynch AC. Robotic surgery for multi-visceral resection in locally advanced colorectal cancer: Techniques, benefits and future directions. Laparosc Endosc Robot Surg. 2023;6:123-6. doi: 10.1016/j.lers.2023.11.001.
- Lau SYC, Lu CT, Lam AK. Changes in surgical margins following formalin fixation and the incidence of local recurrence of colo–rectal cancer. International Surgery Journal. 2025;12(4):508-511. doi: 10.18203/2349-2902.isj20250806.
- Novin K, Saneii M, Noori R, Shahin M, Berahman M, et al. Association Between Pathological Complete Response and Tumor Location in Patients with Rectal Cancer After Neoadjuvant Chemoradiotherapy, a Prospective Cohort Study. Int J Cancer Manag.2021;14(5):e113135. doi: 10.5812/ijcm.113135.
- Delitto D, George TJ Jr, Loftus TJ, et al. Prognostic Value of Clinical vs Pathologic Stage in Rectal Cancer Patients Receiving Neoadjuvant Therapy. J Natl Cancer Inst. 2018;110(5):460-466. doi: 10.1093/jnci/djx228.
- Kasheri E, Artinyan A, Oka K, et al. Downstaging after pre–operative chemoradiation for locally advanced rectal cancer is associa–ted with better survival than pathologic stage 0–1 disease treated with upfront surgery. Int J Colorectal Dis. 2024;39(1):16. doi: 10.1007/s00384-023-04589-1.
- Duzova M, Basaran H, Inan G, Gul OV, Eren OO, Korez MK. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: Outcomes of survival, toxicity, sphincter preser–ving and prognostic factors. Transpl Immunol. 2021 Dec;69:101489. doi: 10.1016/j.trim.2021.101489.
- Steinberg GD, Bivalacqua T, Daneshmand S, Shore ND, Joshi S, Dinney CPN. Updates to CORE-008: A phase 2 multi-arm, multi-cohort study to evaluate intravesical cretostimogene grenadenorepvec in patients with high-risk non-muscle invasive bladder cancer. Journal of Clinical Oncology. 2025;43(16). doi: 10.1200/JCO.2025.43.16_suppl.TPS4625.
- Alexandrescu ST, Dumitru AV, Babiuc RD, Costea RV. Assessment of clinical and pathological complete response after neoadjuvant chemoradiotherapy in rectal adenocarcinoma and its therapeutic implications. Rom J Morphol Embryol. 2021;62(2):411-425. doi: 10.47162/RJME.62.2.07.
- Stojkovic Lalosevic M, Milovanovic T, Micev M, et al. Perineural invasion as a prognostic factor in patients with stage I–III rectal cancer — 5-year follow up. World J Gastrointest Oncol. 2020;12(5):592-600. doi: 10.4251/wjgo.v12.i5.592.
- Beaton C, Twine CP, Williams GL, Radcliffe AG. Systematic review and meta-analysis of histopathological factors influencing the risk of lymph node metastasis in early colorectal cancer. Colorectal Dis. 2013 Jul;15(7):788-97. doi: 10.1111/codi.12129.
- Hasan FF, Fadhil MH, Almukhtar ZK. Assessment of Tissue Eosinophilic Infiltration in Invasive Mammary Carcinoma. Int J Breast Cancer. 2024;2024:1514147. doi: 10.1155/2024/1514147.
- Du CZ, Xue WC, Cai Y, Li M, Gu J. Lymphovascular invasion in rectal cancer following neoadjuvant radiotherapy: A retrospective cohort study. World J Gastroenterol 2009; 15(30): 3793-3798. doi: 10.3748/wjg.15.3793.
- Tang YL, Li DD, Duan JY, Wang X. Prognostic analysis of rectal cancer patients after neoadjuvant chemoradiotherapy: different prognostic factors in patients with different TRGs. Int J Colorectal Dis. 2024 Jun 19;39(1):93. doi: 10.1007/s00384-024-04666-z.
- Sternberg A, Mizrahi A, Amar M, Groisman G. Detection of venous invasion in surgical specimens of colorectal carcinoma: the efficacy of various types of tissue blocks. Journal of Clinical Pathology. 2006;59(2):207-210. doi: 10.1136/jcp.2004.023333.
- Chen L, Huang X, Song Z. The value of lymph node ratio in the prediction of rectal cancer patient survival after preoperative chemoradiotherapy. Int J Clin Exp Pathol. 2018 Dec 1;11(12):5992-6001.
- Berho M, Oviedo M, Stone E, Chen C, Nogueras J, et al. The correlation between tumour regression grade and lymph node status after chemoradiation in rectal cancer. Colorectal Dis. 2009;11:254-258. doi: 10.1111/j.1463-1318.2008.01597.x.
- Hakenberg P, Kalev G, Seyfried S, Reißfelder C, Hardt J. Recurrence patterns and management of locally recurrent rectal cancer: a retrospective cohort study. Langenbecks Arch Surg. 2025;410(1):116. doi: 10.1007/s00423-025-03692-x.
- Cai Y, Li Z, Gu X, Fang Y, Xiang J, Chen Z. Prognostic factors associated with locally recurrent rectal cancer following primary surgery (Review). Oncol Lett. 2014;7(1):10-16. doi: 10.3892/ol.2013.1640.
- Liu Q, Luo D, Cai S, Li Q, Li X. Circumferential resection margin as a prognostic factor after rectal cancer surgery: A large population-based retrospective study. Cancer Med. 2018;7(8):3673-3681. doi: 10.1002/cam4.1662.
- Peng YF, Yu WD, Pan HD, et al. Tumor regression grades: potential outcome predictor of locally advanced rectal adenocarcinoma after preoperative radiotherapy. World J Gastroenterol. 2015;21(6):1851-1856. doi: 10.3748/wjg.v21.i6.1851.