Международный эндокринологический журнал Том 21, №7, 2025
Вернуться к номеру
Морфометрична оцінка екзокринної та ендокринної частин підшлункової залози у щурів за умов тривалого впливу триптореліну (експериментальне дослідження)
Авторы: N.V. Boruta, V.I. Shepitko, V.V. Mykhailenko, O.V. Vilkhova, M.V. Rud, O.D. Lysachenko, L.B. Pelypenko, O.V. Voloshyna, O.A. Levchenko, S.I. Serbin, Ye.V. Stetsuk
Poltava State Medical University, Poltava, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
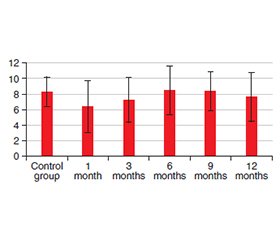
Актуальність. Корекція низки патологічних станів, що є андрогензалежними, базується на антигормональній терапії, зокрема із застосуванням триптореліну — синтетичного аналога гонадотропін-рилізинг-гормону, який центрально пригнічує синтез тестостерону та призводить до хімічної кастрації. Однак клінічний досвід показує, що пацієнти, які отримують трипторелін, часто повідомляють про побічні реакції з боку шлунково-кишкового тракту, зокрема підшлункової залози. Мета: встановити морфологічні зміни у структурних компонентах мікроциркуляторного русла, екзокринної та ендокринної частин підшлункової залози за умов експериментального моделювання хімічної кастрації з використанням триптореліну протягом 12 місяців для визначення прямого і непрямого впливу препарату на ці структури. Матеріали та методи. Для дослідження використано 35 самців білих щурів вагою 180–260 грамів, яких розділили на дві групи. Контрольну групу становили 10 тварин. Експериментальна група включала 25 щурів — по п’ять на кожен із п’яти періодів дослідження: 1-й, 3-й, 6-й, 9-й та 12-й місяці. Тваринам експериментальної групи підшкірно вводили трипторелін у дозі 0,3 мг/кг діючої речовини протягом 12 місяців. З експериментальної групи було відібрано п’ять тварин і проведено морфологічне дослідження мікроциркуляторного русла, екзокринного й ендокринного відділів підшлункової залози. Результати. Морфометричне дослідження дозволило оцінити вплив триптореліну на морфофункціональні характеристики мікроциркуляторного русла екзокринного та ендокринного апарату підшлункової залози. Зміни, що відбулися протягом першого місяця експерименту, характеризувалися помірною стабілізацією структури екзокринної частини та вазодилатацією, що свідчило про активацію компенсаторних механізмів. Починаючи з третього місяця спостерігалися деякі структурні зміни в ацинусах і кровоносних судинах, що призвело до дистрофічних змін в екзокринних та стромальних клітинах. Ці зміни сягали максимуму на дев’ятому місяці експерименту, вказуючи на пригнічення функціональної активності клітинного компонента. До 12-го місяця спостерігалося зменшення кількості дистрофічно змінених клітин, що, ймовірно, пов’язано з переходом частини клітин у стадію компенсації та демонструє певний, хоча й обмежений, механізм адаптації організму. Висновки. Трипторелін спричиняє розвиток хронічного патологічного процесу в підшлунковій залозі, який розпочинається з порушень кровообігу та призводить до вираженої функціональної та морфологічної деградації клітинних структур, незважаючи на короткочасні адаптивні механізми.
Background. Correction of a number of pathological conditions that are androgen-dependent is based on anti-hormone therapy, in particular the use of triptorelin, a synthetic analogue of gonadotropin-releasing hormone, which centrally suppresses testosterone synthesis and leads to chemical castration. Nevertheless, clinical experience indicates that patients receiving triptorelin frequently report adverse reactions affecting the gastrointestinal tract, specifically the pancreas. The purpose of the study is to establish morphological changes in the structural components of the haemomicrocirculatory bed, exocrine and endocrine parts of the pancreas. This will be conducted under conditions of experimental modelling of chemical castration using triptorelin over a 12-month period to determine the direct and indirect effects of the drug on these structures. Materials and methods. Thirty-five male white rats weighing 180–260 grams were used for the study and divided into two groups. The control group consisted of 10 animals. The experimental group included 25 rats, 5 animals for each of the five study periods: 1st, 3rd, 6th, 9th and 12th months. The animals in the experimental group were subcutaneously injected with triptorelin at a dose of 0.3 mg/kg of active substance for 12 months. Five animals were taken from the experimental group and a morphological study of the haemomicrocirculatory bed, exocrine and endocrine sections of the pancreas was conducted. Results. The morphometric investigation enabled the evaluation of the impact of triptorelin on the morphofunctional characteristics of the haemomicrocirculatory bed of the exocrine and endocrine apparatus of the pancreas. The alterations that transpired during the 1st month of the experiment were marked by moderate stabilisation in the structure of the exocrine apparatus and vasodilation, signifying the activation of compensatory mechanisms. Starting from the third month, there have been some structural changes in the acini and blood vessels, which have led to dystrophic changes in the exocrine cells and stromal cells. These alterations reached their peak in the ninth month of the experiment, which shows that the functionality of the cellular component has been suppressed. By the 12th month, there is a decrease in the number of dystrophically altered cells, which is probably due to those that were previously in the compensation stage, demonstrating a certain, although limited, mechanism of adaptation of the body. Conclusions. Triptorelin causes a chronic pathological process in the pancreas, which begins with circulatory disorders and leads to pronounced functional and morphological degradation of cellular structures, despite short-term adaptive mechanisms.
підшлункова залоза; тестостерон; рилізинг-фактор; трипторелін; мікроциркуляторне русло; ендокринні клітини; екзокринні клітини; морфометрія
pancreas; testosterone; releasing factor; triptorelin; haemomicrocirculatory bed; endocrine cells; exocrine cells; morphometry
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Aghazadeh Y, Poon F, Sarangi F, Wong FTM, Khan ST, et al. Microvessels support engraftment and functionality of human islets and hESC-derived pancreatic progenitors in diabetes models. Cell Stem Cell. 2021;28(11):1936-1949.e8. doi: 10.1016/j.stem.2021.08.001.
- Alexandre-Heymann L, Larger É. The pericyte of the pancreatic islet regulates capillary diameter and local blood flow. Med Sci (Paris). 2018;34(8–9):649-651. doi: 10.1051/medsci/20183408006 (in French).
- Aplin AC, Aghazadeh Y, Mohn OG, Hull-Meichle RL. Role of the pancreatic islet microvasculature in health and disease. J Histochem Cytochem. 2024;72(11–12):711-728. doi: 10.1369/00221554241299862.
- Slomianka L. Basic quantitative morphological methods applied to the central nervous system. J Comp Neurol. 2021;529(4):694-756. doi: 10.1002/cne.24976.
- Bender RHF, O’Donnell BT, Shergill B, Pham BQ, Tahmouresie S, et al. A vascularized 3D model of the human pancreatic islet for ex vivo study of immune cell-islet interaction. Biofabrication. 2024;16(2):025001. doi: 10.1088/1758-5090/ad17d0.
- Ciaramella V, Chianese R, Pariante P, Fasano S, Pierantoni R, Meccariello R. Expression analysis of gnrh1 and gnrhr1 in spermatogenic cells of rat. Int J Endocrinol. 2015;2015:982726. doi: 10.1155/2015/982726.
- Burganova G, Bridges C, Thorn P, Landsman L. The role of vascular cells in pancreatic beta-cell function. Front Endocrinol (Lausanne). 2021;12:667170. doi: 10.3389/fendo.2021.667170.
- Chekalina NI. Resveratrol has a positive effect on parameters of central hemodynamics and myocardial ischemia in patients with stable coronary heart disease. Wiad Lek. 2017;70(2 pt 2):286-291.
- Chen S, Wang W, Shen L, Liu H, Luo J, et al. A 3D-printed microdevice encapsulates vascularized islets composed of iPSC-derived β-like cells and microvascular fragments for type 1 diabetes treatment. Biomaterials. 2025;315:122947. doi: 10.1016/j.biomaterials.2024.122947.
- Crawford ED, Schally AV. The role of FSH and LH in prostate cancer and cardiometabolic comorbidities. Can J Urol. 2020;27(2):10167-10173.
- Demirci A, Sahin AS, Soner BC, Esen HH. Effects of safranal on antidiabetic and endothelial dysfunction in streptozotocin-induced diabetic rats. Mol Biol Rep. 2025;52(1):741. doi: 10.1007/s11033-025-10839-y.
- Frankel YD, Cherno VS, Kostenko VO. Effect of melatonin and quercetin on inflammation and metabolism under conditions of round-the-clock lighting and high-calorie carbohydrate-lipid diet. Fiziologichnyi Zhurnal. 2024;70(1):43-51. doi: 10.15407/fz70.01.043.
- Hoesli CA, Kieffer TJ. Pancreatic islets in bed with microvasculature-companions for life. Cell Rep Med. 2021;2(11):100454. doi: 10.1016/j.xcrm.2021.100454.
- Hassanein EM, Szelényi Z, Szenci O. Gonadotropin-releasing hormone (GnRH) and its agonists in bovine reproduction I: structure, biosynthesis, physiological effects, and its role in estrous synchronization. Animals (Basel). 2024;14(10):1473. doi: 10.3390/ani14101473.
- Koval SM, Yushko KO, Snihurska IO, et al. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension. 2019;23(3):183-189. doi: 10.5603/AH.a2019.0012.
- Konijnenberg LS, Luiken TT, Veltien A, Uthman L, Kuster CT, et al. Imatinib attenuates reperfusion injury in a rat model of acute myocardial infarction. Basic Res Cardiol. 2023;118(1):59. doi: 10.1007/s00395-022-00974-z.
- Oesterle SN, Sanborn TA, Ali N, Resar J, Ramee SR, et al. Percutaneous transmyocardial laser revascularisation for severe angina: the PACIFIC randomised trial. Potential class improvement from intramyocardial channels. Lancet. 2000;356(9243):1705-1710. doi: 10.1016/s0140-6736(00)03203-7.
- Mateus Gonçalves L, Andrade Barboza C, Almaça J. Dia–betes as a pancreatic microvascular disease — a pericy–tic perspective. J Histochem Cytochem. 2024;72(3):131-148. doi: 10.1369/00221554241236535.
- Opryshko V, Prokhach A, Akimov O, Riabushko M, Kostenko H, et al. Desmodium styracifolium: botanical and ethnopharmacological insights, phytochemical investigations, and prospects in pharmacology and pharmacotherapy. Heliyon. 2024;10(3):e25058. doi: 10.1016/j.heliyon.2024.e25058.
- Reyes-Soffer G, Ginsberg HN, Berglund L, Duell PB, Heffron SP, et al.; American Heart Association Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular Radio–logy and Intervention; and Council on Peripheral Vascular Disease. Lipoprotein (a): a genetically determined, causal, and prevalent risk factor for atherosclerotic cardiovascular disease: a scientific statement from the American Heart Association. Arterioscler Thromb Vasc Biol. 2022;42(1):e48-e60. doi: 10.1161/atv.0000000000000147.
- Shaienko Z, Morokhovets H. Diagnostic and prognostic value of inflammatory indices in patients with prediabetes and type 2 diabetes mellitus. Int J Endocrinol (Ukraine). 2025;21(3):259-264. doi: 10.22141/2224-0721.21.3.2025.1536.
- Shaienko ZO, Akimov OY, Kostenko VO, Neporada KS. The effect of quercetin on the development of oxidative stress and nitric oxide production in the blood of patients with type 2 diabetes mellitus. Rom J Diabetes Nutr Metab Dis. 2025;32(1):34-39. Available from: https://www.rjdnmd.org/index.php/RJDNMD/article/view/1753.
- Spaska A, Grytsuliak B. Anatomical variations of the pancreatic blood vessels in patients with diabetes/metabolic syndrome. Qatar Med J. 2025;2025(2):48. doi: 10.5339/qmj.2025.48.
- Sciarrone DF, McLaughlin RA, Argarini R, To MS, Naylor LH, et al. Visualising and quantifying microvascular structure and function in patients with heart failure using optical coherence tomo–graphy. J Physiol. 2022;600(17):3921-3929. doi: 10.1113/jp282940.
- Stetsuk YV, Shepitko VI, Pronina OM, Zaporozhets TM, Boruta NV, et al. Effect of quercetin administration on electron microscopic changes in testicular interstitial endocrinocytes during long-term central blockade of luteinising hormone in rats. Rep Morphol. 2024;30(1):68-75. doi: 10.31393/morphology-journal-2024-30(1)-09.
- Tamayo A, Gonçalves LM, Rodriguez-Diaz R, Pereira E, Canales M, et al. Pericyte control of blood flow in intraocular islet grafts impacts glucose homeostasis in mice. Diabetes. 2022;71(8):1679-1693. doi: 10.2337/db21-1104.