Международный неврологический журнал 3(3) 2005
Вернуться к номеру
Инфаркты в вертебрально-базилярном бассейне: клиника и диагностика
Авторы: С.М.Виничук, И.С.Виничук, Национальный медицинский университет, Киев; Т.А.Ялынская, Клиническая больница «Феофания», Киев
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
В работе проведен клинико-нейровизуализационный анализ у 79 пациентов с клинической картиной ишемического инфаркта в вертебрально-базилярном бассейне (ВББ). Описаны особенности неврологической клиники лакунарных и нелакунарных заднециркулярных инфарктов. Для их верификации использовали методику магнитно-резонансной томографии (МРТ). Более информативной для диагностики острых лакунарных и нелакунарных инфарктов в стволе головного мозга оказалась методика диффузионно-взвешенной магнитно-резонансной томографии (ДВ МРТ).
Окклюзионное поражение артерий в вертебрально-базилярном бассейне (ВББ) приводит к развитию заднециркулярных инфарктов (posterior circulation infarcts) с локализацией в различных отделах ствола головного мозга, таламуса, затылочных долей и мозжечка. Частота их развития занимает второе место (20%) после инфаркта в бассейне средней мозговой артерии (СМА) (Камчатов П.Р., 2004) и составляет 10-14% в структуре всех ишемических инсультов (Виничук С.М., 1999; Евтушенко С.К., 2004; Toi H. et al, 2003). Согласно данным других авторов, у европейцев патология интракраниальных артерий в ВББ встречается чаще, чем в каротидном бассейне (Ворлоу Ч.П. и соавт., 1998).
Задняя вертебрально-базилярная система эволюционно более древняя, чем передняя — каротидная. Она развивается совершенно отдельно от каротидной системы и образуется артериями, которые имеют разные структурные и функциональные характеристики: позвоночными и основной артериями и их ветвями.
В системе вертебрально-базилярного бассейна выделяют три группы артерий (Ворлоу Ч.П. и соавт., 1998) (рис. 1):
— мелкие артерии, так называемые парамедианные, отходящие непосредственно от стволов позвоночной и основной артерий, от передних спинальных артерий, а также глубокие перфорирующие артерии, берущие начало от задней мозговой артерии (ЗМА);
— короткие огибающие (или круговые) артерии, кровоснабжающие соответственно боковые территории ствола мозга, область покрышки, а также длинные огибающие артерии — задняя нижняя мозжечковая артерия (ЗНМА), передняя нижняя мозжечковая артерия (ПНМА), верхняя мозжечковая артерия (ВМА), ЗМА с её ветвями и передняя ворсинчатая артерия;
— крупные или большие артерии (позвоночные и основная) в экстра- и интракраниальном отделах.
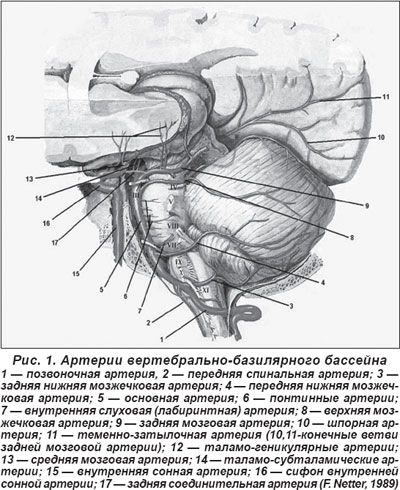
Наличие в заднем вертебрально-базилярном бассейне артерий разного калибра с различиями в их строении, анастомозном потенциале и с различными зонами кровоснабжения мелких, глубинных перфорирующих артерий, коротких и длинных огибающих артерий, а также крупных артерий в большинстве случаев определяют локализацию очага поражения, его размеры и клиническое течение заднециркулярных инфарктов. В то же время индивидуальные различия в расположении артерий, разнообразие патогенетических механизмов очень часто определяют индивидуальные особенности неврологической клиники при острых ишемических инсультах в ВББ. Поэтому, наряду с наличием типичных неврологических синдромов, врачи нередко отмечают не ту клиническую картину вертебрально-базилярного инсульта, которая описана в клинических руководствах, а его атипичное течение, что затрудняет определение характера инсульта и выбор адекватной терапии. При такой клинической ситуации могут помочь только методы визуализации головного мозга.
Материалы и методы исследования
Проведено комплексное клинико-нейровизуализационное обследование 79 пациентов (48 мужчин и 31 женщина) в возрасте от 37 до 89 лет (в среднем 65,2±1,24 года). В исследование были включены все поступившие с клинической картиной острого ишемического инсульта в ВББ. Пациенты поступали в течение 6-72 ч с момента возникновения первых симптомов заболевания. Основной причиной ишемических нарушений мозгового кровообращения (НМК) была артериальная гипертензия в сочетании с атеросклерозом сосудов (74,7%), еще у 22,8% обследованных она сочеталась с сахарным диабетом; у 25,3% пациентов основным этиологическим фактором заболевания был атеросклероз. Информация о пациентах регистрировалась в стандартных протоколах, которые включали демографические показатели, факторы риска, клинические симптомы, результаты лабораторных и нейровизуализационных исследований, исход и др.
Степень нарушения неврологических функций оценивали при госпитализации пациентов, в процессе лечения и в конце терапии по шкале NIHSS (National Institutes of Health Stroke Scale, США). Одновременно использовали шкалу B. Hoffenberth и соавторов (1990), которая предполагает более адекватную оценку клинических параметров при острых НМК в ВББ. Для оценки степени восстановления неврологических функций использовали модифицированную шкалу Рэнкина (G.Sulter et al., 1999). Подтипы ишемических инсультов классифицировались согласно шкале Группы по изучению цереброваскулярных заболеваний Национального Института неврологических нарушений и инсульта (Special Report from the National Institute of Neurological Disorders and Stroke (1990) Classification of cerebrovascular diseases III. Stroke 21: 637-676; учитывали также критерии TOAST (Trial of ORG 10172 in Acute Stroke Treatment — исследование низкомолекулярного гепарина ORG 10172 в терапии острого инсульта) (A.J.Grau et al., 2001). Определение лакунарных синдромов основывалось на данных клинических исследований К.Миллера Фишера (C.M. Fisher, 1965; 1982) и методов нейровизуализации.
Проводили стандартные лабораторные тесты: исследование уровня глюкозы, мочевины, креатинина, гематокрита, фибриногена, кислотно-основного баланса, электролитов, липидов, показателей коагулирующих свойств крови.
Всем пациентам проводили ультразвуковую допплерографию магистральных сосудов головы в экстракраниальном отделе (УЗДГ) и транскраниальную допплерографию (ТКД), в отдельных случаях — дуплексное сканирование; проводили 12-электродное ЭКГ, контролировалось артериальное давление (АД); определяли объемный МК по внутренней сонной (ВСА) и позвоночной артерии (ПА).
Спиральная компьютерная томография (СКТ) головного мозга проводилась во всех случаях сразу при поступлении пациентов в стационар. Она позволяла определить тип инсульта: ишемия или геморрагия. Вместе с тем использование СКТ не всегда позволяло выявить инфаркт ствола головного мозга в острый период заболевания. В таких случаях использовали методику рутинной магнитно-резонансной томографии (МРТ), поскольку магнитно-резонансные изображения задней черепной ямки более информативные, чем СКТ. МРТ головного мозга проводили на аппарате «Magnetom Symphony» («Siemens») с напряженностью магнитного поля 1,5 Тл и на аппарате «Flexart» («Toshiba») с напряженностью магнитного поля 0,5 Тл. Применяли стандартный протокол сканирования, включающий получение TIRM (Turbo Inversion Recovery Magnifucle) и T2-взвешенных изображений (T2-BИ) в аксиальной плоскости, T1-взвешенных изображений (T1-BИ) в сагиттальной и коронарных плоскостях. Однако при наличии нескольких патологических очагов с помощью методики МРТ трудно было определить степень их давности, верифицировать очаг инфаркта в продолговатом мозге, особенно в острый период. В таких случаях использовали более чувствительную методику нейровизуализации — диффузионно-взвешенную магнитно-резонансную томографию (ДВ МРТ).
С помощью диффузионно-взвешенных изображений (ДВИ) можно определить участок острой ишемии головного мозга в течение нескольких часов после развития инсульта, что проявляется снижением измеряемого коэффициента диффузии (ИКД) воды и повышением МР-сигнала на ДВИ. Ограничение диффузии воды возникает вследствие недостаточности энергии (потеря тканевой АТФ, ослабление функции натрий-калиевого насоса) и наступающего цитотоксического отека ишемизированной ткани мозга (Neumann-Haefelin T at al., 1999). Поэтому считают, что ДВИ особенно чувствительны в выявлении очага ишемии со сниженным содержанием АТФ и высоким риском необратимого повреждения нейронов (von Kummer R., 2002). Ткань мозга после перенесенной острой фокальной ишемии с высоким МР-сигналом на ДВИ и низким ИКД соответствует инфарктному очагу.
Другая современная чувствительная методика нейровизуализации головного мозга — перфузионно-взвешенная (ПВ) МРТ, которая используется в клинической практике, дает информацию о гемодинамическом состоянии ткани мозга и может выявить нарушения перфузии как в зоне ишемического ядра, так и в окружающих коллатеральных участках. Поэтому в течение первых часов после развития инсульта участки расстройств перфузии на перфузионно-взвешенном изображении (ПВИ), как правило, более обширные, чем на ДВИ. Считается, что эта зона диффузионно-перфузионного несоответствия (ДВИ/ПВИ) отображает ишемическую пенумбру, т.е. «ткань в состоянии риска» функциональных нарушений (Neumann-Haefelin T at al., 1999).
ДВ МРТ в аксиальной плоскости нами выполнена при обследовании 26 пациентов (32,9%): 12 пациентов обследовали в течение 24 ч после развития инфаркта, в том числе 1 — в течение 7 ч, 2 — до 12 ч от начала заболевания. Остальным больным выполняли ДВИ на 2-3 сутки и в динамике заболевания: 3 раза обследовали 4 пациентов, 2 раза — 14,1 раз — 8.
Магнитно-резонансная ангиография, которая позволяет визуализировать большие экстра- и интракраниальные артерии, проведена 17 пациентам (30,4%) с нелакунарным ишемическим инфарктом.
Цель нашего исследования — оценить значение клинических и нейровизуализационных методов в диагностике лакунарных и нелакунарных заднециркулярных инфарктов.
Результаты и их обсуждение
Клинико-нейровизуализационное обследование 79 пациентов (48 мужчин и 31 женщина, в возрасте от 60 до 70 лет) с клинической картиной ишемического инсульта в ВББ позволило выделить такие клинические формы острых ишемических нарушений мозгового кровообращения: транзиторные ишемические атаки (ТИА) (n=17), лакунарные ТИА (n=6), лакунарный инфаркт (n=19), нелакунарный инфаркт в ВББ (n=37). У больных с ТИА и лакунарными ТИА неврологический дефицит регрессировал в течение первых 24 ч от начала заболевания, хотя у пациентов с лакунарными ТИА на МРТ выявляли небольшие очаги лакунарного инфаркта. Мы их анализировали отдельно. Поэтому основная исследуемая группа составила 56 пациентов.
С учетом причин и механизмов развития острого НМК выделены такие подтипы ишемических инфарктов: лакунарный инфаркт (n=19), атеротромботический (n=21), кардиоэмболический (n=12) инфаркты и инфаркт по неизвестной причине (n=4).
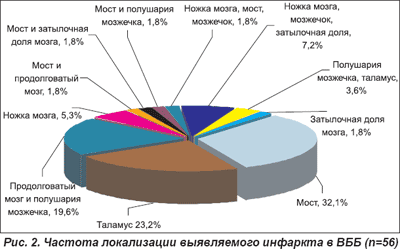
Частота локализации выявляемого ишемического инфаркта в ВББ, верифицированного методами нейровизуализации, была различной (рис. 2). Как видно из приведенных данных, наиболее часто очаги инфаркта выявляли в области моста (32,1%), таламуса (23,2%), реже — в области ножек мозга (5,4%). У многих обследованных (39,4%) заднециркулярные инфаркты были обусловлены многоочаговым поражением: продолговатый мозг и полушария мозжечка (19,6%); различные отделы ствола головного мозга и полушария мозжечка, затылочная доля мозга; полушария мозжечка и таламус; затылочные доли мозга.
Хотя на основании клинических данных нельзя было точно определить артериальную локализацию очага поражения, методы нейровизуализации позволили провести клиническое описание инфаркта в ВББ с учетом сосудистой территории кровоснабжения и за критериями ТОАST классифицировать все заднециркулярные ишемические инфаркты на лакунарные и нелакунарные.
Классификация ишемических инфарктов в ВББ по этиологическим и патогенетическим признакам:
— лакунарные инфаркты вследствие поражения мелких перфорирующих артерий, обусловленные микроангиопатиями на фоне артериальной гипертензии и сахарного диабета, при условии отсутствия источников кардиоэмболии и стеноза крупных вертебрально-базилярных артерий (n=19);
— нелакунарные инфаркты вследствие поражения коротких и/или длинных огибающих ветвей позвоночной и основной артерий при наличии источников кардиоэмболии и отсутствии стеноза крупных вертебрально-базилярных артерий (n=30);
— нелакунарные инфаркты вследствие окклюзионного поражения крупных артерий (позвоночной и основной), в экстра- или интракраниальном отделах, т.е. обусловленные макроангиопатиями (n=7).
Как видно из приведенных данных, поражение мелких ветвей было причиной лакунарных инфарктов в 33,9% случаев; поражение коротких или длинных огибающих ветвей позвоночной или основной артерий являлось наиболее частой (53,6%) причиной развития нелакунарного инфаркта; окклюзия крупных артерий также приводила к возникновению нелакунарного инфаркта и выявлялась у 12,5% обследуемых. Локализация очага на МРТ и ДВ МРТ головного мозга относительно часто коррелировала с неврологической клиникой.
I. Лакунарные инфаркты в ВББ
Клиническая характеристика и исход 19 пациентов с лакунарными инфарктами (ЛИ) в ВББ, верифицированные методами нейровизуализации, приведены в табл. 1. Очаги ЛИ обычно имели округлые очертания, около 0,5-1,5 см в диаметре. Если при первом исследовании диаметр ЛИ составлял более 1 см, он чаще увеличивался при повторном проведении МРТ.
Лакунарные инфаркты возникали вследствие поражения отдельной парамедианной ветви ПА, ОА или одной перфорирующей таламогеникулярной артерии — ветви ЗМА на фоне артериальной гипертензии, которая нередко сочеталась с гиперлипидемией, а у 6 пациентов — с сахарным диабетом. Начало заболевания было острым, иногда сопровождалось головокружением, тошнотой, рвотой. Фоновый неврологический дефицит по шкале NIHSS соответствовал 4,14±0,12 балла, по шкале В.Hoffenberth — 5,37±0,12 балла, т.е. отвечал нарушениям неврологических функций легкой степени тяжести.
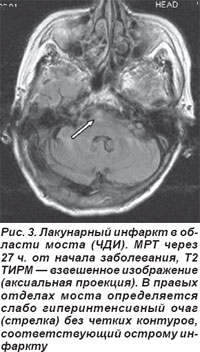
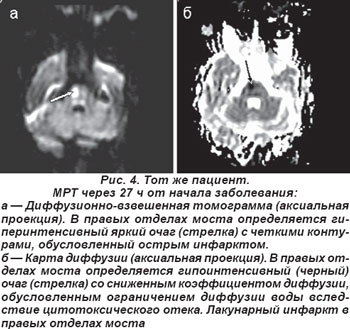
Чаще выявлялся (n=9) чисто двигательный инфаркт (ЧДИ), обусловленный поражением двигательных путей в области основания моста, которые кровоснабжаются мелкими парамедианными артериями, отходящими от основной артерии. Он сопровождался парезом мимических мышц и руки или страдали полностью рука и нога с одной стороны. Полный моторный синдром выявляли у 3 пациентов, частичный — у 6 (лицо, рука или нога), они не сопровождались объективными симптомами расстройств чувствительности, явными нарушениями функции ствола мозга: выпадение полей зрения, снижение слуха или глухота, шум в ушах, диплопия, мозжечковая атаксия и грубый нистагм. Для иллюстрации приводим МРТ пациента (рис. 3), проведенную через 27 ч от начала заболевания, Т2 TIRM — взвешенная томограмма в аксиальной проекции, на которой выявлен лакунарный инфаркт в правых отделах моста. Диагноз ЛИ подтверждается данными ДВ МРТ и картой диффузии (рис. 4). Клинически определялся ЧДИ.
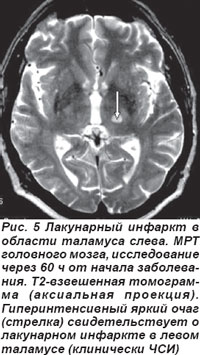
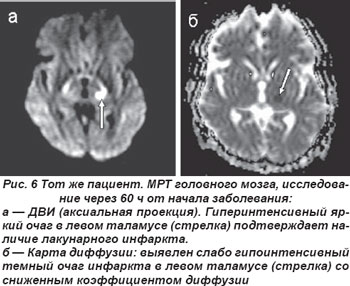
Лакунарные инфаркты в таламусе у 5 пациентов обусловили развитие чисто сенсорного синдрома (ЧСС), причиной которого являлось поражение латеральных отделов таламуса вследствие окклюзии таламогеникулярной артерии (рис. 5, 6). Гемисенсорный синдром был полным у 2 пациентов и неполным — у 3. Полный гемисенсорный синдром проявлялся снижением поверхностной и/или глубокой чувствительности или онемением кожных покровов по гемитипу при отсутствии гомонимной гемианопсии, афазии, агнозии и апраксии. При неполном гемисенсорном синдроме чувствительные расстройства регистрировались не на всей половине тела, а на лице, руке или ноге. У 2 пациентов выявлялся хейро-оральный (cheiro-oral) синдром, когда нарушения чувствительности возникали в области угла рта и ладони гомолатерально; у одного больного определялся хейро-педо-оральный (cheiro-oral-pedal) синдром, он проявлялся гипалгезией болевой чувствительности в области угла рта, ладоней и стоп с одной стороны без моторных расстройств.
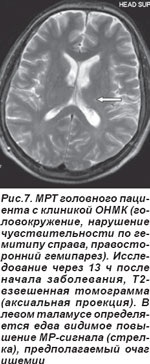
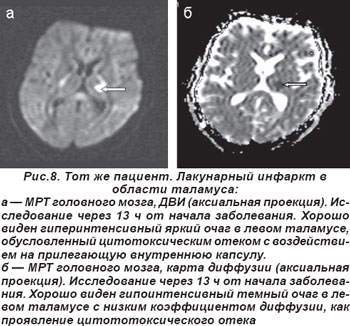
У 2 пациентов лакунарный инфаркт таламуса сопровождался распространением ишемии в сторону внутренней капсулы, что обусловило развитие сенсомоторного инсульта (СМИ) (рис. 7, 8). Неврологическая симптоматика была вызвана наличием лакуны в латеральном ядре таламуса, но при этом наблюдалось воздействие на прилегающую ткань внутренней капсулы. В неврологическом статусе определялись нарушения чувствительности и движений, но расстройства чувствительности предшествовали нарушениям моторики.
У 2 пациентов был диагностирован «атактический гемипарез». Лакуны выявлялись в основании моста. Неврологическая клиника проявлялась гемиатаксией, умеренной слабостью ноги, легким парезом руки. Синдром дизартрии и неловкой руки (dysarthria-clumsy — hand syndrom) выявлялся у одного пациента, был обусловлен локализацией лакуны в базальных отделах моста и сопровождался дизартрией и выраженной дисметрией руки и ноги.
Лакунарные инфаркты в ВББ характеризовались хорошим прогнозом, восстановление неврологических функций наступило в среднем на 10,2±0,4 день лечения: у 12 пациентов — полное восстановление, у 7 оставалась незначительная неврологическая микросимптоматика (дизестезии, боль), которая не влияла на выполнение своих прежних обязанностей и на повседневную жизненную активность (1 балл по шкале Рэнкина).
II. Нелакунарные инфаркты в ВББ
Клиническая характеристика больных с нелакунарным инфарктом в ВББ различной этиологии приводится в табл. 2. Как свидетельствуют приведенные данные, наиболее часто неврологическими симптомами у больных с острым ишемическим инфарктом вследствие поражения коротких или длинных огибающих ветвей позвоночной (ПА) или основной (ОА) артерий были: системное головокружение, головная боль, ухудшение слуха с шумом в том же ухе, двигательные и мозжечковые расстройства, нарушения чувствительности в зонах Зельдера и/или по моно- или гемитипу. Клинико-неврологический профиль заднециркулярных инфарктов вследствие поражения крупных артерий (позвоночных и основной) у всех пациентов проявлялся дефектом поля зрения, двигательными расстройствами, нарушениями статики и координации движений, мостовым парезом взора, реже — головокружением, нарушением слуха.
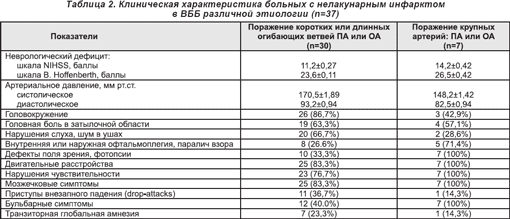
Анализ фонового неврологического дефицита у пациентов с нелакунарными инфарктами вследствие поражения коротких или длинных огибающих артерии ПА или ОА свидетельствует, что нарушения неврологических функций по шкале NIHSS соответствовали средней степени тяжести (11,2±0,27 балла), а по шкале В. Hoffenberth — тяжелым нарушениям (23,6±0,11 балла). Таким образом, шкала В. Hoffenberth и соавторов (1990) по сравнению со шкалой NIHSS при оценке острого вертебрально-базилярного инсульта более адекватно отражала нарушения неврологических функций, тяжесть состояния пациентов. В то же время при инфарктах в ВББ вследствие поражения крупных артерий и развития грубого неврологического дефекта применяемые шкалы однонаправленно отображали объем неврологического дефицита, вероятно, потому, что у пациентов преобладали обширные ишемические инфаркты.
Исходный уровень артериального давления у больных с окклюзией крупных артерий ВББ был значительно ниже, чем у пациентов с поражением коротких или длинных огибающих ветвей позвоночной или основной артерии. У некоторых больных с окклюзией крупных артерий, обусловившей развитие крупноочагового стволового инфаркта, при поступлении регистрировалась артериальная гипотензия. С другой стороны, артериальная гипертензия в первые сутки после инсульта у больных с поражением коротких или длинных огибающих ветвей ПА и ОА могла быть проявлением компенсаторной сосудисто-мозговой реакции (феномен Кушинга), которая возникала в ответ на ишемию стволовых образований головного мозга. Обращала на себя внимание лабильность артериального давления в течение суток с повышением его в утренние часы после сна.
Клиническая картина нелакунарных инфарктов, обусловленных поражением коротких и/или длинных огибающих ветвей позвоночной и основной артерий при наличии источников кардиоэмболии и отсутствии стеноза крупных вертебрально-базилярных артерий, была гетерогенной с различным клиническим течением. При прочих равных условиях развитие очаговых изменений в задних отделах головного мозга зависела от уровня поражения, артериального русла и размера очага инфаркта.
Закупорка задней нижней мозжечковой артерии проявлялась альтернирующим синдромом Валленберга-Захарченко. В классическом варианте он проявлялся системным головокружением, тошнотой, рвотой, дисфагией, дизартрией, дисфонией, нарушением чувствительности на лице по сегментарному диссоциированному типу в зонах Зельдера, синдромом Бернера-Горнера, мозжечковой атаксией на стороне очага и двигательными расстройствами, гипестезией болевой и температурной чувствительности на туловище и конечностях с противоположной стороны. Такими же неврологическими расстройствами характеризовалась закупорка интракраниального отдела ПА на уровне отхождения от нее задней нижней мозжечковой артерии и парамедианных артерий.
Нередко наблюдались варианты синдрома Валленберга-Захарченко, которые возникали при окклюзирующих поражениях парамедианных артерий ПА, медиальных или латеральных ветвей ЗНМА и клинически проявлялись системным головокружением, нистагмом, мозжечковой атаксией. На МРТ головного мозга у них выявлялись очаги инфаркта в медиальных или латеральных отделах продолговатого мозга и нижних отделов полушарий мозжечка.
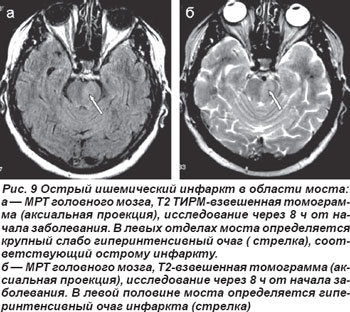
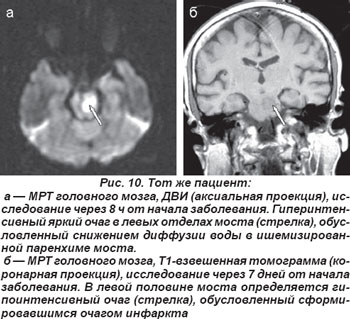
В случае кардиоэмболической окклюзии парамедианных или коротких огибающих ветвей основной артерии возникали нелакунарные инфаркты в области моста (рис. 9, 10). Неврологическая клиника их была полиморфной и зависела от уровня поражения артериального русла и локализации очага инфаркта. Закупорка парамедианных артерий моста проявлялась альтернирующими синдромами Фовилля — периферический парез мимических мышц и наружной прямой мышцы глаза на стороне очага с контрлатеральным гемипарезом или Мийара-Гюблера: периферический парез мимических мышц на стороне очага и гемипарез на противоположной стороне.
При закупорке ветвей основной артерии, кровоснабжающих средний мозг, возникали парез мышц, иннервируемых глазодвигательным нервом, на стороне очага и гемиплегия на противоположной стороне (синдром Вебера) или гемиатаксия и атетоидные гиперкинезы в контрлатеральных конечностях (синдром Бенедикта) или интенционный гемитремор, гемиатаксия с мышечной гипотонией (синдром Клода). При инфаркте в бассейне артерии четверохолмия возникал паралич взгляда вверх и недостаточность конвергенции (синдром Парино), который сочетался с нистагмом.
Двусторонние инфаркты в бассейне парамедианных и коротких огибающих артерий ОА характеризовались развитием тетрапареза, псевдобульбарного синдрома и мозжечковыми нарушениями.
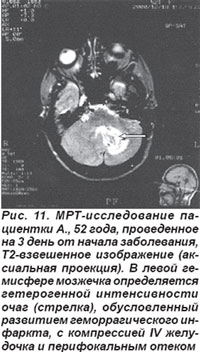
Инфаркт мозжечка возникал остро вследствие кардиальной или артерио-артериальной эмболии передней нижней мозжечковой артерии или верхней мозжечковой артерии и сопровождался общемозговыми симптомами, нарушением сознания. Закупорка ПНМА приводила к развитию очага инфаркта в области нижней поверхности полушарий мозжечка и моста. Основными симптомами были головокружение, шум в ушах, тошнота, рвота и на стороне очага поражения парез мимических мышц по периферическому типу, мозжечковая атаксия, синдром Бернера-Горнера. При окклюзии ВМА очаг инфаркта формировался в средней части полушарий мозжечка и сопровождался головокружением, тошнотой, мозжечковой атаксией на стороне очага (рис. 11). Церебеллярные ишемические инсульты возникали также при закупорке позвоночной или основной артерий.
Закупорка внутренней слуховой (лабиринтной) артерии, которая в большинстве случаев берет начало от передней нижней мозжечковой артерии (может отходить и от основной артерии) и является концевой, возникала изолированно и проявлялась системным головокружением, односторонней глухотой без признаков поражения ствола головного мозга или мозжечка.
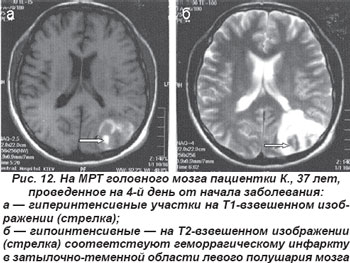
Закупорка ЗМА или ее ветвей (шпорная и теменно-затылочная артерия) обычно сопровождалась контрлатеральной гомонимной гемианопсией, зрительной агнозией при сохранности макулярного зрения. В случае левосторонней локализации очага инфаркта возникали амнестическая или семантическая афазии, алексия. Поражение ветвей ЗМА, которые кровоснабжают кору теменной доли на границе с затылочной, проявлялось корковыми синдромами: дезориентацией в месте и времени, зрительно-пространственными нарушениями. Крупноочаговые инфаркты затылочной доли мозга сопровождались геморрагической трансформацией инфаркта (рис. 12).
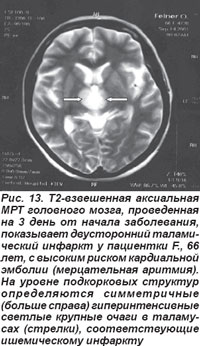
Таламические инфаркты возникали вследствие поражения таламо-субталамической (таламоперфорирующих, парамедианных ветвей) и таламогеникулярной артерий, являющихся ветвями задней мозговой артерии. Окклюзия их сопровождалась угнетением сознания, парезом взора вверх, нейропсихологическими нарушениями, расстройством памяти (антероградная или ретроградная амнезия), контрлатеральной гемигипестезией. Более тяжелые нарушения (угнетение сознания, парез взора вверх, амнезия, таламическая деменция, синдром акинетического мутизма) возникали при двустороннем таламическом инфаркте, который развивался вследствие атероматозной или эмболической окклюзии общей ножки таламо-субталамической артерии, парамедианные ветви которой кровоснабжают заднемедиальные отделы таламусов (рис. 13). Окклюзия таламо-геникулярной артерии вызывала развитие инфаркта вентролатеральной области таламуса и сопровождалась синдромом Дежерина-Русси: на противоположной очагу поражения стороне выявлялся преходящий гемипарез, гемианестезия, хореоатетоз, атаксия, гемиалгии и парестезии.
Закупорка задних ворсинчатых артерий, являющихся ветвями ЗМА, приводила к развитию инфаркта в области задних отделов таламуса (подушки), коленчатых тел и проявлялась контрлатеральной гемианопсией, иногда нарушением психической деятельности.
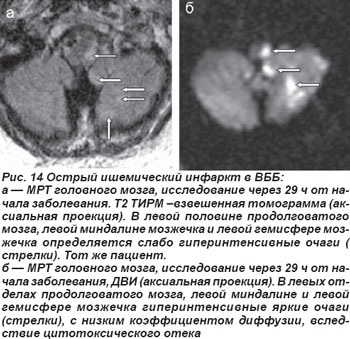
Закупорка позвоночной артерии (ПА) возникала как на экстракраниальном, так и на интракраниальном уровнях. При окклюзии экстракраниального отдела ПА отмечались кратковременная потеря сознания, системное головокружение, нарушения зрения, глазодвигательные и вестибулярные расстройства, нарушения статики и координации движений, выявлялись также парезы конечностей, нарушения чувствительности. Нередко возникали приступы внезапного падения — drop attacks с нарушением мышечного тонуса, вегетативные расстройства, нарушения дыхания, сердечной деятельности. На МРТ головного мозга выявлялись инфарктные очаги латеральных отделов продолговатого мозга и нижних отделов полушарий мозжечка (рис. 14, 15).
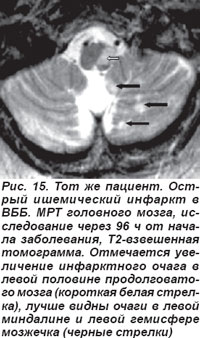
Окклюзия интракраниального отдела ПА проявлялась альтернирующим синдромом Валленберга-Захарченко, который в классическом варианте выявлялся и при закупорке ЗНМА.
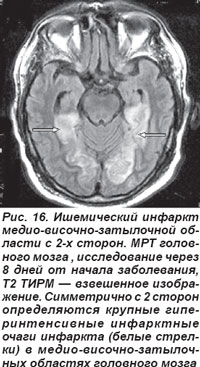
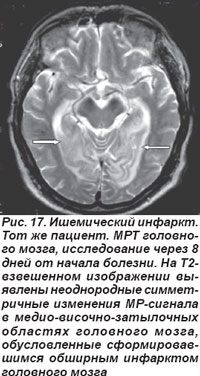
Закупорка основной артерии сопровождалась поражением моста, среднего мозга, мозжечка, характеризовалась потерей сознания, глазодвигательными расстройствами, обусловленными патологией III, IV, VI пар черепных нервов, развитием тризма, тетраплегии, нарушением мышечного тонуса: кратковременная децеребрационная ригидность, горметонические судороги, которые сменялись мышечной гипо- и атонией. Острая эмболическая окклюзия ОА в области развилки приводила к ишемии ристральных отделов ствола мозга и двустороннему ишемическому инфаркту в бассейне кровоснабжения задних мозговых артерий (рис. 16, 17). Такой инфаркт проявлялся корковой слепотой, глазодвигательными нарушениями, гипертермией, галлюцинациями, амнезией, расстройствами сна и в большинстве случаев заканчивался летальным исходом.
Таким образом, заднециркулярные ишемические инфаркты разные этиологически, гетерогенны по клиническому течению и с разным исходом.
Результаты нашего исследования показывают, что методика МРТ чувствительна в отношении выявления острых ишемических заднециркулярных инсультов. Вместе с тем, она не всегда позволяла визуализировать острый лакунарный инфаркт или очаги ишемии в стволе головного мозга, особенно в области продолговатого мозга. Для их выявления более информативной являлась методика диффузионно-взвешенной МРТ.
Чувствительность ДВИ в выявлении острого инфаркта ствола головного мозга в период до 24 ч после начала инсульта составила 67%, инфарктный очаг на протяжении этого времени не выявлен у 33% пациентов, т.е. у трети обследованных с клиническими симптомами инфаркта ствола головного мозга выявлялись ложноотрицательные результаты. Повторно обследования больных через 24 ч с использованием ДВ МРТ головного мозга обнаруживали инфарктную зону.
Недостаточная информативность методики ДВИ при определении острого инфаркта при локализации в стволе головного мозга можно объяснить двумя факторами. Во-первых, наличием малых ишемических очагов, поскольку перфорирующие артерии васкуляризируют очень маленькие зоны ствола мозга. Во-вторых, нейроны ствола головного мозга более стойкие к ишемии, чем нейроны более молодых эволюционно полушарий большого мозга. Это могло быть одной из причин более высокой толерантности их к ишемии и более позднего развития цитотоксического отека ткани ствола головного мозга (Toi H. et al., 2003).
1. Віничук С.М. Судинні захворювання нервової системи. — Київ: Наук. думка. — 1999. — 250 с.
2. Ворлоу Ч.П., Деннис М.С., ван Гейн Ж., Ханкий Г.Ж., Сандеркок П.А.Г., Бамфорд Ж.М., Вордлау Ж. Инсульт: Практическое руководство для ведения больных (Пер. с англ.). — Политехника, СПб, 1998. — 629 с.
3. Евтушенко С.К., В.А. Симонян, М.Ф. Иванова. Оптимизация тактики терапии у больных гетерогенным ишемическим поражением мозга // Вестник неотложной восстановительной медицины. — 2001. — Т.1, №1. — С. 40-43.
4. Камчатов П.Р. Вертебрально-базилярная недостаточность // РМЖ. — 2004. — №12(10). — С. 614-616.
5. Grau A.J., Weimar C., Buggle F. et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke // Stroke. — 2001. — Vol. 32. — P. 2559-2566.
6. Fisher C.M. Lacunes: small, deep cerebral infarcts // Neurology. — 1965. — Vol. 15. — P. 774-784.
7. Fisher C.M. Lacunar strokes and infarcts: a review // Neurology. — 1982. — Vol. 32. — P. 871-876.
8. Von Kummer R. From stroke imaging to treatment. In Stroke: clinical aspects and imaging (teaching courses of the ENS). — 2002. — P. 5-24.
9. Neumann-Haefelin T., Wittsack H.J., Wenserski F., Sieler M., Seitz R.J., Modder V., Freund H.J. Diffusion — and perfusion — weighted MRІ. The DWI/PWI mismatch region in acute stroke. // Stroke. — 1999. — Vol. 30, №8. — P. 1591-1597.
10. Sulter G., Steen C., Dekeyser J. Use of the Barthel Index and Modified Rankin Scale in acute stroke trials //Stroke. — 1999. — Vol. 30. — P. 1538-1541.
11. Toi H., Uno M., Harada M., Yoneda K. et al. Diagnosis of acute brain-stem infarcts using diffusion — weighed MRI. // Neurology. — 2003. — Vol. 46, №6. — P. 352-356.
