Международный неврологический журнал 3(3) 2005
Вернуться к номеру
Лечение и исход острых ишемических нарушений мозгового кровообращения в вертебрально-базилярном бассейне
Авторы: С.М. Виничук, Т.И. Ильяш, М.М. Прокопив, Национальный медицинский университет, Киев
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
В работе анализируются результаты лечения и исход 79 больных с острыми ишемическими нарушениями мозгового кровообращения в вертебрально-базилярном бассейне (ВББ) на госпитальном этапе. Показано, что для повышения результативности терапии важным является назначение в комплексном лечении пирацетама (Ноотропила), оказывающего положительное действие на начальном этапе ишемического каскада и корригирующего его последствия, а также бетагистина дигидрохлорида (Бетасерк), обладающего нейромедиаторными и нейромодулирующими свойствами.
Известно, что патофизиология острого мозгового инфаркта и транзиторных ишемических атак (ТИА) определяется множеством неблагоприятных факторов. Среди них выделяют два наиболее важных, последовательно развивающихся процесса: 1) сосудистые (изменения эндотелия сосудов), гематологические (количество, состав и свойства крови), а также кардиологические (расстройства, ослабление насосной функции сердца) нарушения, которые вызывают начальный дефицит локального мозгового кровотока (МК) и определяют развитие локальной церебральной ишемии; 2) последующее развитие патобиохимических процессов в нервных клетках, вызванных ишемическим каскадом и ведущих либо к восстановлению функции нейронов ишемизированной ткани в случае своевременного и адекватного лечения или к необратимым изменениям клеток — нейрональной «смерти» (некрозу, апоптозу). Именно поэтому терапия острых церебральных ишемий должна базироваться на мониторинге функционального состояния системы кровообращения (параметры системного артериального давления, ЭКГ, ультразвуковой допплерографии магистральных сосудов головы и транскраниальной допплерографии), лабораторных тестов (показатели гликемии, гемокоагуляции, водноэлектролитного обмена, липидов, кислотно-основного состояния и др.), учете этиопатогенетических механизмов подтипов ишемического инфаркта, отрезка времени от начала его развития, выявлении церебральных и экстрацеребральных осложнений и др.
Интенсивная терапия острого мозгового инсульта, независимо от бассейна дисциркуляции (каротидный или вертебрально-базилярный), в основном идентичная и предполагает осуществление основных рекомендаций Европейской инициативы по изучению инсульта (EUSI) (Hacke W., Kaste M., Bogonsslavsky J. et al., 2003):
— коррекция и стабилизация жизненно важных функций;
— специфическая терапия: реканализация закупоренного сосуда или нивелирование механизмов, ведущих к нейрональной «смерти» в ишемизированной ткани головного мозга (нейропротекция);
— профилактика и лечение осложнений: неврологических (вторичная геморрагия, отек мозга, судороги) либо терапевтических (аспирация, инфекции, пролежни, тромбоз глубоких вен конечностей, тромбоэмболия легочной артерии);
— вторичная профилактика раннего повторного инфаркта;
— ранняя реабилитация.
Вместе с тем неотложная терапия острых церебральных ишемий должна предполагать выявление и лечение клинических состояний, которые при нарушении кровообращения в ВББ выявляются чаще, чем при поражении передней каротидной системы и могут угрожать жизни больного. Особенно важно обращать внимание на состояние дыхательных путей, дыхательной функции и кровообращения (Рекомендации Европейской инициативы по изучению инсульта, 2003). Более чем в 50% случаев заднециркулярные инсульты в ВББ сопровождались дисфагией, которая является фактором риска аспирации и дегидрации. В связи с этим важной составляющей базисной терапии таких пациентов является организация энтерального или зондового питания. Известно, что ТИА и ишемический инфаркт в ВББ часто проявляются вестибулярным головокружением и нарушением равновесия. Поэтому лечение таких состояний должно быть направлено и на ингибирование импульсации от рецепторов вестибулярных ядер ствола головного мозга с использованием нейромедиаторных, нейромодулирующих препаратов (бетагистина дигидрохлорид), предупреждающих углубление проявлений вертебрально-базилярной недостаточности (Евтушенко С.К., 1998; Лавров А.Ю., 2001).
Цель исследования — оценить эффективность комплексной терапии и исход лакунарных и нелакунарных заднециркулярных инфарктов.
Материалы и методы исследования
Проведен анализ результатов лечения и исхода 79 больных, поступивших в стационар с клинической картиной острого ишемического инсульта в ВББ. Мужчин было 48, женщин — 31, средний возраст — 65,2±1,24 года. В зависимости от длительности и обратимости неврологического дефицита выделены такие клинические формы ишемических НМК: ТИА (n=23), лакунарный инфаркт (ЛИ) (n=19), нелакунарный инфаркт (n=37). Основными этиологическими факторами заболевания были артериальная гипертензия в сочетании с атеросклерозом пре- и церебральных сосудов — у 74,4% больных, сахарный диабет — у 22,8%, ИБС с мерцательной аритмией — у 17,1%. Среди васкулярных факторов риска наиболее часто выявляли: курение — у 51,9%, злоупотребление алкоголем — у 32,9%, гиперлипидемию — у 31,6%, вирусную (HVS, CMV, VEB) или бактериальную инфекцию (стрептококк, хламидии) — у 20,3% обследуемых. Отягощенная наследственность по инсульту выявлялась у 27,8% пациентов. Объем неврологических нарушений оценивали по шкале NIHSS (National Institutes of Health Stroke Scale, США) и шкале B. Hoffenberth и соавторов (1990), а степень восстановления неврологических функций по шкале Рэнкина (G.Sulter et al., 1999). Определяли стандартные лабораторные тесты: уровень глюкозы, мочевины, гематокрита, фибриногена, кислотно-основного состояния, электролитов, липидов, показателей коагуляции крови. Всем пациентам проводили ультразвуковую допплерографию (УЗДГ), спиральную компьютерную томографию (СКТ), магнитно-резонансную томографию (МРТ); использовали также диффузионно-взвешенную МРТ. При статистической обработке материала использованы непараметрические критерии Спиринса.
Результаты и их обсуждение
Объем применяемой терапии у больных с ТИА и острым ишемическим инфарктом в ВББ на госпитальном этапе приведен в табл.1.
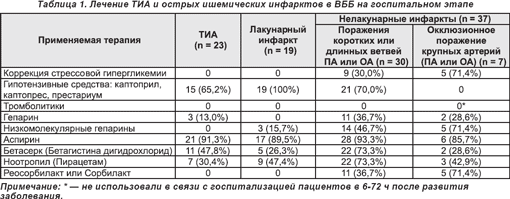
У трети обследуемых (37,8%) с крупноочаговыми нелакунарными инфарктами в ВББ регистрировалась острая гипергликемия (ГГ) на фоне сахарного диабета с фоновым уровнем глюкозы в крови от 7,0 до 17,8 ммоль/л (в среднем — 11,1 ± 1,2 ммоль/л) и стрессовая ГГ у лиц без диабета — от 7,2 до 14,1 ммоль/л (в среднем — 8,6 ± 0,7 ммоль/л). В таких случаях проводили коррекцию стрессовой гликемии с использованием фармасулина Н — человеческого рекомбинантного инсулина короткого действия по методике, разработанной на кафедре (Віничук С.М., Мельник В.С., Маргітич В.М., 2004). У пациентов с ТИА и ЛИ гипергликемии не выявляли.
Большое значение в комплексном лечении пациентов имела коррекция гемодинамических нарушений. В связи с тем что наиболее частой причиной поражения мелких парамедианных артерий ствола головного мозга и глубоких перфорирующих артерий, васкуляризирующих таламус, была артериальная гипертензия, обусловившая развитие ЛИ, назначали препараты АПФ (каптоприл, каптопрес, престариум). Достаточно высокими были показатели системного АД при нелакунарных инфарктах, обусловленных окклюзией коротких или длинных ветвей ПА или ОА. При такой гемодинамической ситуации проводили мониторинг АД и поддерживали его параметры на уровне 160-180/90-100 мм рт.ст. Если при повторных измерениях параметры систолического давления составляли ≥ 220 мм рт.ст., а диастолического ≥ 120 мм рт. ст., назначали гипотензивные средства и снижали АД до 180/100-105 мм рт. ст. Определить значения индивидуальных порогов АД для каждого пациента было достаточно трудно вследствие его лабильности в течение суток при заднециркулярных инфарктах.
Так как исходный уровень АД у пациентов с окклюзионным поражением крупных артерий был достоверно ниже, чем у больных с патологией мелких артерий или коротких огибающих ветвей ПА и ОА, гипотензивная терапия им не назначалась. У ряда больных этой группы в остром периоде инсульта регистрировалось значительное падение системного АД, что приводило к гемодинамическим расстройствам и гипоперфузии. В таких случаях эффективным было внутривенное капельное введение по 200 мл отечественных препаратов реосорбилакта или сорбилакта, которые улучшают мозговую микроциркуляцию, стабилизируют гемодинамику, увеличивают энергетический ресурс, снижают внутричерепное давление (сорбилакт).
Для стимуляции спонтанной реканализации закупоренной артерии, предупреждения реэмболизации при атеротромботическом и кардиоэмболическом подтипах нелакунарного ишемического инфаркта применяли прямые антикоагулянты (гепарин, низкомолекулярные гепарины), а также антиагреганты (аспирин). Хотя антикоагулянтные и антиагрегантные препараты не оказывали заметного реперфузионного действия, улучшение микроциркуляции в ишемизированной ткани служило основанием для их применения.
Комплексная терапия острых ишемических инсультов в ВББ предполагала также ранее применение нейропротекторов. Важную роль в определении целесообразности проведения нейропротективной терапии может сыграть нейровизуализация, в частности применение диффузионно-перфузионных МРТ-исследований, с помощью которых можно выявить жизнеспособные участки ишемической полутени.
Для уменьшения степени повреждения мозговых структур при острых заднециркулярных инфарктах на догоспитальном этапе и в течение 5-ти дней в стационаре больным назначали сульфат магния по 10-20 мл внутривенно капельно. Теоретическим обоснованием применения магния было его свойство конкурировать с ионами кальция как на уровне мембранных каналов, трансмембранного переноса, так и внутри клетки, то есть на уровне внутриклеточных взаимодействий (Верткин А.Л. и соавт., 2003).
С целью предотвращения гибели нейронов ишемической пенумбры, нейтрализации последствий ишемического каскада с первых часов после развития заболевания назначали наиболее изученный из нейропротекторных препаратов — Ноотропил (UCB Pharma, Бельгия) по 6-9 г внутривенно капельно в течение первых 7-10 суток. Препарат обладает комбинированным фармакологическим действием, направленным на сосудистые и клеточные механизмы повреждения ишемизированной ткани мозга. Целесообразность его применения подтверждена многочисленными экспериментальными и клиническими исследованиями (Абрамец И.И. и соавт., 1996; Бурд Г.С. и соавт., 1997; Смеянович А.Ф. и соавт., 1998; Enderby P. et al., 1994; Kessler J. et al., 2000).
Данные Европейского мультицентрового исследования PASS I (Piracetam Acute Stroke Study I) показывают, что применение пирацетама оказывает положительное действие на начальном этапе ишемического каскада и корректирует его последствия (De Deyn P.P. et al., 1997).
На начальных этапах ишемического каскада в анаэробных условиях Ноотропил изменяет путь утилизации глюкозы без увеличения образования молочной кислоты (лактата) за счет активации альтернативных путей продукции энергии (стимуляция пентоз- и гексозфосфатного пути), способствует увеличению экстракции кислорода и поддержанию его метаболического уровня (Heiss W.D. et al., 1988), чем предупреждает развитие необратимых изменений нейронов (инфаркта).
Важное значение для предупреждения развития необратимых изменений нейронов в ишемической полутени в первые 1-6 ч после возникновения инфаркта имеет восстановление адекватной церебральной перфузии. Усиление ее позволяет восстановить нормальное функционирование нервных клеток, а снижение приводит к гибели не только нейронов, но и клеток нейроглии. Поэтому применение Ноотропила оправдано, так как он эффективно влияет на сосудистое звено ишемического каскада: нормализует функцию сосудистого эндотелия, уменьшает адгезию эритроцитов к эндотелию сосудов, улучшает способность их к деформации (Fleischman J.A., 1982; Nalbandian R.M. et al., 1983), препятствует склеиванию эритроцитов (Murayama M., 1979), противодействует агрегации тромбоцитов (Moriau M. et al., 1993), обладает антитромботическими свойствами (Stockmans F. et al., 1998), предотвращает развитие церебрального вазоспазма, не вызывая вазодилятации и снижения АД (Reuse-Blom S., 1979). Указанные эффекты пирацетама улучшают микрогемоциркуляцию и церебральную перфузию ишемизированной ткани мозга.
Препарат также восстанавливает синаптическую передачу нервных импульсов в ткани ишемической полутени за счет увеличения высвобождения и обратного захвата нейромедиаторов пресинаптическими мембранами нейронов и восстановления функции постсинаптических мембран: восстанавливает плотность и стимулирует нейропластичность постсинаптических М-холинорецепторов и NMDA-рецепторов (глутаматэргических) и улучшает их функцию (Pilch H., Muller W.E., 1988; Cohen S.A., Muller W.E., 1993). Доказано также модулирующее влияние Ноотропила на аминоэргические системы: серотонинэргическую, дофаминэргическую, норадренэргическую и глутаминэргическую (Muller W.E. et al., 1994), тела нейронов которых находятся в разных отделах головного мозга.
Фармакологические эффекты Ноотропила корректируют также последствия ишемического каскада: восстановление пластичности и естественного функционирования энергозависимых клеточных мембран, ускорение конверсии аденозиндисфосфата (АДФ) в АТФ (G. Benzi et al., 1985), активация ферментных систем и метаболизма в митохондриях, ингибирующее действие в отношении свободных радикалов, элиминация их, улучшение процессов нейротрансмиссии, в том числе и транскалезной (Muller W.E., 1999).
Таким образом, использование Ноотропила для лечения острого ишемического инсульта в первые 7 ч после его развития позволяет осуществлять два важных и взаимосвязанных направления терапии: нейропротекция — восстановление структуры и функции нейронов, а также связей между ними, профилактика механизмов, ведущих к нейрональной «смерти» в ишемической полутени; сосудистые эффекты (вазоактивные), благодаря которым улучшаются реологические свойства крови, микрогемоциркуляция и церебральная перфузия ишемизированной ткани мозга, уменьшается вероятность развития повторного тромбообразования сосудов.
Результаты исследования PASS I, основанные на лечении 927 больных с острым ишемическим инсультом и применении пирацетама* в первые 7 ч от начала заболевания по 12 г/сутки внутривенно капельно в течение 4 недель, а затем по 4,8 г/сутки перорально в последующие 8 недель подтверждают терапевтическую эффективность препарата: улучшение степени реабилитации, повышение показателей повседневной бытовой активности по шкале Бартеля, полное выздоровление — у 18,8% пациентов (в группе плацебо — у 13,6%) (De Deyn P.P. et al., 1997).
Острые нарушения в ВББ часто сопровождались системным головокружением. У многих пациентов головокружение сочеталось с очаговой неврологической симптоматикой, это подтверждало поражение центральных вестибулярных систем (вестибулярные ядра, их связи) на уровне стволовых структур головного мозга. В отдельных наблюдениях головокружение сочеталось с односторонней глухотой и было следствием закупорки внутренней слуховой (лабиринтной) артерии, так как ее кохлеарная, вестибулярная и кохлеовестибулярная ветви васкуляризируют структуры внутреннего уха: улитковый или спиральный ганглий и структуры базальной мембраны, полукружные каналы и отолитовый аппарат. У 24 пациентов системное головокружение было проявлением вестибулярно-атактического синдрома без нарушения слуха, у 5 — кохлеовестибулярного синдрома.
Известно, что в функционировании центральных вестибулярных структур ствола головного мозга важную роль играет гистаминергическая система. Она обеспечивает передачу импульсации от вестибулярных ядер, а также функциональную связь между вестибулярными ядрами и рвотным центром ствола головного мозга. Основным источником гистаминергической иннервации считают задний гипоталамус (Lacour M. et al., 2000). Гистаминовые рецепторы бывают разного типа: Н1- и Н2-рецепторы являются постсинаптическими, а Н3-рецепторы — пресинаптическими.
Учитывая изложенное, к программе терапии пациентов с острыми ишемическими инфарктом в ВББ с проявлениями вестибуло-атактического и кохлеовестибулярного синдромов мы включали препараты с нейромедиаторными свойствами, которые угнетают спонтанную активность вестибулярных структур. Такими свойствами обладает бетагистина дигидрохлорид (Бетасерк) (Class J. et al., 2000). Он является структурным аналогом гистамина, терапевтические эффекты его реализуются через различные патогенетические механизмы головокружения.
Установлено, что бетагистина дигидрохлорид (Бетасерк изготовления кампании Solvay Pharmacenticals, Голландия) является выраженным антагонистом Н3-рецепторов вестибулярных ядер и нейронов внутреннего уха (Лавров А.Ю., 2001), оказывает слабую агонистическую активность относительно Н1-рецепторов внутреннего уха и вестибулярных ядер, не влияет на Н2-рецепторы.
Таким образом, терапевтический эффект Бетасерка у больных с инфарктом в сосудах ВББ и головокружением базируется на нормализации возбудимости вестибулярных ядер ствола головного мозга путем ингибирования спонтанной и вызванной импульсации от Н3-рецепторов нейронов центральной и периферической вестибулярной систем, т.е. препарат обладает нейромодулирующим действием.
Бетагистина дигидрохлорид (Бетасерк) улучшал также кровообращение в сосудах вертебрально-базилярного и каротидного бассейнов путем опосредованной стимуляции Н1-рецепторов сосудов через Н3-рецепторы. Препарат достоверно увеличивал прирост объемного мозгового кровотока по ВСА на 22,8% и ПА на 18,3% (в группе контроля соответственно на 15,4 и 13,9%), что подтверждает вазоактивный эффект препарата (Віничук С.М., Ілляш Т.І., 2004).
Лечение с использованием Бетасерка в сочетании с базисной терапией ускоряло восстановление неврологических функций у пациентов, достоверно снижало средний балл неврологического дефицита по шкале В. Hoffenberth и соавторов (1990) с 11,86 ± 0,078 до 8,55 ± 0,046 балла (p < 0,001). Динамика среднего балла неврологического дефицита у пациентов, которым не назначали Бетасерк, была менее значимой (с 11,23 ± 0,11 до 9,03 ± 0,05 балла; p < 0,05).
Исход лакунарных и нелакунарных инфарктов в ВББ на госпитальном этапе и через один месяц после лечения приведен в табл. 2.
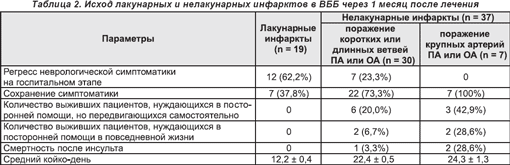
Как видно из приведенных данных, наиболее благоприятный исход наблюдался у больных с лакунарными инфарктами: регресс неврологической симптоматики на госпитальном этапе наступил у 62,2% обследованных, лишь у 7 пациентов (37,8%) сохранялась незначительная неврологическая симптоматика, которая не влияла на повседневную бытовую активность (1 балл по шкале Рэнкина). В случаях инфарктов, обусловленных поражением коротких или длинных ветвей ПА или ОА, регресс неврологического дефицита на госпитальном этапе наступил лишь у 7 (23,3%) пациентов, различная неврологическая симптоматика сохранялась у 73,3% обследованных. При обширных инфарктах в ВББ вследствие окклюзии крупных артерий ПА или ОА неврологические расстройства сохранялись за весь период наблюдения в стационаре.
Естественно, в группе лакунарных инфарктов не было пациентов, нуждающихся в посторонней помощи в повседневной жизни. В то же время в группе выживших с нелакунарными инфарктами в ВББ вследствие поражения коротких или длинных ветвей ПА или ОА, сочетанных с ишемической болезнью сердца. Нуждались в посторонней помощи, но передвигались самостоятельно 20,0% пациентов, нуждались в посторонней помощи в повседневной жизни 6,7% перенесших инсульт. Более печальная статистика наблюдалась при инфарктах в ВББ, обусловленных поражением крупных артерий ПА или ОА: нуждались в посторонней помощи, но передвигались самостоятельно 42,9% пациентов, еще 28,6% нуждались в посторонней помощи в повседневной жизни.
Неодинаковой была смертность после инсульта нелакунарных инфарктов в ВББ: в случаях инфарктов вследствие поражения коротких или длинных ветвей ПА или ОА — 3,3%, при поражении крупных артерий ПА или ОА — 28,6%.
Средний койко-день у больных с лакунарными инфарктами в ВББ составлял 12,2 ± 0,4 дня, у пациентов с нелакунарными инфарктами — соответственно 22,4 ± 0,5 и 24,3 ± 1,3 дня.
* — Исследование PASS I проводилось с использованием препарата Ноотропил (UCB Pharma, Бельгия) ↑
1. Абрамец И.И., Комиссаров И.В., Самайлович И.М. Синаптические эффекты ноотропов: механизмы вовлечения глутаматных рецепторов // Арх. клинической и эксперим. медицины. — 1996. — Т. 5, №1. — С. 73-79.
2. Бурд Г.С., Гехт А.Б, Боголепова А.Н., Буклина С.Б. Ноотропил в лечении нарушений высших психических функций у больных с ишемическим инсультом // Невропатол. и псизиатрии им. С.С. Корсакова. — 1997. — Т. 97, №10. — С. 29-34.
3. Верткин А.Л., Талибов О.Б., Измайлов А.И. Магний и лечение инсульта // Лечащий врач. — 2003. — №4. — С. 1-4.
4. Віничук С.М., Ілляш Т.І. Ефективність препарату Бетасерк у лікуванні хворих із гострими ішемічними порушеннями мозкового кровообігу в судинах вертебрально-базилярного басейну // Укр. мед. часопис. — 2004. — №6 (44). — С. 32-37.
5. Віничук С.М., Мельник В.С., Маргітич В.М. Стресова гіперглікемія після гострого ішемічного інсульту та її корекція з використанням людського рекомбінантного інсуліну короткої дії — Фармасуліну Н // Укр. мед. часопис. — 2004. — №1(99). — С. 75-83.
6. Евтушенко С.К. Ишемические (кардиогенные и гетерогенные) инфаркты мозга, или Актуальные вопросы кардионеврологии. Учебное пособие. — Донецк: Радянська Донеччина, 1998. — 56 с.
7. Лавров А.Ю. Применение бетасерка в неврологической практике // Невр. журн. — 2001. — №2. — С.35-38.
8. Смеянович А.Ф., Шанько Ю.Т., Антинев И.П. и соавт. Лечение ноотропилом ишемических поражений головного мозга // Здравохранение (МЗ Респ. Беларусь). — 1998. — №6. — С. 64-66.
9. Benzi G., Pastoris O., Villa R.F., Gruffrida A.M. Influence of aging and exogenous substances on cerebral energy metabolism in post hypoglycemic recovery // Biochemical Pharmacology. — 1985. — Vol. 34. — P. 1477-1483.
10. Class J., Van De Heyning P.H. A revier of medical treatment for Meniere's discase // Acta Otolaryngol. — 2000. — Suppl. 544. — P. 34-39.
11. Cohen S.A., Muller W.E. Effects of piracetam on N-methyl-D-aspartate receptor properties in the aged mouse brain // Pharmacology. — 1993. — Vol. 47. — P. 217-222.
12. De Deyn P.P., Reuck L.D., Deberdt W. Treatment of acute ischemic stroke with piracetam members of the piracetam in Acute Study (PASS) Group // Stroke. — 1997. — Vol. 28, №12. — P. 2347-2352.
13. Enderby P., Broeckx J., Hospers W. et al. Effect of Piracetam on Recovery and Rehabilitation after Stroke: A Double-Blind, Placebo-Controlled Study // Clin. Neuropharmacology. — 1994. — Vol. 17, №4. — P. 320-331.
14. Fleischman J.A. Piracetam's effect on sickle and diabetic erythrocytes as demonstrated in enucleated human eye trabecular meshwork filterability studies: clinical implications. 10 th International Symposium on Nootropic Agents, Paris, October 13, 1982. — P. 61-67.
15. Hacke W., Kaste M., Bogonsslavsky J. et al. European Stroke Iniciative (EUSI) Recomendations for Stroke mangement — update 2003 // Cerebrovasc. Dis. — 2003. — Vol.16, №4. — P. 311-337.
16. Heiss W.D., Hebold I., Klinkhammer P. Effect of piracetam on cerebral glucose metabolism in Alzheimer's disease measured by positron emission tomography // J. Cereb. Blood Flow Metab. — 1988. — №8. — P. 613-617.
17. Kessler J., Thieb A., Karbe H., Heiss W.D. Pyracetam impoves activated bload flow and facilitates rehabilitation of poststroke aphasic patients // Stoke. — 2000. — V.31, №9. — P. 2112-2116.
18. Lacour M., Tighilet B. Vestibular compensation in the cat the role of the histaminergic system // Acta Otolaryngol. — 2000. — Suppl. 544. — P. 15-18.
19. Moriau M., Crasborn L., Lavenne-Pardonge E., Von Frenckell R., Col-Debeys C. Platelet anti-aggregant and rheo-logical properties of piracetam // Arzneimittel-Forschung (Drug Research). — 1993. — Vol. 43. — P. 110-118.
20. Muller W.E., Hartmann H., Koch S., Scheuer K., Stoll S. Neurotransmission in aging — therapeutic aspects. In: Racagni G., Brunello N., Langer S.J. (eds). Recent advances in the treatment of neurodegenerative disorders and cognitive dysfunction. Int Acad Biomed. Drug. Res., Basel, Karger. — 1994. — №7. — P. 166-173.
21. Murayama M. Biochemical and physico-chemical alterations produced by piracetam on (sickle cell) blood. International Symposium on Nootropic Drugs, Rio de Janeiro, October, 1979. — P. 205-210.
22. Nalbandian R.M, Henry R.L., Burek C.L. et al. Diminished adherence of sickle erythrocytes to cultured vascular endothelium by piracetam // American Journal of Hematology. — 1983. — Vol. 15. — P. 147-151.
23. Pernerstorfer T., Hollensfein V., Hansen J. et al. Heparin blunts endotoxin — induced coagulation activation // Circulatian. — 1999. — Vol. 100, №25. — P. 2485-2490.
24. Pilch H., Muller W.E. Piracetam elevates muscarinic cholinergic receptor density in the frontal cortex of aged but not of young mice // Psychopharmacology. — 1988. — Vol. 94. — P.74-78.
25. Reuse-Blom S., Microcirculation of the pial vessels in the rabbit // Acta Cardiologia. — 1979. — Vol. 34. — P. 35-36.
26. Stockmans F., Deberdt W., Nystrom A. et al. Inhibitory effect of piracetam on platelet rich thrombus formetion in an animal model // Thromb Haemostasis. — 1998. — Vol. 79. — P. 222-227.
