Международный неврологический журнал 3 (65) 2014
Вернуться к номеру
Особливості системи гемостазу в гострому періоді первинного ішемічного інсульту
Авторы: Кульматицький А.В. - Львівський національний медичний університет імені Данила Галицького, кафедра невропатології та нейрохірургії ФПДО
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Наведені результати комплексного лабораторного дослідження системи гемостазу 100 пацієнтів у гострому періоді первинного ішемічного інсульту. Установлено, що у хворих з первинним ішемічним інсультом в гострому періоді наявна активація судинно-тромбоцитарного гемостазу, що супроводжується зниженням рівня тромбоцитів, підвищеним ступенем їх агрегації та зростанням активності фактора Віллебранда. Виявлено, що гострий період первинного ішемічного інсульту перебігає з превалюванням процесів гіперкоагуляції та посиленого фібриноутворення на тлі дефіциту природних антикоагулянтів та посиленого фібринолізу.
Приведены результаты комплексного лабораторного исследования системы гемостаза 100 пациентов в остром периоде первичного ишемического инсульта. Установлено, что у больных с первичным ишемическим инсультом в остром периоде имеется активация сосудисто-тромбоцитарного гемостаза, которая сопровождается снижением уровня тромбоцитов, повышенной степенью их агрегации и ростом активности фактора Виллебранда. Выявлено, что острый период первичного ишемического инсульта протекал с превалированием процессов гиперкоагуляции и усиленного фибринообразования на фоне дефицита естественных антикоагулянтов и усиленного фибринолиза.
The results of complex laboratory study of hemostasis system in 100 patients in the acute period of primary ischemic stroke are presented. It was established that in patients in the acute period of primary ischemic stroke there was an activation of vascular-platelet hemostasis, which was accompanied by a reduction in platelet count, increased degree of aggregation and growth activity of von Willebrand factor. We found that the primary acute period of ischemic stroke proceeded with the prevalence of hypercoagulability processes and enhanced fibrin formation with the deficit of natural anticoagulants and enhanced fibrinolysis.
первинний ішемічний інсульт, система гемостазу.
первичный ишемический инсульт, система гемостаза.
primary ischemic stroke, hemostasis system.
Статья опубликована на с. 28-32
Актуальність проблеми
Серцево-судинні та, зокрема, цереброваскулярні захворювання посідають одне з перших місць за поширеністю, смертністю і частотою інвалідизації в Україні та світі [4]. Цереброваскулярна патологія як одна з основних причин смертності залишається найбільш актуальною проблемою сучасної неврології. За даними численних епідеміологічних досліджень останніх років, смертність від інсультів та інфарктів міокарда в усьому світі залишається високою, а в ряді країн Центральної та Східної Європи ці показники погіршуються [3]. Кожні 5 хвилин в однієї людини в нашій країні розвивається інсульт і кожні 12 хвилин один із хворих помирає від інсульту; 30–40 % пацієнтів з інсультом в Україні вмирають упродовж 1-го місяця і близько половини — упродовж 1-го року [6, 15].
Основою патогенетичних ознак судинних захворювань головного мозку є порушення взаємовідношення різних компонентів, що впливають на систему мікроциркуляторного гемостазу, які знаходяться в судинній стінці та тромбоцитах [7].
Система гемостазу — постійно функціонуюча багатокомпонентна система, у якій підтримуються в динамічній рівновазі процеси активації та інгібіції як на клітинному (судинно-тромбоцитарному), так і ферментному (згортання крові, фібриноліз) рівні [5].
Вогнища розпаду тканини мозку в результаті ішемії є джерелом надходження в кров тканинного фактора та інших активних речовин, що володіють прокоагулянтними властивостями. Все це призводить до прогресивного наростання коагулопатичного потенціалу крові, стійкої гіперкоагуляції, що неминуче веде до порушення балансу гемостазу, зриву протизгортальних механізмів [12]. Локальна і генералізована гіперкоагуляція, пошкодження церебральних структур, що беруть участь у регуляції гемостазу, сприяють поглибленню порушень згортання крові, що вже виникли і, відповідно, тягнуть за собою зміни в системі природних антикоагулянтів та фібринолізу [5].
Мета дослідження — вивчити особливості системи гемостазу в гострому періоді первинного ішемічного інсульту.
Матеріал та методи дослідження
Проведено комплексне клініко-інструментальне та лабораторне обстеження 100 хворих із первинним ішемічним інсультом (ПнІІ) віком від 36 до 80 років (середній вік яких становив 61,66 ± 12,21 року), з них — 56 чоловіків та 44 жінки, які перебували на стаціонарному лікуванні у 2-му неврологічному відділенні комунальної міської клінічної лікарні швидкої медичної допомоги м. Львова (КМКЛ ШМД).
Першу контрольну групу (КГ І) становили 43 практично здорові особи, з них 20 чоловіків та 23 жінки, віком від 38 до 74 років (середній вік — 59,95 ± 9,55 року). З метою порівняння додатково була обстежена друга контрольна група (КГ ІІ) із 39 хворих на гіпертонічну хворобу в поєднанні з церебральним атеросклерозом без церебральних ускладнень, з них 20 чоловіків та 19 жінок віком від 36 до 79 років (середній вік — 60,00 ± 10,32 року), які перебували на стаціонарному лікуванні в кардіологічному відділенні КМКЛ ШМД м. Львова.
Діагноз мозкового ішемічного інсульту (МІІ) встановлювали відповідно до критеріїв ВООЗ (симптоми фокальної та/або глобальної втрати церебральних функцій, що швидко розвиваються із симптоматикою, яка триває понад 24 години або призводить до смерті без явних інших причин) та результатів комп’ютерно-томографічних методів дослідження.
Хворі з ГПМК були обстежені у динаміці гострого періоду МІІ: на 1-шу — 3-тю, 7-му — 10-ту та 18-ту — 21-шу добу від початку захворювання. Відбір хворих із МІІ проводився в групи у випадковому порядку, давністю на момент огляду не більше 72 годин після виникнення неврологічної симптоматики.
Забір крові для дослідження проводився з ліктьової вени натщесерце.
У плазмі крові хворих визначали такі показники системи гемостазу: вміст тромбоцитів крові (ТР) фазово-контрастним методом; індукована агрегація тромбоцитів (іАТР) за допомогою набору «Агрескрин-тест» («Технологія-Стандарт», Росія), фактор Віллебранда (vWF) методом твердофазового імуноферментного аналізу (ELISA) з використанням тест-наборів фірми Biosurse (США); протромбіновий час (ПЧ) за A. Quike з розрахунком міжнародного нормалізованого відношення (МНВ); активований частковий тромбопластиновий час (АЧТЧ) за Caen і співавт.; тромбіновий час (ТЧ) за Biggs, Macforlane з розрахунком тромбінового індексу (ТІ), вміст фібриногену (ФГ) за Clauss; розчинні фібрин–мономерні комплекси (РФМК) — о-фенантроліновим методом; антитромбін ІІІ (АТ-ІІІ) за Hensen, Loeliger у модифікації К.М. Бишевського; активність системи протеїну С (ПС) тест-набором «Парус-тест» («Технологія-Стандарт», Росія), спонтанний еуглобуліновий лізис (ЕЛ) визначали тест-наборами фірми Simko Ltd. Для отримання безтромбоцитарної плазми кров змішували з цитратом натрію у співвідношенні 9 : 1 та центрифугували зі швидкістю 3000 g протягом 15 хв.
Статистичну обробку результатів дослідження проводили з використанням пакета програм Statistica for Windows 6.0 (2006) та критерію Стьюдента, критерію Стьюдента для множинних порівнянь та зв’язаних пар. Різницю показників вважали вірогідною при р < 0,05.
Результати та їх обговорення
У численних роботах підкреслюється, що ішемічні порушення мозкового кровообігу, незважаючи на їх поліморфізм, виникають в умовах односпрямованих змін активації системи гемостазу [14]. Відомо, що провідний механізм реалізації ішемічного інсульту взаємопов’язаний з гемостатичним профілем [16].
Результати численних досліджень гемостазу та гемореології при ішемічних інсультах неоднозначні [14].
Проведене нами дослідження виявило суттєві зміни основних показників системи гемостазу, що супроводжували перебіг усього гострого періоду ПнІІ.
У патогенезі ішемії головного мозку важливу роль відіграє порушення судинно-тромбоцитарної ланки системи гемостазу [9].
Як видно з табл. 1, у пацієнтів КГ ІІ були вірогідно вищі показники ТР, іАТР та активність vWF порівняно з КГ І.
У хворих з ПнІІ кількість ТР у крові на 1-шу — 3-тю добу від початку захворювання була істотно нижчою як порівняно з КГ І, так і з КГ ІІ. Аналогічні зміни спостерігались і на 7-му — 10-ту добу, проте кількість ТР у цих хворих вірогідно збільшилась. На 18-ту — 21-шу добу відмічено подальше вірогідне збільшення кількості ТР, що досягло контрольних значень.
Ступінь іАТР при ПнІІ з 1–3-ї доби залишався вірогідно вищим, ніж у КГ І та КГ ІІ, до кінця гострого періоду. Наростання іАТР у цих хворих спостерігалось на 7-му — 10-ту добу, значення якого не відрізнялось від показників 18–21-ї доби.
Активність vWF у хворих із ПнІІ протягом усього гострого періоду перевищувала значення обох контрольних груп, проте вірогідної динаміки даного показника в цій групі не виявлено.
Таким чином, у хворих КГ ІІ та ПнІІ спостерігалось підвищення ступеня іАТР та активності vWF. Активація тромбоцитів, будучи сполучною ланкою між дією факторів ризику розвитку цереброваскулярних захворювань та тромботичним ушкодженням судинного ендотелію, супроводжується зміною реологічних властивостей крові та співвідношення кількості формених елементів крові і плазми, порушенням ангіогемічних взаємодій та мікроемболією дрібних гілок судинного басейну [9]. Тромбоцити відіграють особливу роль як у розвитку, так і в перебігу інсульту, оскільки їх активація тягне за собою викид потужного проагреганта — тромбоксану А2, а також зв’язування білкових комплексів з глікопротеїдними рецепторами IIb/IIIa мембрани тромбоцитів [2].
Виявлене нами зниження вмісту тромбоцитів у хворих із ПнІІ на початку захворювання з поступовим відновленням їх кількості на 18-ту — 21-шу добу до рівня КГ І та КГ ІІ може бути як одним із факторів виникнення інсульту (участь тромбоцитів у процесах тромбогенезу і атеротромбозу [17]), так і його наслідком (активація адгезії та агрегації тромбоцитів у вогнищі ішемії внаслідок ураження ендотелію [8].
В останні роки доведене існування функціонального взаємозв’язку між тромбоцитами і ендотелієм, між клітинним та судинним компонентами гемостазу. Біологічно активні речовини, що виділяються при пошкодженні ендотелію, можуть індукувати агрегацію тромбоцитів. У свою чергу, речовини, що виділяються тромбоцитами, здатні не тільки лавиноподібно прискорювати подальшу агрегацію тромбоцитів, але й можуть також посилювати пошкодження ендотелію [14]. Загальновизнаним маркером ендотеліальної дисфункції є vWF [10]. Як свідчать результати наших досліджень, в гострому періоді ПнІІ стабільно високі значення vWF порівняно з КГ І та КГ ІІ сприяють посиленій внутрішньосудинній агрегації тромбоцитів, оскільки даний білок синтезується ендотелієм у відповідь на його пошкодження або активацію тромбіном та ініціює початок тромбоутворення [14].
У хворих із ПнІІ виявлено високі значення іАТР, що на 7-му — 10-ту добу наросла та протягом усього гострого періоду продовжувала перевищувати відповідні значення КГ І і КГ ІІ. Такі зміни відбувались при паралельному збільшенні в крові активованих тромбоцитів, що призвело до наростання кількості тромбоцитарних агрегатів.
Одночасно з судинно-тромбоцитарним гемостазом включається і плазмовий гемостаз за рахунок активації факторів згортання крові, адсорбованих на поверхні тромбоцитів [10]. Оскільки невеликі кількості тромбіну можуть активувати тромбоцити, коагуляційна система більше, ніж тромбоцити, може викликати глибокі і різноспрямовані зсуви в системі гемостазу, сприяючи гемостатичній активації, що супроводжує інсульт [5].
Як видно з табл. 2, у пацієнтів КГ ІІ порівняно з КГ І виявлено вірогідно вищі значення МНВ, ФГ, РФМК та подовження АЧТЧ.
У хворих з ПнІІ на 1-шу — 3-тю добу спостерігались вірогідно нижчі значення МНВ та АЧТЧ порівняно з КГ І та КГ ІІ. На 7-му — 10-ту добу показники МНВ і АЧТЧ істотно знизились і надалі залишались нижчими від КГ І і КГ ІІ. На 18-ту — 21-шу добу МНВ вірогідно зросло і не відрізнялось від значень КГ І, залишаючись нижчим від значень КГ ІІ, а АЧТЧ вірогідно зріс до значень КГ ІІ і залишався вищим від значень КГ І.
У хворих з ПнІІ на 1-шу — 3-тю та 7-му — 10-ту добу спостерігався вірогідно вищий рівень ФГ та РФМК порівняно з КГ І і КГ ІІ, причому вміст РФМК на 7-му — 10-ту добу істотно збільшився. На 18-ту — 21-шу добу рівні ФГ та РФМК вірогідно знизились порівняно з 1–3-ю та 7–10-ю добою, залишаючись вірогідно вищими від значень КГ І і КГ ІІ.
Фібриноген — це основний маркер коагуляційної системи, що є важливою детермінантою реологічних властивостей крові та відіграє мультифункціональну роль у гемостатичних і тромботичних механізмах [14]. Поява у плазмі крові розчинного фібрину є також одним з основних показників стану гіперкоагуляції, оскільки РФМК — це олігомерні комплекси фібрину з фібриногеном та продуктами деградації фібрину/фібриногену. Накопичення РФМК свідчить не тільки про активацію системи згортання крові, але й про порушення динамічної рівноваги між функціонуванням системи згортання крові та фібринолізом [13].
Активація гемостазу в гострому періоді ПнІІ супроводжувалась змінами й в антикоагулянтній ланці, що проявлялись зниженням концентрації природних антикоагулянтів (АТ-ІІІ та ПС), основна функція яких полягає в інгібіції активних факторів згортання крові.
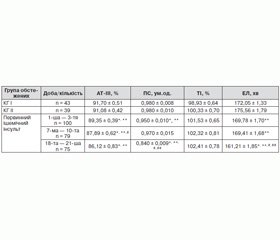
Як видно з табл. 3, у пацієнтів КГ ІІ не виявлено вірогідних відмінностей у показниках системи антикоагулянтів та фібринолізу порівняно з КГ І. У хворих з ПнІІ на 1-шу — 3-тю добу спостерігався вірогідно нижчий рівень АТ-ІІІ та ПС порівняно з КГ І і КГ ІІ, що може свідчити про посилене споживання антикоагулянтів в умовах активації коагуляції. На 7-му — 10-ту добу показник АТ-ІІІ істотно знизився і залишався нижчим від КГ І, КГ ІІ та 1–3-ї доби до кінця гострого періоду. Показник ПС на 7-му — 10-ту добу невірогідно зріс та не відрізнявся від значень КГ І і КГ ІІ. На 18-ту — 21-шу добу рівень ПС різко знизився порівняно з КГ І, КГ ІІ, 1–3-ї та 7–10-ї діб.
У хворих із ПнІІ не виявлено вірогідних змін у значеннях ТІ як з контролем, так і в динаміці усього гострого періоду.
Одним із ключових моментів, що визначають ризик розвитку тромбозу, є стан фібринолітичної системи крові. Фібринолітична система відіграє важливу роль не лише в обмеженні росту фібринового тромбу, але й у забезпеченні утилізації тромботичних мас із судинного русла після того, як тромб виконав свою гемостатичну функцію [1].
У хворих з ПнІІ на 1-шу — 3-тю та 7-му — 10-ту добу спостерігався вірогідно коротший час ЕЛ лише порівняно з КГ ІІ, а з КГ І вірогідної різниці не відмічалось. Час ЕЛ на 18-ту — 21-шу добу істотно вкоротився й вірогідно відрізнявся від значень контролю, 1–3-ї та 7–10-ї діб, що свідчить про активацію процесів фібринолізу.
Таким чином, у гострому періоді ПнІІ практично всі показники, що відображають стан коагуляційного гемостазу, змінені в сторону їх погіршення порівняно з аналогічними показниками КГ І та КГ ІІ. Окрім того, отримані нами дані свідчать про те, що в пацієнтів із гіпертонічною хворобою в поєднанні з церебральним атеросклерозом (КГ ІІ) мають місце зміни в судинно-тромбоцитарній та коагуляційній ланках системи гемостазу протромбогенного характеру, що підвищує ризик виникнення серцево-судинних ускладнень.
Висновки
У хворих із первинним ішемічним інсультом у гострому періоді виявлена активація судинно-тромбоцитарного гемостазу, що супроводжувалась зниженням рівня тромбоцитів, підвищеним ступенем їх агрегації та зростанням активності фактора Віллебранда.
Гострий період первинного ішемічного інсульту перебігав із превалюванням процесів гіперкоагуляції та посиленого фібриноутворення, на що вказує високий рівень фібриногену та РФМК, які є маркером як ступеня тромбінемії, так і активації внутрішньосудинного згортання крові, на фоні дефіциту природних антикоагулянтів та посиленого фібринолізу.
1. Баркаган З.С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза. — М.: Ньюдиамед, 2001. — 296 с.
2. Грицай Н.Н. Коагулопатии при острой цереброваскулярной патологии // Здоров’я України. — 2008. — № 7. — С. 20.
3. Евтушенко С.К., Филимонов Д.А., Симонян В.А., Луцкий И.С., Шестова Е.П., Морозова Т.М. Основные и новые факторы риска, способствующие развитию ишемических инсультов у лиц молодого возраста // Международный неврологический журнал. — 2013. — № 6(60). — С. 92–114.
4. Зозуля І.С., Цимбалюк В.І., Зозуля А.І. Інсульт: стратегія і тактика надання медичної допомоги // Український медичний часопис. — 2012. — № 5. — С. 36–39.
5. Кистенев Б.А., Максимова М.Ю., Лагутин А.В. Ишемический инсульт у больного, страдающего железодефицитной анемией // Атмосфера. Нервные болезни. — 2007. — № 2. — С. 27–31.
6. Колотилов Н.Н. Инсульт: инженерия знаний // Лучевая диагностика, лучевая терапия. — 2011. — № 3. — С. 71–85.
7. Мищенко Т.С. Аспирин в профилактике и лечении ишемических нарушений мозгового кровообращения // Здоров’я України. — 2007. — № 23(1). — С. 34–35.
8. Нетяженко В.З., Мальчевська Т.Й. Тієнопіридини у лікуванні і профілактиці ускладнень атеротромбозу. Оригінальні та генеричні препарати: чому надати перевагу? // Мистецтво лікування. — 2005. — № 1. — С. 64–70.
9. Нечипуренко Н.И., Пашковская И.Д., Мусиенко Ю.И. Основные патофизиологические механизмы ишемии головного мозга // Медицинские новости. — 2008. — № 1. — С. 7–13.
10. Оржешковський В.В., Невмержицька Н.М. Сучасні аспекти фармакотерапії порушень згортальної та протизгортальної систем при ішемічному інсульті // Ліки України. — 2009. — № 3. — С. 47–51.
11. Поливода С.Н., Черепок А.А. Фактор Виллебранда как маркер эндотелиальной дисфункции у пациентов с заболеваниями сердечно–сосудистой системы // Український ревматологічний журнал. — 2000. — № 1. — С. 13–18.
12. Пряникова Н.А., Стаховская Л.В., Скворцова В.И., Ефремова Н.М. Фибринолитическая и антикоагулянтная терапия в остром периоде ишемического инсульта // Consilium Medicum. — 2003. — № 8. — С. 462–465.
13. Савчук О.М., Чернишенко В.О., Краснобрижа Є.М. та ін. Розчинні фібрин-мономерні комплекси — маркери розвитку внутрішньосудинного мікрозсідання крові // Експериментальна та клінічна фізіологія і біохімія. — 2006. — №1. — С. 57–63.
14. Суслина З.А., Танашян М.М., Ионова В.Г. Ишемический инсульт: кровь, сосудистая стенка, антитромботическая терапия. — М.: Медицинская книга, 2005. — 248 с.
15. Чуйко Н.Я. Церебральні судини при ішемічному інсульті у хворих на метаболічний синдром // Морфологія. — 2013. — № 2(7). — С. 79–83.
16. Randomized trail of an oral platelet glycoprotein IIb/IIIa antagonist, Sibrafiban, in patients after an acutecoronary syndrome. Results of the TIMI 12 trail / Cannon Chr.P., McCabe C.H., Borzak S. et al. // Circulation. — 1998. — Vol. 97. — P. 340–349.
17. Associations of inflammatory and hemostatic variables with the risk of recurrent stroke / М. Woodward, G.D. Lowe, D.J. Camрbell et al. // Stroke. — 2005. — Vol. 36. — Р. 2143–2147.

/30/30.jpg)
/31/31.jpg)