Журнал «Медицина неотложных состояний» 5 (60) 2014
Вернуться к номеру
Септична гіперглікемія у дітей та можливості її корекції за допомогою тривалої інфузії 4,2% розчину L-аргініну
Авторы: Георгіянц М.А., Корсунов В.А. - Харківська медична академія післядипломної освіти
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті обговорюються проблеми контролю глікемії при сепсисі у дітей. Наводяться результати власного дослідження впливу тривалої інфузії 4,2% розчину L-аргініну дозою 5 мл/кг/добу на стан спланхнічної та легеневої гемодинаміки. Констатується позитивний вплив запропонованої інфузії без сторонніх ефектів з боку системної гемодинаміки.
В статье обсуждаются проблемы контроля гликемии при сепсисе у детей. Приводятся результаты собственного исследования длительной инфузии 4,2% раствора L-аргинина в дозе 5 мл/кг/сутки на состояние центральной гемодинамики и гликемии. Констатируется позитивное воздействие предложенной инфузии без нежелательных эффектов со стороны системной гемодинамики.
The article discusses the problems of glycemic control in children with sepsis. The results of our own investigation of the effect of prolonged infusion of 4.2% L-arginine solution in a dose of 5 ml/kg/day on state of splanchnic and pulmonary hemodynamics are provided. The positive impact of the proposed infusion without side effects from systemic hemodynamics is stated.
діти, сепсис, глікемія, L-аргінін.
дети, сепсис, гликемия, L-аргинин.
children, sepsis, glycemia, L-arginine.
Статья опубликована на с. 55-57
Одним з перспективних напрямків інтенсивної терапії (ІТ) сепсису та його ускладнень вважається контроль глікемії. Як відомо, сепсис супроводжується вуглеводним гіперметаболізмом та інсулінорезистентністю, які викликають збільшення споживання кисню та гіперлактатемію, апоптоз, ушкодження ендотелію [1, 2]. Зважаючи на це, було запропоновано підтримувати глікемію у межах 4,4–6,1 ммоль/л за допомогою інсулінотерапії, що за окремими спостереженнями сприяло зниженню летальності при септичних станах у дорослих та при несептичних критичних станах у дітей [3–5]. У той же час, на думку інших авторів, менш суворий контроль рівня глікемії при критичних станах у дітей запобігає розвитку гіпоглікемії, не впливає негативно на результати лікування та є більш безпечним [6, 7]. Зростання кількості епізодів гіпоглікемії та негативний вплив жорсткої інсулінотерапії на результати лікування спостерігали у дорослих. Нарешті, за результатами метааналізу 27 досліджень не було знайдено впливу агресивного контролю глікемії на летальність, проте спостерігалась більша ймовірність розвитку гіпоглікемії, а у багатоцентровому дослідженні NICE–SUGAR було продемонстроване збільшення летальності на 2,6 % при використанні жорсткого контролю глікемії порівняно з традиційним [8–10]. З огляду на патогенетичну обґрунтованість контролю глікемії та невдачу інсулінотерапії при сепсисі у дітей викликають інтерес альтернативні методи підтримки глікемії. Одним із них може бути використання L-аргініну, якому властивий певний гіпоглікемічний вплив [11]. З L-аргініну під впливом ізоформ ферменту NO-синтетази (NOS) утворюється NO. Інший шлях утворення NO за анаеробних умов відбувається завдяки відновленню нітратредуктазними системами з NO–2 та NO–3. Ці механізми є взаємопов’язаними компонентами циклу NO: L-аргінін — NO — NO–2/NO–3. — NO [12]. Певною кількістю досліджень встановлено, що септичні стани характеризуються зниженням рівня L-аргініну як у дорослих, так і у дітей, що корелює з тяжкістю стану та вираженістю органної дисфункції. За даними метаналізу 2011 р., вміст L-аргініну сироватки на 41 % нижчий у пацієнтів із сепсисом порівняно з хворими, у яких сепсису немає (р < 0,001). Проте клінічний досвід використання L-аргініну в ІТ дуже обмежений, а у дітей взагалі відсутній. До того ж, попри оптимістичні повідомлення окремих авторів, залишаються певні запитання щодо можливих гемодинамічних реакцій унаслідок інфузії L-аргініну.
Мета. Розробити альтернативний інсулінотерапії метод корекції гіпоглікемії з використанням інфузії L-аргініну та визначити його ефективність у дітей із септичними станами. Дослідити вплив інфузії L-аргініну на показники центральної гемодинаміки при сепсисі у дітей.
Матеріали і методи
Протягом 2006–2010 рр. було проведено дослідження, до якого увійшло 46 дітей віком 24,8 ± 7,1 міс., які знаходилися у відділенні інтенсивної терапії КЗОЗ «Харківська обласна дитяча інфекційна клінічна лікарня». Діагноз «сепсис» встановлювався відповідно до критеріїв консенсусу в Сан-Антоніо (2002 р.). Тяжкість стану оцінювалась за шкалою SOFA. В обстежених пацієнтів було проведене дослідження показників кислотно-основного стану (КОС), вмісту глюкози (аналізатор Gastat-mini, Японія), вмісту лактату крові ензиматичним методом — «Ольвекс диагностикум» (Росія) на біохімічному напівавтоматичному аналізаторі Stat Fax 1904+ (США). Всі показники вивчались до початку ІТ та на 2-гу — 3-тю добу її проведення. Моніторинг включав реєстрацію ЕКГ, середнього артеріального тиску (САТ), частоти серцевих скорочень (ЧСС), частоти дихання (ЧД), пульсоксиметрію (монітори UM-300). До початку лікування та за 24–48 год всім хворим проводилась ехокардіоскопія в М-режимі сканером Ultima PA (Україна) з розрахунком показників серцевого викиду за L. Teichholz et al. (1976). Хворі досліджуваної групи (n = 25) додатково до етіотропної та ціль-орієнтованої ІТ отримували внутрішньовенну інфузію 4,2% розчину аргініну гідрохлориду дозою 5 мл/кг/добу зі швидкістю 0,2 мл/кг/год за допомогою інфузомату протягом 1–2 діб. Хворі основної групи (n =21) отримували аналогічну етіотропну та ціль-орієнтовану ІТ за виключенням L-аргініну. Вірогідність відмінностей між показниками визначалась за допомогою критерію t (Стьюдента).
Результати та їх обговорення
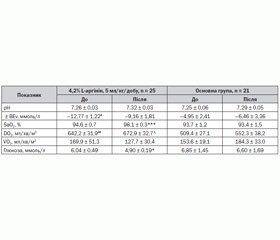
Досліджувані групи за віком та антропометричними характеристиками не мали вірогідних відмінностей (p > 0,05) (табл. 1).
Обстежені хворі характеризувались наявністю клініко-лабораторних ознак системної запальної відповіді у вигляді лейкоцитозу, омолодження лейкоцитарної формули, підвищення температури тіла, підвищенням лактату. Вірогідних відмінностей за цими показниками, потребою у ШВЛ та балом за SOFA не було (p > 0,05). В основній групі 8 (38 ± 11 %) хворих отримували інотропну підтримку добутаміном та 5 (24 ± 10 %) — допаміном. У групі, яка отримувала інфузію L-аргініну, інотропна підтримка добутаміном здійснювалась у 7 (28 ± 9 %) пацієнтів, допаміном — у 4 (16 ± 9 %) пацієнтів, дози препаратів в групах не відрізнялись (табл. 1).
Застосування L-аргініну дозою 5 мл/кг/добу не супроводжувалось підсиленням метаболічного ацидозу. Навпаки, якщо до початку ІТ дефіцит ВЕ у групі L-аргініну був вірогідно більшим, ніж в основній групі (p < 0,05), на 2-гу — 3-тю добу лікування вірогідні відмінності цього показника між групами не визначалися. Сатурація артеріальної крові до початку лікування між досліджуваними групами вірогідно не відрізнялась (p > 0,05), проте вірогідно зростала у групі L-аргініну (р < 0,05) і на 2-гу — 3-тю добу перевищувала сатурацію в основній групі (p < 0,001). Доставка кисню у групі L-аргініну була вірогідно більшою, ніж в основній групі на всіх етапах ІТ, проте слід зауважити цікавий факт — тенденцію до зниження споживання кисню в групі L-аргініну та збільшення в основній групі. Це відбувалось на тлі зниження глікемії у групі L-аргініну з 6,04 ± 0,49 ммоль/л до 4,90 ± 0,19 ммоль/л (p < 0,05). Гіпоглікемії в жодного пацієнта не спостерігалось. В основній групі вірогідних змін рівня глікемії не відбувалось (p > 0,05). Натомість зберігалась гіперглікемія 6,60 ± 1,69 ммоль/л (норма 3,3–5,5 ммоль/л) (табл. 2).
Отже, тенденція до зниження споживання кисню на тлі зменшення гіперглікемії може бути поясненою саме зменшенням вуглеводного гіперметаболізму та розцінюватися як позитивна перебудова метаболічних процесів, зумовлена застосуванням L-аргініну.
Досліджені показники центральної та периферичної гемодинаміки не зазнавали вірогідних змін та не відрізнялись між групами (p > 0,05) (табл. 3).
Таким чином, інфузія 4,2% розчину L-аргініну дозою 5 мл/кг/добу не викликала негативного впливу на стан системної гемодинаміки у великому колі кровообігу (p > 0,05).
Висновки
1. Застосування L-аргініну при сепсисі у дітей сприяло нормалізації глікемії без розвитку гіпоглікемії.
2. Застосування L-аргініну не впливало негативно на стан КОС.
3. Показники центральної гемодинаміки під впливом інфузії L-аргініну не зазнавали негативних змін та залишалися стабільними.
1. Gore D.C. Lactic acidosis during sepsis is related to increased pyruvate production, not deficitis in tissue oxygen availability / D.C. Gore, F. Jahoor, J.M. Hibbert et al. // Ann. Surg. — 1996. — Vol. 224. — P. 225–229.
2. Marik P.E. Stress-hyperglycemia, insulin and immunomodulation in sepsis / P.E. Marik, M. Raghavan // Intensive Care Med. — 2004. — Vol. 30. — P. 748–756.
3. Van den Berghe G. How does blood glucose control with insulin save lives in intensive care / G. Van den Berghe // J. Clin. Invest. — 2004. — Vol. 114. — P. 1187–1195.
4. Hotchkiss R.S. The pathophysiology and treatment of sepsis / R.S. Hotchkiss, I.E. Karl // N. Engl. J. Med. — 2003. — Vol. 348. — P. 138–150.
5. Intensive insulin therapy for patientes in paediatric intensive care: a prospective, randomised controlled study / D. Vlasselaers, I. Milants, L. Desmet et al. // Lancet. — 2009. — Vol. 373. — P. 547–556.
6. Александрович Ю.С. Интенсивная терапия инфекционных заболеваний у детей / Ю.С. Александрович, В.И. Гордеев, К.В. Пшениснов. — СПб.: Элби-СПб, 2010. — 320 с.
7. Ulate K.P. Strict glycemic targets need not be so strict: a more permissive glycemic range for critically ill children / K.P. Ulate, G.C.L. Flacao, M.R. Bielefeld et al. // Paediatrics. — 2008. — Vol. 122. — P. 898–904.
8. Wiener R.S. Benefits and risks of tight glucose control in critically ill adaults: a meta-analysis / R.S. Wiener, D.C. Wiener, R.J. Larson // JAMA. — 2008. — Vol. 300. — P. 933–944.
9. The NICE-SUGAR study investigators / Intensive versus conventional glucose control in critically ill patients // N. Engl. J. Med. — 2009. — Vol. 360. — P. 1283–1297.
10. Prabhakar N. Hyperglycemia and insulin therapy in the critically il child / N. Prabhakar, L. Hans, P. Roger et al. // Pediatric Crit. Care Med. — 2009. — Vol. 10. — P. 303–305.
11. Davis J.S. Is plasma arginine concentration decreased in patients with sepsis? A systematic review and meta-analysis / J.S. Davis, N.M. Anstey // Crit. Care Med. — 2011. — Vol. 39. — P. 380–385.
12. Черний В.И. Нарушения иммунитета при критических состояниях. Особенности диагностики / В.И. Черний, А.Н. Нестеренко // Лікарю-практику. — 2007. — № 3. — С. 1–20.
13. Davis J.S. Sepsis-associated microvascular dysfunction measured by peripheral arterial tonometry: an observational study / J.S. Davis, T.W. Yeo, J.H. Thomas et al. // Critical Care. — 2009. — Vol. 13. — R155.
14. Luiking Y.C. Exogenous arginine in sepsis / Y.C. Luiking, N.E.P. Deutz // Crit. Care Med. — 2007. — Vol. 35. — P. 557–563.
15. Argman Z. Arginine and nitric oxide metabolism in critically ill septic pediatric patients / Z. Argman, V.R. Young, N. Noviski et al. // Crit. Care Med. — 2003. — Vol. 31. — P. 591–597.
16. Kao C.C. Arginine, citrulline and nitric oxide metabolism in sepsis / C.C. Kao, V. Bandi, K.K. Guntupalli et al. // Clinical Science. — 2009. — Vol. 117. — P. 23–30.
17. Davis J.S. Is plasma arginine concentration decreased in patients with sepsis? A systematic review and meta-analysis / J.S. Davis, N.M. Anstey // Crit. Care Med. — 2011. — Vol. 39. — P. 380–385.

/56/56.jpg)
/57/57.jpg)