Журнал «Медицина неотложных состояний» 5 (60) 2014
Вернуться к номеру
Динаміка рівня серотоніну при хімічному нейролізисі в пацієнтів із колоректальним раком
Авторы: Щур О.І. - Харківська медична академія післядипломної освіти
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Відомо, що больовий синдром супроводжується утворенням медіаторів болю, серед яких серотонін займає важливе місце. У дослідженні проаналізована інтенсивність больового синдрому в пацієнтів із колоректальним раком залежно від біохімічної відповіді організму на біль. При дослідженні динаміки серотоніну в перед- та післяопераційному періоді ми вивчили залежність інтенсивності больового синдрому від кількісної характеристики медіатора. У післяопераційному періоді були проаналізовані стандартне знеболювання наркотичними анальгетиками в I групі пацієнтів та подовжена епідуральна аналгезія з хімічним нейролізисом у II групі пацієнтів. Було зроблено висновок про ефективність знеболювання на основі розробленої методики епідурального хімічного нейролізису шляхом порівняльного аналізу динаміки рівня серотоніну.
Известно, что болевой синдром сопровождается образованием медиаторов боли, среди которых серотонин занимает важное место. В исследовании проанализирована интенсивность болевого синдрома у пациентов с колоректальным раком в зависимости от биохимического ответа организма на боль. При исследовании динамики серотонина в пред- и послеоперационном периоде мы изучили зависимость интенсивности болевого синдрома от количественной характеристики медиатора. В послеоперационном периоде были проанализированы стандартное обезболивание наркотическими анальгетиками в I группе пациентов и продленная эпидуральная аналгезия с химическим нейролизисом во II группе пациентов. Был сделан вывод об эффективности обезболивания на основе разработанной методики эпидурального химического нейролизиса путем сравнительного анализа динамики уровня серотонина.
It is known that the pain syndrome is accompanied by the formation of the mediators of pain, among which serotonin plays an important role. The study analyzed the severity of pain syndrome in patients with colorectal cancer, depending on the biochemical response of the body to pain. While studying serotonin dynamics in the pre- and postoperative period, we have investigated the dependence of pain syndrome severity on the quantitative characteristics of a mediator. In the postoperative period we have analyzed standard analgesia with narcotic analgesics in group I of patients and continuous epidural analgesia with chemical neurolysis in patients from study group II. It was concluded that the efficiency of analgesia based on the developed technique of epidural chemical neurolysis through a comparative analysis of the dynamics of serotonin levels.
хімічний нейролізис, 30° спирт, серотонін.
химический нейролизис, 30° спирт, серотонин.
chemical neurolysis, 30° alcohol, serotonin.
Статья опубликована на с. 82-85
Вступ
Щороку у світі рак діагностується у близько 6 мільйонів людей і більше як 4 мільйони людей вмирають від цієї хвороби, що становить 10 % від загальної кількості випадків смерті. Показник онкологічної захворюваності в Україні характеризується поступовим зростанням, число вперше виявлених хворих становить 304–308 на 100 тис. населення [6]. Уже при первинному зверненні у 25 % хворих виявляється IV стадія захворювання, що в більшості випадків є причиною відмови таким пацієнтам у спеціалізованій допомозі та переведення їх на симптоматичне лікування. При цьому 40–50 % цих хворих відчувають біль помірної й вираженої інтенсивності за суб’єктивними шкалами оцінки інтенсивності болю, що різко погіршує якість життя. На сьогодні використання методів паліативної медицини та реабілітації онкологічних хворих вносить свої корективи в лікування хронічного больового синдрому в цих хворих. Ця проблема є актуальною для спеціалістів різного профілю.
Серотонін як медіатор болю відіграє важливу роль при хронічному больовому синдромі в пацієнтів онкологічного профілю. Накопичення серотоніну є першою ланкою довгого ланцюга фізіологічних і біохімічних процесів, що породжують біль. Серотонін являє собою похідне амінокислоти триптофану, значна частина серотоніну депонується в тромбоцитах. Під впливом різних активаторів — колагену, тромбіну, АДФ, ФАТ — відбувається секреція серотоніну з тромбоцитів і хромафінних клітин. У помірних концентраціях серотонін викликає розширення артеріол, скорочення міоцитів у стінках венул і венозний застій. У високих концентраціях серотонін обумовлює спазм артеріол. Серотонін викликає почуття болю як безпосередньо, так і посилюючи ноцицептивний ефект брадикініну. За даними деяких авторів [2, 6], динаміку рівня серотоніну можна вивчати як маркер больового синдрому. Тому дослідження динаміки рівня серотоніну, ймовірно, відображає стан больової імпульсації в пацієнтів із колоректальним раком [9, 11].
Задачею дослідження було вивчення інтенсивності больового синдрому у хворих із колоректальним раком залежно від динаміки рівня серотоніну та його лікування методом епідурального хімічного нейролізису.
Матеріали і методи
З метою вирішення поставленої задачі на базі Харківського обласного клінічного онкологічного центру було проведено клінічне дослідження. У ньому брали участь 104 пацієнти. Серед них 44 (41,34 %) чоловіки та 60 (58,65 %) жінок. Середній вік пацієнтів становив 63,3 ± 1,2 року. У всіх пацієнтів при надходженні до стаціонару був хронічний больовий синдром — біль протягом 6 місяців. Наявність колоректального раку III–IV стадії за C.E. Dukes (1956) було визначено гістохімічно. Хворим проведено органозберігаюче оперативне втручання з лімфодисекцією D2-D3. Усі пацієнти були розділені на дві групи дослідження (табл. 1).
Больовий синдром було вивчено перехресним аналізом за візуальною аналоговою шкалою (ВАШ) [2], шкалою якості життя (ШЯЖ) [2] та больовим опитувальником Мак-Гілла [2], на початкових етапах дослідження він був однаковим (табл. 2).
Із даних табл. 2 видно, що больовий синдром на початкових етапах дослідження був однаковим в обох групах, тобто пацієнти були рандомізовані за основними факторами больової агресії.
I (n = 49) — контрольна група, у якій загальне знеболювання включало стандартні етапи та післяопераційне знеболювання відповідно до «Стандартів організації та професійно орієнтованих протоколів надання невідкладної допомоги хворим з хірургічною патологією органів живота та грудної клітки». У ранньому післяопераційному періоді з метою знеболювання в цій групі дослідження вводили наркотичні анальгетики. II (n = 55) — основна група дослідження, у якій схема знеболювання була доповнена епідуральним хімічним нейролізисом. У післяопераційному періоді наркотичні анальгетики з метою знеболювання не застосовувались.
Пацієнтам I (n = 49), контрольної групи з метою аналгезії та анестезії під час операції під внутрішньовенною анестезією з ШВЛ у режимі помірної гіпервентиляції залежно від загального стану, супутньої патології, обсягу операції та показників інтраопераційного моніторингу систем організму вводили барбітурати (розчин тіопенталу натрію 1% 3–5 мг/кг), бензодіазепіни (розчин сібазону 0,5% 0,25–1,55 мг/кг), наркотичні анальгетики (розчин фентанілу 0,005% 0,46–0,86 мкг/кг). Об’єм та швидкість інфузії інтраопераційно становили 5–8 мл/кг/год.
Пацієнтам II (n = 55), основної групи дослідження в операційній після забезпечення центрального венозного доступу під місцевою анестезією проводили пункцію та катетеризацію епідурального простору на рівні Th9-Th10. Для катетеризації епідурального простору використовувалися набори Perifix G18 та 0,5% розчин бупівакаїну. Епідуральний катетер заводили каудально на 4 см. Усім пацієнтам проведене оперативне втручання під комбінованою внутрішньовенною анестезією з ШВЛ у режимі помірної гіпервентиляції та епідуральною анестезією на рівні Th9-Th10. Пацієнтам із метою аналгезії та анестезії під час операції залежно від загального стану, супутньої патології, обсягу операції та показників інтраопераційного моніторингу систем організму вводили барбітурати (розчин тіопенталу натрію 1% 3–5 мг/кг), бензодіазепіни (розчин сибазону 0,5% 0,25–1,55 мг/кг), наркотичні анальгетики (розчин фентанілу 0,005% 0,46–0,52 мкг/кг). Об’єм та швидкість інфузії інтраопераційно становили 5–8 мл/кг/год. В епідуральний катетер вводили 0,5% розчин бупівакаїну 75–150 мг із подальшим інтраопераційним введенням. Тривалість анестезіологічного забезпечення в I групі дослідження становила 124,31 ± 21,22 хв, у II групі — 169,52 ± 12,43 хв. Тривалість оперативного лікування в I групі дослідження становила 98,57 ± 13,14 хв, у II групі — 89,54 ± 11,49 хв.
Рівень серотоніну визначали за допомогою тесту Serotonin ELISA Fast Track діагностичною in vitro імуноферментною (ІФА) тест-системою для кількісного визначення серотоніну в сироватці крові.
Інтенсивність больового синдрому оцінювалась в передопераційному періоді, на 1, 2, 3, 5, 7, 14 та 28-му добу.
У ранньому післяопераційному періоді пацієнтам I (n = 49), контрольної групи з метою аналгезії вводили наркотичні анальгетики в дозі 0,25–0,35 мкг/кг протягом 7 діб.
Пацієнтам II (n = 55), основної групи дослідження протягом першої доби вводився епідурально 0,5% розчин бупівакаїну в дозі 30–40 мг за загальноприйнятою методикою. Визначалася зона аналгезії, тривалість дії анестетика. На другу добу через 30 хвилин після введення 40 мг 0,5% розчину бупівакаїну вводився 30° розчин спирту в об’ємі 4,71 ± 0,29 мл. Протягом наступних 5 діб оцінювався ефект від проведеного хімічного нейролізису. Протягом цих 5 діб в епідуральний простір вводився 0,5% розчин бупівакаїну в дозі 20 мг із різною кратністю залежно від інтенсивності больового синдрому + ревмоксикам 1% 15 мг внутрішньом’язово, на ніч вводився 0,5% розчин бупівакаїну в дозі 30 мг + промедол 2% 10 мг.
Результати досліджень та їх обговорення
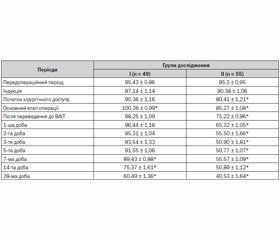
При дослідженні нами була виявлена хвилеподібна динаміка рівня серотоніну (табл. 3).
Під час передопераційного періоду зазначений показник був більшим на 16,37 % (р = 0,00181) у I групі та на 16,21 % (р = 0,00652) у II групі порівняно з даними фізіологічної норми. Це може визначити певну роль серотоніну в розвитку больового синдрому. Під час індукції досліджуваний показник характеризувався зростанням (р = 0,0056) у I групі пацієнтів на 6,26 %, а у II групі — на 10,21 % (р = 0,00637) порівняно з нормальними значеннями. На початку хірургічного доступу ми помітили зростання рівня серотоніну (р = 0,016) у I групі дослідження на 10,52 % порівняно з нормою, тоді як у II групі він був у межах нормальних величин. На основному етапі операції медіатор зберігав негативну тенденцію до зростання в I групі дослідження на 22,39 % (р = 0,000166), а в II групі — лише на 3,98 % (р = 0,00863) порівняно з нормою, що свідчило про ефективне знеболювання в цій групі та його недостатність у I групі. Під час переведення пацієнтів до ВАІТ, незважаючи на використання стандартного методу знеболювання, у I групі дослідження рівень серотоніну зростав (р = 0,00957) на 19,81 % порівняно з фізіологічною нормою, майже не змінюючи динаміку, він залишався на максимальних цифрах упродовж 3 діб. У той час як у II групі пацієнтів зазначений показник залишався в межах фізіологічної норми впродовж всього терміну дослідження до 28-ї доби. Це свідчило про правильну тактику знеболювання у пацієнтів із колоректальним раком III–IV стадії.
На 1-шу добу раннього післяопераційного періоду зберігалось збільшення показника в I групі дослідження на 17,6 % (р = 0,00699) порівняно з нормальними значеннями. На 2-гу добу рівень медіатора болю зростав у I групі на 16,23 % (р = 0,00543) порівняно з фізіологічними величинами. 3-тя доба характеризувалася зростанням досліджуваного показника порівняно з нормальними значеннями в I групі на 14,07 % (р = 0,0098). На 5-ту добу рівень серотоніну зростав на 11,64 % (р = 0,0059) у I групі порівняно з нормою, що підтверджувало наявність больового синдрому в цій групі дослідження, тоді як у II групі серотонін залишався в межах фізіологічних значень ще з етапу переведення пацієнтів до ВАІТ. Подальше зростання рівня серотоніну було зафіксовано на 7-му добу в I групі пацієнтів на 9,06 % (р = 0,00891) порівняно з нормальними значеннями. На 14-ту добу ми відзначили позитивну тенденцію до зниження показника (р = 0,0015) вже й у I групі дослідження, коли рівень серотоніну було зафіксовано в межах нормальних величин, він залишався таким у цій групі на останньому етапі — на 28-му добу.
Починаючи саме з 3-ї доби, коли ефект епідурального хімічного нейролізису визначався певною мірою в II групі дослідження, рівень серотоніну, який нами вивчався, однозначно знаходився в межах фізіологічної норми включно до останнього етапу дослідження. Водночас у I групі, незважаючи на системне використання наркотичних анальгетиків у післяопераційному періоді, рівень серотоніну сягав максимальних значень, позитивна динаміка визначалася лише на 14-ту добу. Крім того, у I групі дослідження зазначений медіатор досягав максимальних значень на основному етапі операції.
Висновок
Наведена вище динаміка медіатора болю серотоніну певною мірою свідчила про позитивний вплив на зниження його рівня в II групі дослідження завдяки використанню епідурального хімічного ней–ролізису для лікування хронічного больового синдрому в пацієнтів із колоректальним раком III–IV стадії. У той час як у I групі медіаторна хвиля рівня серотоніну характеризувалась негативною динамікою до збільшення та зберігалася впродовж 14 діб післяопераційного періоду включно при застосуванні наркотичних анальгетиків.
1. Алексеев В.В. Основные принципы лечения болевых синдромов / В.В. Алексеев // Русский медицинский журнал. — 2011. — № 4. — С. 35-40.
2. Волчков В.А. Болевые синдромы в онкологии и реаниматологии / В.А. Волчков, Ю.Д. Игнатов, В.И. Страшнов. — М., 2006. — 320 с.
3. Исагулян Э. Современные методы лечения хронических болевых синдромов — нейростимуляция / Э. Исагулян, В.А. Шабалов // Боль и ее лечение. — 2010. — № 1.— С. 45-48.
4. Лазебник Л.Б. Хронический болевой синдром: современные подходы к лечению / Л.Б. Лазебник // Здоровье Украины. — 2009. — № 1(1). — С. 18-19.
5. Радчук І.П. Тактика лікування хронічного больового синдрому в онкологічних хворих / І.П. Радчук // Медицина невідкладних станів. — 2008. — № 5 (18). — С. 12-17.
6. Лечение болевого синдрома в онкологии / Под редакцией д.м.н., проф. И.П. Шлапака, д.м.н. Е. Яроша.
7. Листровой М. Терапия хронического болевого синдрома в онкологии методом химического нейролизиса // Здоров’я України. — 2004. — № 23–24. — С. 26-27.
8. Bernatsky S. Comorbidity and physician use in fibromyalgia / S. Bernatsky // Swiss Med. Wkly. — 2009. — № 2. — P. 76-81.
9. Ner J.G. Encapsulation of an intrathecal catheter / J.G Ner, R. Sabatowski // Pain. — 2010 Mar. — Vol. 103, № 1–2. — P. 217-220.
10. Petzke F. Release tramadol for treatment of chronic malignant pain an open multicenter trial / F. Petzke // Support Care Cancer. — 2011. — № 9. — Р. 48–54.
11. Tunks E.R. Epidemiologic Perspective on Chronic Pain Treatment / E.R. Tunks // The Canadian Journal of Psychiatry. — 2008. — № 4. — P. 235-242.

/83/83.jpg)
/84/84.jpg)