Журнал «Медицина неотложных состояний» 5 (60) 2014
Вернуться к номеру
Оценка адекватности анестезиологического обеспечения у пациентов молодого возраста, прооперированных по поводу травм конечностей в условиях различных видов анестезии
Авторы: Богуславская Н.Н. - Харьковская областная клиническая травматологическая больница; Георгиянц М.А. - Харьковская медицинская академия последипломного образования
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье проведено сравнение адекватности различных видов анестезии путем оценки уровня гормонов стресса у молодых пациентов с травмами конечностей при операциях металлоостеосинтеза. Выявлены более выраженные антистрессовые свойства внутривенной анестезии (пропофол, фентанил) в сравнении с проводниковой анестезией.
В статті здійснено порівняння адекватності різних видів анестезії шляхом оцінки рівня гормонів стресу у молодих пацієнтів із травмами кінцівок при операціях металоостеосинтезу. Виявлені більш виражені антистресові властивості внутрішньовенної анестезії (пропофол, фентаніл) порівнянo з провідниковою анестезією.
In the article comparison of adequacy of different types of anesthesia by estimation of stress hormones level is conducted in young patients with the traumas of limbs at the operations of osteosynthesis. More expressed antistress properties of intravenous anesthesia (propofol, fentanyl) are revealed by comparison to regional anesthesia.
травмы конечностей, проводниковая, внутривенная анестезия, маркеры стресса.
травми кінцівок, провідникова, внутрішньовенна анестезія, маркери стресу.
traumas of limbs, regional, intravenous anesthesia, stress markers.
Статья опубликована на с. 86-89
Введение
Проблема хирургического стресса и адекватности анестезии волновала ученых давно. Это направление в анестезиологии особенно развивалось в конце ХХ века, однако является не менее актуальным и в наши дни [1, 3, 4, 7, 11, 12]. В настоящее время в травматологической клинике широко применяются различные виды как региональной, так и общей анестезии [2, 5, 8, 9], однако «нет идеального анестетика или техники для травмированного пациента» [2], и надо стремиться к тому, чтобы найти наиболее эффективные и безопасные.
Любые оперативные вмешательства являются серьезным стрессом для организма больного. По определению А.П. Зильбера (1984), «хирургический стресс — это состояние полифункциональных изменений, возникающих в организме больного под влиянием агрессивных факторов, главными из которых являются: психоэмоциональное напряжение, лечебные и диагностические манипуляции, ожидание операции, страх, депрессия вегетативных функций, боль, патологические рефлексы неболевого характера, постуральные реакции кровообращения, дыхания, кровопотеря и повреждения жизненно важных органов» [6]. Если антистрессовая защита не в силах предотвратить эти изменения, они реализуются в опасных для организма синдромах [10]. Справиться с этой задачей должно помочь рациональное комплексное анестезиологическое пособие.
Нейроэндокринная реакция на хирургическую травму — сложное сочетание гормональных и метаболических изменений [6, 10, 13]. Наиболее информативные нейроэндокринные маркеры стресса — быстрое повышение уровней кортикотропин-рилизинг-фактора, адренокортикотропного гормона и глюкокортикоидов, активизация гипоталамической норадренергической импульсации, увеличивающей образование глюкозы в печени и выброс гипергликемических гормонов: адреналина и глюкагона. Наблюдается также снижение уровней инсулина, медиатором чего является адреналин. Из этих эндокринных изменений проистекает метаболический ответ, включающий повышение плазменных уровней глюкозы и свободных жирных кислот, усиленное потребление кислорода, гликолиз, расщепление белка, гликогенолиз и глюконеогенез [4, 7, 10, 13].
В связи с этим исследование биохимических маркеров стресса и на сегодня остается актуальным, поскольку его результаты являются основой для объективизации адекватности анестезии и выбора метода анестезиологического обеспечения, позволяющего ограничить повреждающее действие хирургического вмешательства.
Цель: сравнение адекватности анестезии путем оценки уровня гормонов стресса у молодых пациентов при операциях металлоостеосинтеза в условиях различных видов анестезии.
Материалы и методы
Исследование выполнено на базе отделения анестезиологии и интенсивной терапии КУЗ «Харьковская областная клиническая травматологическая больница» в течение 2013 года. В исследование вошло 24 пациента в возраcте от 20 до 45 лет, которым были произведены операции металлоостеосинтеза по поводу травм конечностей. Пациенты были распределены на 3 группы: I (n = 7) — оперированные в условиях проводниковой анестезии без седации (средний возраст 33,7 ± 2,1 года), II (n = 9) — проводниковой анестезии с седацией (33,8 ± 1,3 года), III (n = 8) — оперированные в условиях внутривенной анестезии (32,8 ± 1,8 года). Средняя продолжительность оперативного вмешательства составила 94,5 ± 4,9 мин. По полу, антропометрическим данным, характеру травмы, объему и длительности оперативного вмешательства больные в группах не отличались.
Всем больным проводилась премедикация в палате на ночь перед операцией per os (феназепам — 0,002 мг) и на операционном столе внутривенно (атропин — 0,01 мг/кг, димедрол — 0,15 мг/кг, сибазон — 0,15 мг/кг, омнопон — 0,3 мг/кг). В I и II группах проводили блокады нервов с добавлением к раствору 1% лидокаина в качестве адъюванта бупренорфина 1,8 мкг/кг. Во II группе для седации вводили пропофол в дозе 1,8 мг/кг/ч. В III группе проводилась внутривенная анестезия с искусственной вентиляцией легких, индукцию осуществляли тиопенталом натрия в дозе 7,0 ± 0,2 мг/кг в среднем, поддержание сна — пропофолом в дозе 3,9 мг/кг/ч, аналгезия обеспечивалась фентанилом в дозе 7,1 мкг/кг/ч, миорелаксация — ардуаном в дозе 0,05 мг/кг.
Мониторинг включал пульсоксиметрию, контроль частоты сердечных сокращений, среднего артериального давления (монитор UM-300).
Уровень кортизола в сыворотке крови определялся иммуноферментным методом с помощью тест-систем производства «Алькор-Био» (Россия), инсулина — иммуноферментным методом с помощью тест-систем производства DRG International, Inc. (Германия), гликемии — глюкозо-оксидазным методом с помощью тест-систем производства PZ Cormay S.A. (Польша). Индекс НОМА (The Homeostatic Model Assessment), отражающий степень инсулинорезистентности, которая зависит, в свою очередь, от степени стрессорных реакций, рассчитывали по формуле:
НОМА = (глюкоза (ммоль/л)) х инсулин (мкЕД/мл)) / 22,5.
Кортизол-инсулиновое соотношение (K/И) вычисляли по формуле:
K/И = кортизол (нмоль/л) / инсулин (мкЕд/мл).
Забор крови для биохимических исследований проводили на следующих этапах: І — до операции, ІІ — на травматичном этапе, ІІІ — в конце операции, IV — в 1-е послеоперационные сутки.
В периоперационном периоде инфузия глюкозы не проводилась.
Все данные представлены в виде количества наблюдений (n), средней арифметической (М), стандартной ошибки средней (m). Статистическую обработку полученных данных проводили в программе Microsoft Excel. Для оценки достоверности отличий использовали значения t-критерия Стьюдента, T-критерия Вилкоксона. Отличия считались достоверными при р < 0,05.
Результаты
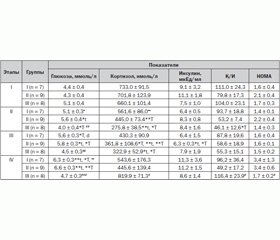
Исходная концентрация маркеров стресса до операции у пациентов всех групп достоверно не отличалась, однако следует указать, что отмечалась тенденция роста кортизола, но достоверных отличий по сравнению с показателями нормы не выявлено (до 8:00 часов 394 ± 256 нмоль/л) (табл. 1).
На травматичном этапе операции во всех группах уровень глюкозы не превышал значения нормы, однако во II группе уровень глюкозы достоверно повысился с 4,3 ± 0,4 ммоль/л до 5,6 ± 0,4 ммоль/л (р < 0,05), а в III — достоверно снизился с 5,1 ± 0,4 ммоль/л до 4,0 ± 0,4 ммоль/л (р < 0,05) по сравнению с дооперационным уровнем. При этом уровень глюкозы в I группе был достоверно выше по сравнению с III группой (р < 0,05), а также достоверно выше во II группе по сравнению с III группой (р < 0,01) на травматичном этапе операции.
В конце операции во всех группах уровень гликемии также не превышал значения нормы, однако отмечалось достоверное повышение уровня глюкозы в I (до 5,6 ± 0,3 ммоль/л, р < 0,05) и II группе (до 5,8 ± 0,3 ммоль/л, р < 0,05) по сравнению с исходными. При этом уровень глюкозы в I (р < 0,05) и во II (р < 0,01) группах был достоверно выше по сравнению с III группой в конце операции.
В первые послеоперационные сутки отмечалось достоверное повышение уровня глюкозы в I (до 6,3 ± 0,3 ммоль/л, р < 0,01) и II (до 6,6 ± 0,3 ммоль/л, р < 0,01) группах по сравнению с этапом до операции, что превышало также лабораторную норму. На данном этапе уровень глюкозы в I (р < 0,01) и во II (р < 0,001) группах был достоверно выше по сравнению с III группой.
На травматичном этапе операции отмечалось достоверное снижение уровня кортизола во II (с 701,8 ± 123,9 нмоль/л до 445,0 ± 73,4 нмоль/л, р < 0,01) и III (с 660,1 ± 101,4 нмоль/л до 275,8 ± 38,5 нмоль/л, р < 0,01) группах по сравнению с исходными значениями. На данном этапе уровень кортизола в I группе был достоверно выше по сравнению с III группой (р < 0,01).
В конце операции отмечалось достоверное снижение уровня кортизола во II (до 361,8 ± 108,6 нмоль/л, р < 0,05) и III (до 322,9 ± 52,9 нмоль/л, р < 0,05) группах по сравнению с этапом до операции. Межгрупповых различий по уровню кортизолемии на данном этапе не было. Следует отметить, что в конце операции во всех группах уровень кортизолемии не превышал значения нормы.
В первые послеоперационные сутки статистически значимых отличий в группах по уровню кортизолемии по сравнению с дооперационным уровнем не отмечалось, однако на данном этапе уровень кортизола в III группе был достоверно выше по сравнению со II группой (р < 0,05).
Исходный уровень инсулина в группах не различался.
На травматичном этапе операции достоверных изменений уровня инсулина во всех группах по сравнению с этапом до операции не было. Не отмечалось также и межгрупповых различий на данном этапе по уровню инсулинемии.
В конце операции отмечалось достоверное снижение уровня инсулина во II группе (с 11,1 ± 0,8 мкЕд/мл до 6,3 ± 0,3 мкЕд/мл, р < 0,05) по сравнению с этапом до операции.
В первые послеоперационные сутки во всех группах достоверных изменений уровня инсулина по сравнению с этапом до операции не было. Межгрупповых различий по уровню инсулинемии на последних двух этапах не было.
На всех этапах инсулинемия не выходила за пределы лабораторной нормы (13,8 ± 11,2 мкЕд/мл).
Кортизол-инсулиновое соотношение достоверно снижалось на травматичном этапе операции в III группе (со 104,0 ± 23,1 до 46,1 ± 12,6; р < 0,05) по сравнению с этапом до операции.
В конце операции K/И во всех группах было относительно стабильным по сравнению с предыдущим этапом, имело тенденцию к снижению по сравнению с исходным уровнем (р > 0,05).
В первые послеоперационные сутки K/И было максимальным в III группе (116,4 ± 23,9), что было достоверно выше в сравнении со II группой, в которой K/И было минимальным (49,2 ± 17,2; р < 0,05).
Индекс НОМА на II–IІІ этапах во всех группах достоверно не отличался от дооперационного уровня, однако в первые послеоперационные сутки в I и II группах данный индекс достигал уровня 3,4 ± 1,3 и 3,4 ± 0,6 соответственно, а в III группе он оставался на уровне дооперационного (1,7 ± 0,2), что было достоверно ниже, чем во II группе (р < 0,05).
Обсуждение результатов
Из представленных результатов видно, что у пациентов всех групп до операции развивается стресс-реакция, о чем свидетельствует высокое содержание кортизола.
В I и II группе на травматичном этапе и в конце операции сохранялась нормогликемия, а в первые послеоперационные сутки отмечалась гипергликемия. На травматичном этапе содержание кортизола было повышено по сравнению с лабораторной нормой, однако на последующих этапах оно нормализовалось. Следует отметить, что во II группе уровень кортизола на травматичном этапе и в конце операции достоверно снижался по сравнению с дооперационным уровнем. Уровень инсулина в этих группах на всех этапах был в пределах лабораторной нормы, K/И на всех этапах достоверно не изменялось, индекс НОМА на I–III этапах был стабильным, однако на IV этапе он превышал норму.
В III группе на всех этапах сохранялась нормогликемия. На травматичном этапе и в конце операции содержание кортизола было в пределах нормы, однако в первые послеоперационные сутки отмечалась гиперкортизолемия. Уровень инсулина на всех этапах был в пределах лабораторной нормы. K/И соотношение достоверно снижалось на травматичном этапе, было наименьшим в конце операции по сравнению с другими группами, однако на IV этапе оно было наибольшим в данной группе и достоверно выше, чем во II. Индекс НОМА в этой группе был наиболее стабильным и достоверно ниже в первые послеоперационные сутки по сравнению со II группой.
Выводы
1. Внутривенная анестезия (пропофол, фентанил) в сравнении с проводниковой анестезией обеспечивает более выраженную антистрессовую защиту при операциях металлоостеосинтеза на травматичном этапе.
2. Необходимо проведение дальнейшего исследования для обоснования выбора метода анестезии.
1. Багаев В.Г. Сравнительная оценка антистрессорной активности ксенона и севофлурана при плановых анестезиях у детей / В.Г. Багаев, В.Г. Амчеславский, Д.И. Леонов // Анестезиология и реаниматология. — 2013. — № 1. — С. 7-10.
2. Бараш П. Клиническая анестезия / П. Бараш, Б. Куллен, Р. Стелтинг. — М.: Медицинская литература, 2004. — С. 197-202.
3. Бишовець С.М. Стан гемодинаміки та глікемії при тотальній інтравенозній анестезії в абдомінальній хірургії / С.М. Бишовець, В.М. Орел, К.В. Гаєвський // Біль, знеболювання і інтенсивна терапія. — 2013. — № 2. — С. 58-63.
4. Голуб И.Е. Хирургический стресс и обезболивание / И.Е. Голуб, Л.В. Сорокина. — Иркутск: ИГМУ, 2005. — 201 с.
5. Дюк Дж. Секреты анестезии / Дж. Дюк: Пер. с англ. — М.: МЕДпресс-информ, 2005. — С. 336-341.
6. Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии / А.П. Зильбер. — М.: Медицина, 1984. — С. 113-124.
7. Любошевский П.А. Хирургический стресс-ответ при абдоминальных операциях высокой травматичности и возможности его анестезиологической коррекции: автореф. дис. на соиск. уч. степ. доктора мед. наук: спец. 14.01.20 «анестезиология и реаниматология» / П.А. Любошевский. — М., 2012. — 42 с.
8. Поллард Б.Дж. Руководство по клинической анестезиологии / Под ред. Б.Дж. Полларда; Пер. с англ.; Под общ. ред. Л.В. Колотилова, В.В. Мальцева. — М.: МЕДпресс-информ, 2006. — С. 598-609.
9. Рафмелл Д.П. Регионарная анестезия: самое необходимое в анестезиологии / Д.П. Рафмелл, Д.М. Нил, К.М. Вискоуми; Пер. с англ.; Под общ. ред. А.П. Зильбера, В.В. Мальцева. — М.: МЕДпресс-информ, 2007. — С. 82-99, 113-132.
10. Рябов Г.А. Синдромы критических состояний / Г.А. Рябов. — М.: Медицина, 1994. — С. 84-105, 175-194.
11. Черний В.И. Стрессовая реакция как критерий адекватности анестезии при лапароскопической герниопластике и операции Лихтенштейна / В.И. Черний, Н.Н. Смирнова, И.В. Макара, Т.И. Колесникова // Питання експериментальної та клінічної медицини. — 2011. — № 2. — С. 256-260.
12. Шиганова А.М. Оценка адекватности анестезии и выраженности стрессорного ответа при резекциях печени / А.М. Шиганова, М.А. Выжигина, К.А. Бунятян, Л.И. Винницкий, Л.О. Самохина, А.С. Головкин, О.В. Балаян, Л.А. Юрьева // Анестезиология и реаниматология. — 2013. — № 5. — С. 15-19.
13. Reis F.M. Изменения пролактина и глюкозы в плазме, индуцированные хирургическим стрессом: единая или двойственная реакция? Мини-обзор (Перевод и обработка В. Фесенко) / F.M. Reis, A. Ribeiro-de-Oliveira Jr, L. Machado, R.M. Guerra, A.M. Reis, C.C. Coimbra // Медицина неотложных состояний. — 2008. — № 5(18). — С. 108-114.

/88/88.jpg)