Международный неврологический журнал 5 (67) 2014
Вернуться к номеру
Применение Эпилептала в комплексном лечении депрессивного расстройства у пациентов с высоким суицидальным риском
Авторы: Коростий В.И., Кожина А.М., Зеленская Е.А., Хмаин С.Х. - Харьковский национальный медицинский университет
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
В статье приведены результаты исследования, показавшего высокую эффективность комплексного подхода к терапии рекуррентного депрессивного расстройства, сопровождающегося суицидальным поведением. Лечение включало применение ламотриджина (Эпилептала) в комбинированной терапии с антидепрессантами, в комплексе с применением психокоррекционных и психообразовательных программ.
У статті наведені результати дослідження, яке показало високу ефективність комплексного підходу до терапії рекурентного депресивного розладу, що супроводжується суїцидальною поведінкою. Лікування включало застосування ламотриджину (Епілепталу) у комбінованій терапії з антидепресантами, у комплексі із застосуванням психокорекційних і психоосвітніх програм.
The article presents the results of a study that showed high efficiency of an integrated approach to the treatment of recurrent depressive disorder accompanied by suicidal behavior. Treatments included the use of lamotrigine (Epileptal) in combination therapy with antidepressants, together with application of and psychocorrective and psychoeducational programs.
депрессивные расстройства, ламотриджин, комплексные психокоррекционные программы.
депресивні розлади, ламотриджин, комплексні психокорекційні програми.
depressive disorders, lamotrigine, comprehensive psychocorrective programs.
Статья опубликована на с. 66-71
Проблема депрессивных расстройств является одной из актуальных для теории и практики современной медицины. По данным Всемирной организации здравоохранения, общая распространенность большого депрессивного расстройства составляет в среднем 5 % среди населения, среди пациентов общей практики — 33 %, риск заболевания в течение жизни — более 20 %. Свыше 25 % обращений пациентов к врачам общей практики связано с депрессиями, при этом только в 10–30 % случаев депрессивные расстройства распознаются как таковые [1, 2, 15].
При оценке суммарного рейтинга депрессии в отдельных возрастных когортах отмечается не только весомое увеличение общего количества пациентов, но и значительное «омоложение» этого заболевания. Известно, что вероятность заболеть депрессией в течение жизни возрастает более чем в 2 раза и достигает 14,4–17,3 %. При этом выздоровление или наступление стойкой ремиссии отмечается лишь у 33 % больных, в то время как у 55 % депрессия рецидивирует, еще у 12 % продолжается годами и даже десятилетиями [3–5, 10].
Более 60 % лиц, совершивших суицид, страдают большой депрессией. У больных алкоголизмом с депрессией эта цифра возрастает до 75 %. Около 15 % населения переносят депрессивный эпизод на протяжении жизни. 30 % всех больных с клинически выраженной депрессией совершают суицид; половина из них при этом погибает [6, 11, 13].
Суицидальное поведение представляет собой одну из наиболее актуальных проблем современного общества. Являясь сложным феноменом, суицидальное поведение включает в себя не только медицинский, но и социальный, психологический, культурный, религиозный и другие аспекты [9, 14, 15, 17].
На протяжении последнего десятилетия во всем мире депрессивные состояния приобретают угрожающие масштабы, наносят экономический вред обществу. Повышение риска осуществления аутоагрессивных действий у больных с депрессивными расстройствами свидетельствует о несомненной актуальности проблемы эффективного и адекватного лечения депрессивных расстройств, имеющей как медицинское, так и социальное значение [2, 7, 12, 16].
Вышеизложенное определило актуальность настоящего исследования, цель которого — оценка эффективности и безопасности ламотриджина в комплексной терапии больных с депрессивными расстройствами и высоким суицидальным риском.
Материал и методы
Для решения поставленной задачи нами с позиций системного подхода было проведено комплексное обследование 95 больных обоих полов в возрасте 18–55 лет, совершивших суицидальную попытку и находящихся на обследовании и лечении в базовых клиниках кафедры психиатрии, наркологии и медицинской психологии Харьковского национального медицинского университета с диагнозом «рекуррентное депрессивное расстройство» (F33.0, F33.1, F33.2).
Все больные ранее получали в амбулаторных или стационарных условиях монотерапию антидепрессантами группы селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН). В исследование включались пациенты, у которых наблюдалось отсутствие ответа на 2 адекватных курса монотерапии антидепрессантами.
В ходе работы были использованы следующие методы исследования: клинико-психопатологический, включающий в себя изучение жалоб, оценку психического статуса больных с выделением основных психопатологических синдромов и их динамики, в качестве диагностических критериев использовались критерии МКБ-10; клинико-анамнестический; психодиагностический с использованием шкал тревоги и депрессии Гамильтона (HDRS) (Hamilton M., 1967), адаптированных к МКБ–10 (Пантелеева Г.Л., 1988); шкалы Монтгомери — Асберг (MADRS) (Montgomery S.A., Asberg M., 1979), адаптированной к МКБ–10 (Guelfi G.D., 1993); больничной шкалы тревоги и депрессий (HADS) (Zigmond A.S., Snaith R.P., 1983); клинико-биохимический с использованием флуориметрических методов, а именно оценка концентрации серотонина в крови по интенсивности флуоресценции флуорофора при конденсации с нингидрином (Костюковская Л.С., 1993), методы математической статистики.
Результаты и обсуждение
Как показали результаты, в клинической картине депрессивных расстройств у обследованных больных наиболее характерны предъявляемые жалобы на сниженный фон настроения (79,5 ± 2,8 % обследованных), подавленность (46,2 ± 3,4 %), плаксивость (37,4 ± 3,3 %), чувство грусти, тоски (39,5 ± 3,3 %), чувство тревоги, постоянного внутреннего напряжения (44,6 ± 3,4 %), нежелание общаться со сверстниками (42,3 ± 3,4 %), плохую переносимость шума и яркого света (35,6 ± 3,3 %), головные боли (45,2 ± 3,4 %), головокружения (33,7 ± 3,2 %), мышечное напряжение (37,4 ± 3,3 %), мышечные боли (22,4 ± 2,8 %), парестезии (33,1 ± 3,2 %), нарушения цикла «сон — бодрствование» (76,2 ± 2,9 %), общую слабость, вялость и быструю утомляемость (56,2 ± 3,4 %), состояния растерянности (64,7 ± 3,3 %), явления повышенной восприимчивости к ранее нейтральным раздражителям (73,2 ± 3,1 %).
Особенностью депрессивных расстройств явилась их массивная соматизация, характеризующаяся полиморфными вегетовисцеральными расстройствами — 68,7 % обследованных.
Анализ тяжести состояния обследованных пациентов нами был проведен в соответствии с критериями МКБ-10 и основывался на оценке количества присутствующих в клинической картине психопатологических симптомов и степени их выраженности, с учетом дополнительного анализа степени тяжести депрессивной и тревожной симптоматики по шкалам Гамильтона, Монтгомери — Асберг.
На основе данных анамнеза, клинико-психопатологического исследования и показателей по шкалам Гамильтона, Монтгомери — Асберг и больничной шкале тревоги и депрессии выделены следующие варианты психопатологической симптоматики: тревожный — в 44,3 % случаев, неврастенический — в 38,9 %, тревожно-тоскливый — в 16,8 % случаев.
Для тревожного варианта характерна тяжелая либо умеренно выраженная тревога и депрессия по диагностическим шкалам, суицидальная попытка, развившаяся в результате кратковременной, внезапной и индивидуально значимой психогении. Доминирование общего тревожного фона настроения, подавленности, раздражительность, гиперестезии, чувство тоски, тревоги, ожидания несчастья, внутреннего напряжения, беспокойства с невозможностью расслабиться, усиление тревоги на фоне оживления воспоминаний о психотравмирующей ситуации. Характерными были нарушения цикла «сон — бодрствование». Отмечалась концентрация внимания на состоянии соматического неблагополучия, чему способствовали вегетосоматические симптомы, преимущественно кардиоваскулярного типа (тягостные ощущения сдавления, сжатия в груди).
Астенический вариант характеризовался легкой или средней выраженностью тревоги и депрессии по диагностическим шкалам и протекал с преобладанием астенических проявлений — повышенной утомляемости, вялости, истощаемости, раздражительности, повышенной восприимчивости к ранее нейтральным раздражителям, апатии, адинамии. Из вегетосоматических симптомов были типичны головные боли и иные сенесталгии, ощущение нехватки воздуха, артериальная гипотония, отсутствие аппетита. Суицидальная попытка развивалась на фоне длительного эмоционального напряжения.
Астенотревожный вариант включает тяжелую либо умеренно выраженную тревогу и депрессию по диагностическим шкалам, проявления астении в сочетании с тревогой, напряженностью, волнением, аффектом тоски, истерическими проявлениями на фоне ярких соматовегетативных проявлений. Суицидальное поведение формировалось постепенно, на фоне массивной психогении с длительными, непрогнозируемыми последствиями, тревожные проявления при этом сменялись астеническими и стойкими соматовегетативными расстройствами.
Тоскливый вариант характеризовался проявлениями выраженной тоски наряду с относительно слабовыраженной тревогой. Характерным являлось изменение структуры суточных колебаний настроения с выраженными проявлениями тоски именно в утренние часы в сочетании с грустью, подавленностью, апатией. Депрессивные и тревожные расстройства в рамках легкого и среднего эпизода по диагностическим шкалам. Суицидальное поведение развивалось при длительном подостром психогенном воздействии.
При клинической оценке выявлены гендерные различия. Так, если в тоскливом и астеническом диапазонах соотношение мужчин и женщин составляло 1 : 1,5, то в тревожном диапазоне было отмечено незначительное преобладание мужчин. У женщин по сравнению с мужчинами депрессивные эпизоды характеризовались большей выраженностью как тоскливого, так и тревожного компонентов депрессии, регистрируемых в соответствии со шкалой Гамильтона. Чаще, чем у мужчин, отмечались тенденции к вегетативным кризам и соматическим симптомам (p < 0,05).
В ходе исследования нами была проведена оценка пре– и постсуицидального периода. Пресуицидальный период у подавляющего большинства обследованных (89,3 %) носил острый характер, длительностью от нескольких минут до суток. В постсуицидальном периоде отмечалась редукция депрессивной симптоматики с негативным отношением к совершенной суицидальной попытке.
Для мужчин характерен более высокий показатель завершенных суицидов, что объясняется выбранным ими методом. Мужчины чаще используют огнестрельное оружие, повешение или падение с высоты. Женщины чаще выбирают передозировку лекарственных препаратов или наносят самопорезы.
При анализе особенностей метаболических нарушений в системе биогенных аминов у обследованных больных выявлено, что у пациентов с суицидальным поведением наблюдалось снижение экскреции адреналина в ночной период и норадреналина днем, повышение уровня серотонина и снижение концентрации мелатонина в крови.
Показательным было значительное снижение соотношения «мелатонин/серотонин» в группе пациентов с высоким уровнем депрессии, которое статистически достоверно отличалось от аналогичного показателя у здоровых лиц и у пациентов с баллом депрессии менее 13 (шкала Гамильтона). Для пациентов с выраженным депрессивным фоном характерным было достоверное уменьшение экскреции норадреналина как днем, так и ночью. В целом у лиц с суицидальным поведением выявлена низкая активность симпатоадреналовой системы в дневной и ночной периоды, возрастание уровня серотонина в крови и уменьшение содержания мелатонина в плазме. Эти метаболические изменения зависели от нозологических признаков, выраженности депрессивных нарушений (табл. 1).
Дальнейший статистический анализ полученных результатов с применением методов регрессии и корреляции обнаружил зависимости между метаболическими и клинико-психопатологическими параметрами. Показана прямая линейная обратная зависимость между уровнем мелатонина и серотонина в крови обследованных пациентов с суицидальным поведением.
Рассматривая результаты проведенных биохимических исследований, в целом можно обоснованно предположить, что нейротрансмиттерные и нейрогормональные системы, к которым относятся биогенные амины, метаболические нарушения и дисбаланс в этих системах имеют отношение к суицидальному поведению и суицидальным попыткам. Снижение содержания и, как следствие, функции мелатонина, нарушение его соотношения с серотонином и катехоламинами создает нейрогормональный фон для развития психопатологических состояний, приводящих к суицидальным намерениям и действиям.
Более высокие, чем нормальные, значения выявлены у 60 % пациентов, нормальные показатели — у 40 %, концентрация мелатонина была в целом сниженной — ниже нормы у 50 %, выше нормы — у 25 %, нормальные параметры наблюдались у 25 % обследованных. Известно, что концентрация серотонина в крови зависит практически от его депонированной в тромбоцитах формы, а тромбоциты отображают интенсивность его обратного вовлечения, которое может быть свойственным и центральным серотониновым нейронам. Нарушение функций серотонина является составной частью моноаминовой теории депрессий, дисфункцию эпифиза и недостаточность мелатонина, как правило, ассоциируют с сезонными депрессиями. Исходя из полученных в работе данных можно утверждать, что нейроэндокринная регуляция суицидального поведения инициируется снижением уровня мелатонина, что, в свою очередь, приводит к снижению экскреции катехоламинов, которое свидетельствует о недостаточности или истощении этого звена адаптации в результате длительно действующей предшествующей стрессорной ситуации. Поэтому пациенты с суицидальными намерениями были не способны выйти из долговременной конфликтной ситуации путем активного варианта ее решения, не имея метаболического ресурса для ее преодоления.
В настоящее время в терапии рекуррентной депрессии и биполярного аффективного расстройства используется комплексный подход, включающий в себя применение нормотимиков, антипсихотиков, антидепрессантов, а также интенсивные психотерапевтические и психоообразовательные мероприятия.
К препаратам первой линии выбора независимо от фазы и этапа заболевания относятся нормотимики, которые следует назначать уже на начальных этапах заболевания с их последующим длительным приемом. Эта группа включает в себя традиционно применяющиеся карбонат лития, вальпроаты, а также ламотриджин.
В нашем исследовании выбор ламотриджина как препарата для аугментированной («усиленной») терапии в виде комбинации с антидепрессантами групп СИОЗС и СИОЗСН обусловлен минимальными побочными эффектами и межлекарственными взаимодействиями, низкой поведенческой токсичностью.
Ламотриджин — современный антиконвульсант, давно успешно применяющийся при лечении эпилепсии, в настоящее время зарегистрирован также в качестве препарата выбора при биполярном расстройстве. Следует отметить, что на сегодняшний день ламотриджин является единственным нормотимиком, эффективность которого, в том числе и у больных с «быстрой сменой фаз», доказана в методологически точно спланированных слепых плацебо- и литийконтролируемых исследованиях.
Механизм действия ламотриджина определяется селективной блокадой потенциалзависимых медленно инактивирующихся натриевых каналов нейронов, в результате чего происходит торможение выброса в синаптическую щель возбуждающих аминокислот, в первую очередь глутамата. Ламотриджин блокирует потенциалзависимые кальциевые каналы нейронов гиппокампа, то есть региона, ответственного за регуляцию эмоциональной сферы, когнитивные функции и подкорково-корковые взаимоотношения. Кроме того, для ламотриджина характерно неселективное ингибирование обратного захвата моноаминов (в том числе серотонина), блокада моноаминоксидазы.
В ходе работы нами использовался Эпилептал (препарат ламотриджина производства компании «Фармак») в терапевтической дозировке 200–300 мг/сут, назначаемый с титрованием дозы при постепенном ее наращивании: в 1–2-ю неделю терапии доза составляла 25 мг 1 раз в сутки, на 3-й неделе — 50 мг 1 или 2 раза в сутки, с дальнейшим ее повышением на 4-й неделе (достижение стабилизирующей суточной дозы) до 100 мг 1 или 2 раза в сутки. Максимальная суточная доза составила 200 мг. В ряде случаев суточная доза повышалась до 300 мг на 6-й неделе терапии.
К преимуществам использования Эпилептала в нашем исследовании следует отнести:
— потенцирование антидепрессивного эффекта;
— благоприятное влияние на когнитивные функции и психоэмоциональную сферу;
— назначение один или два раза в сутки, что, минимально обременяя пациента, обеспечивает соблюдение им режима лечения более надежно, чем при многократных приемах;
— отсутствие рецидивов при однократном пропуске приема препарата;
— безопасность и хорошая переносимость.
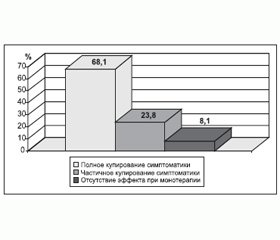
Эпилептал в комбинированной терапии с антидепрессантами (СИОЗС, СИОЗСН) оказался эффективен у 91,9 % больных, у 68,1 % отмечалось полное, а у 23,8 % — частичное купирование депрессивной симптоматики (рис. 1).
/69/69.jpg)
Начальный клинический эффект отмечался с 4–6-й недели приема Эпилептала, что обусловлено постепенным увеличением дозы препарата.
На фоне применения препарата Эпилептал нами отмечены:
— редукция аффективной симптоматики;
— изчезновение суицидальных мыслей;
— нормализация фона настроения;
— стабилизация вегетативного статуса, нормализация цикла «сон — бодрствование».
Наблюдалось повышение психофизической активности больных, увеличение уверенности в собственных силах и возможностях, что позволяло расширять контакты с окружающими, возобновлять привычный двигательный режим. К концу 9-й недели заметно улучшились когнитивные показатели. Все вышеперечисленное способствовало более успешной психосоциальной адаптации больных.
При оценке динамики показателей по психодиагностическим шкалам на 3-й неделе приема Эпилептала отмечено снижение показателей до 13 баллов и меньше по шкале Гамильтона, 15 баллов и меньше по шкале Монтгомери — Асберг, 7 баллов и меньше по больничной шкале тревоги и депрессии, что свидетельствует об отсутствии депрессивного и тревожного эпизодов (рис. 2).
/70/70.jpg)
В результате исследования выявлена хорошая переносимость препарата Эпилептал, меньшая выраженность и частота побочных эффектов, особенно в отношении высших психических функций. Побочные действия препарата отмечены у 8,7 % больных и являлись дозозависимыми. Наиболее часто при применении ламотриджина наблюдались такие побочные эффекты, как головокружение, головная боль, тошнота, сонливость, диплопия, а также кожная сыпь макулопапулезного характера. Ни в одном случае данный факт не повлек за собой отмены препарата. Все остальные случаи побочных эффектов вполне предсказуемы (типичны для данного класса препаратов), они в целом быстро проходят при продолжении лечения и доступны для быстрой коррекции. Вместе с тем риск развития побочных эффектов может быть существенно снижен за счет минимизации стартовой дозы препарата и соблюдения рекомендуемых схем титрования дозы.
Необходимо отметить, что в обеих группах для коррекции депрессивных расстройств помимо фармакотерапии применялись комплексные психокоррекционные программы, предусматривавшие поэтапное введение психотерапевтических методик в зависимости от личностных особенностей больных и содержательной части психотерапии. В состав вышеуказанных программ входят следующие психотерапевтические методики: рациональная, личностно-ориентированная, когнитивно-бихевиоральная психотерапия, тренинг когнитивных, профессиональных и социальных навыков. Также неотъемлемым компонентом психотерапевтического вмешательства является психообразовательная работа с больными депрессивными расстройствами и их родственниками.
Проведенное в течение 12 месяцев катамнестическое исследование показало высокую эффективность предлагаемой комплексной системы для терапии депрессивных расстройств с высоким риском суицидального поведения. Применение ламотриджина (Эпилептала) в сочетании с антидепрессантами способствует снижению частоты рецидивов на 12,5 %, инверсии фаз — на 34,2 %. У 83,8 % больных повторных суицидальных попыток не отмечалось, 16,2 % прошли повторные курсы комплекса терапевтических мероприятий в связи с дополнительными психотравмирующими обстоятельствами, при этом у данной категории больных суицидального поведения не отмечалось, а в клинической картине доминировала астеническая и тревожно-депрессивная симптоматика.
Таким образом, проведенное исследование показало высокую эффективность комплексного подхода к терапии рекуррентного депрессивного расстройства, сопровождающегося суицидальным поведением и включающего в себя применение препарата Эпилептал (ламотриджин) в комбинированной терапии с антидепрессантами (СИОЗС, СИОЗСН), в комплексе с применением психокоррекционных и психообразовательных программ.
1. Бачериков А.Н., Денисенко М.М. Клинико-психопатологические, патопсихологические особенности и принципы профилактики суицидального поведения у больных эндогенными и экзогенными депрессиями // Український вісник психоневрології. — 2010. — Т. 18, вип. 4(65). — С. 56–60.
2. Кожина А.М., Коростий В.И., Зеленская Е.А., Хмаин С.Х. Психогенные депрессии и суицидальное поведение у лиц молодого возраста // Медична психологія. — 2013. — Т. 8, № 4 (32). — С. 42–45.
3. Коростий В.И., Кожина А.М., Хмаин С.Х. Оценка эффективности и переносимости ламотриджина (Эпилептал) в комбинированной терапии резистентных к лечению и атипичных форм рекуррентного депрессивного расстройства // Международный неврологический журнал. — 2013. — № 2(56). — С. 68–76.
4. Марута Н.А. Стан надання та перспективи розвитку психіатричної допомоги в Україні // Архів психіатрії. — 2011. — Т. 17, вип. 3(66). — С. 5–9.
5. Марута Н.А., Семикина Е.Е. Новые возможности терапии депрессивных расстройств // Український вісник психоневрології. — 2007. — Т. 15, вип. 3(52). — С. 89–94.
6. Марута Н.О. Стан психічного здоров’я населення та перспективи розвитку психіатричної допомоги в Україні // Здоров’я України. — 2012. — № 3(22). — С. 6–8.
7. Марута Н.О., Семікіна О.Є., Малюта Л.В. Когнітивно-біхевіоральна терапія при лікуванні депресивних порушень // Таврический журнал психиатрии. — 2011. — Т. 15, № 2(52). — С. 32–33.
8. Михайлов Б.В. Психогенные расстройства и проблемы психотерапии // Международный психиатрический, психотерапевтический и психоаналитический журнал. — 2007. — Т. 1, № 1. — С. 84–89.
9. Мішиєв В.Д. Сучасні депресивні розлади. — Львів: Видавництво «МС», 2004. — 208 с.
10. Пилягина Г.Я. Многоликость саморазрушения (особенности патогенеза аутодеструктивных эквивалентов) / Г.Я. Пилягина // Таврический журнал психиатрии. — 2002. — № 2(19). — С. 52–56.
11. Подкорытов В.С., Чайка Ю.Ю. Депрессии (Современная терапия). — Харьков: Торнадо, 2003. — 350 с.
12. Пшук Н.Г., Коваленко І.В., Пшук Г.Я. Психологічна предиспозиція депресії // Всесвіт соціальної психіатрії, медичної психології та психосоматичної медицини. — 2009. — Т. 1, № 2(2). — С. 21–24.
13. Чабан О.С. Тревога, депрессия и боль // Здоров’я України. — 2012. — № 3(22). — С. 4.
14. Чуприков А.П. К вопросу о необходимости организации суицидологической службы в Украине / А.П. Чуприков, Г.Я. Пилягина // Український вісник психоневрології. — 2002. — № 10(2). — С. 154–157.
15. Lewinsohn P.M. Adolescent suicidal ideation and attempts: Prevalence, risk factors, clinical implications / P.M. Lewinsohn, P. Rohde, J.R. Seeley // Clinical Psychology: Science and Practice. — 1996. — № 3. — Р. 25–46.
16. Mann J.J. Toward a clinical model of suicidal behavior in psychiatric patients. / J.J. Mann, C. Watemaux, G. Haas, K. Malone // Am. J. Psychiatry. — 1999. — № 156. — Р. 181–189.
17. Ganesvaran Т. Psychiatric in-patient suicide rates: a 21-year study / Т. Ganesvaran, A.K. Shah // Med. Sci. Law. — 1997. — Vol. 37, № 3. — P. 202–209.

/68/68.jpg)