Международный неврологический журнал 5 (67) 2014
Вернуться к номеру
Старение мозга: возможности нейрогеропротекторной терапии
Авторы: Насонова Т.И., Сазонов И.В. - Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
С целью изучения влияния включения современных нейропротекторов с антигипоксическим действием в комплексную терапию пациентов с хронической ишемией мозга и оценки возможности использования исследования когнитивных вызванных потенциалов методом P300 (латентность) для определения нейрогеропротекторного эффекта было проведено открытое рандомизированное исследование. Основную группу составили 50 пациентов с хронической ишемией мозга (дисциркуляторная энцефалопатия (ДЭ) ІІ ст.) в возрасте от 47 до 74 лет (средний возраст 66,7 года), которые кроме традиционной получали этапную терапию препаратом Армадин по схеме: 1–7-й день — в/м по 100 мг 2 раза в сутки; 8–21-й день — перорально по 1 таблетке (125 мг) 3 раза в сутки. Группу контроля составили 20 пациентов в возрасте от 48 до 70 лет, которые получали традиционную терапию. Эффективность терапии оценивали по результатам наблюдения в динамике клинико-неврологических показателей, результатам нейропсихологического тестирования с использованием стандартных шкал, а также исследования когнитивных вызванных потенциалов методом Р300. В результате проведенного этапного лечения препаратом Армадин у пациентов с хронической ишемией мозга (ДЭ ІІ ст.) выявлено уменьшение субъективной и объективной симптоматики ДЭ в виде снижения выраженности симптомов головокружения, головных болей, улучшения памяти, общего самочувствия и, как следствие, повышения качества жизни. Согласно проведенным расчетам изменение биологического возраста составило –5,752 и –6,352 года в основной группе и +2,92 и +2,512 года — в контрольной, по данным Р300 в соответствующих отведениях. Таким образом, препарат Армадин продемонстрировал нейрогеропротекторный эффект у пациентов с хронической ишемией мозга (ДЭ ІІ ст.).
З метою вивчення впливу включення сучасних нейропротекторів з антигіпоксичною дією в комплексну терапію пацієнтів з хронічною ішемією мозку і оцінки можливості використання дослідження когнітивних викликаних потенціалів методом P300 (латентність) для визначення нейрогеропротекторного ефекту було проведено відкрите рандомізоване дослідження. Основну групу склали 50 пацієнтів з хронічною ішемією мозку (дисциркуляторна енцефалопатія (ДЕ) ІІ ст.) віком від 47 до 74 років (середній вік 66,7 року), які крім традиційної отримували етапну терапію препаратом Армадін за схемою: 1-ша — 7-ма доба — в/м по 100 мг 2 рази на добу; 8-ма — 21-ша доба — перорально по 1 таблетці (125 мг) 3 рази на добу. Групу контролю склали 20 пацієнтів віком від 48 до 70 років, які отримували традиційну терапію. Ефективність терапії оцінювали за результатами спостереження в динаміці клініко-неврологічних показників, за результатами нейропсихологічного тестування з використанням стандартних шкал, а також дослідження когнітивних викликаних потенціалів методом Р300. В результаті проведеного етапного лікування препаратом Армадін у пацієнтів з хронічною ішемією мозку (ДЕ ІІ ст.) виявлено зменшення суб’єктивної та об’єктивної симптоматики ДЕ у вигляді зниження вираженості симптомів запаморочення, головних болів, поліпшення пам’яті, загального самопочуття і, як наслідок, підвищення якості життя. Згідно з проведеними розрахунками зміна біологічного віку склала –5,752 і –6,352 року в основній групі і +2,92 і +2,512 року — в контрольній, за даними Р300 у відповідних відведеннях. Таким чином, препарат Армадін продемонстрував
нейрогеропротекторний ефект у пацієнтів з хронічною ішемією мозку (ДЕ ІІ ст.).
In order to study the effect of the inclusion of modern neuroprotectors with antihypoxic action in the complex therapy of patients with chronic cerebral ischemia and to assess the possibility of using the study of cognitive evoked potentials by P300 method (latency) to determine neurogeroprotective effect, there has been carried out an open, randomized study. Study group comprised of 50 patients with chronic cerebral ischemia (discirculatory encephalopathy (DE) stage II) aged 47 to 74 years (mean age 66.7 years) who received, in addition to conventional one, a step treatment with Armadin by scheme: 1st — 7th day — i/m 100 mg twice a day; 8th — 21st day — orally, 1 tablet (125 mg) 3 times a day. The control group consisted of 20 patients aged 48 to 70 years who received conventional therapy. Efficacy of the therapy has been assessed based on the results of follow-up in the dynamics of clinical and neurological indicators, the results of neuropsychological testing using standard scales, as well as studies of cognitive evoked potentials by P300 method. As a result of step drug treatment with Armadin, patients with chronic cerebral ischemia (DE stage II) showed a decrease of subjective and objective symptoms of DE as a reduction in symptoms of dizziness, headaches, memory enhancement, general well-being and, as a result, improved quality of life. According to our calculations, the change of biological age was –5.752 and –6.352 in the study group and +2.92 and +2.512 years — in the control one, in terms of to the P300 in the respective leads. Thus, Armadin demonstrated neurogeroprotective effect in patients with chronic cerebral ischemia (DE stage II).
старение, нейропротекция, Армадин.
старіння, нейропротекцiя, Армадін.
aging, neuroprotection, Armadin.
Статья опубликована на с. 79-86
По прогнозам Организации Объединенных Наций, к середине века на Земле будет жить около 3,2 миллиона людей старше 100 лет, в то время как на сегодняшний день их насчитывается немногим более 300 тысяч.
Доля пожилых людей в общей структуре населения растет быстрее, чем какой-либо другой возрастной группы. На мировой карте появляется все больше «старых» стран — государств, в которых население старше 65 лет составляет более 7 %.
В силу того, что проблема старения будет иметь все более выраженный характер, ученые всех стран исследуют процессы старения и разрабатывают пути снижения их влияния на каждого человека и человечество в целом.
Старение — процесс разрушения, проявляющийся с возрастом вследствие повреждающего действия эндогенных (наследственность и болезни) и экзогенных факторов (факторы среды), приводящий к недостаточной работе физиологических функций любого организма.
При старении происходит снижение способности организма к приспосабливанию и развиваются возрастные патологии. Принято различать биологический и календарный возраст. Возраст календарный — паспортный возраст, учитывает только время существования организма. Возраст биологический — реальная степень старения организма, так называемый настоящий (функциональный) возраст, оценивается на основе измерения параметров, отражающих функционирование различных систем организма. Биологический возраст с высокой точностью можно определить при помощи специальных тестов, в основе которых лежит оценка функций индивидуума и сравнивание со средними значениями в популяции (возрастные кривые).
Под темпом старения понимают разницу между биологическим и календарным возрастом. При медленном темпе старения календарный возраст больше биологического, а продолжительность жизни выше.
Различают следующие виды старения организма: нормальное (естественное), замедленное, преждевременное (ускоренное).
Естественное старение характеризуется конкретным темпом и определенной последовательностью возрастных изменений, соответствующих нормальным (средним) биологическим возможностям данной группы организмов.
Замедленное старение — старение, при котором темпы возрастных изменений более медленные, чем в среднем в данной популяции организмов. При предельно низком темпе старения организма проявляется феномен, известный как долголетие.
Ускоренное (преждевременное) старение характеризуется проявлением более ранних возрастных изменений или ярким их проявлением в какой-то возрастной период.
В отличие от естественного (физиологического) старения, результатом которого будет активное долголетие, ускоренное старение способствует развитию патологических состояний и болезней. Ускоренное старение обусловлено внутренними и средовыми факторами. Эти факторы могут включаться на разных этапах развития физиологического старения, видоизменяя его механизмы и проявления. Ряд заболеваний могут ускорять старение и влиять на показатели биологического возраста. К таким заболеваниям следует отнести церебральный атеросклероз, артериальную гипертензию, хронические неспецифические заболевания легких, сахарный диабет, ожирение, гипотиреоз и др. На основании тестов для определения биологического возраста можно оценить как степень влияния хронических заболеваний на темпы старения, так и эффективность геропротекторных мероприятий и программ.
В данной работе предпринята попытка оценить степень влияния хронической ишемии мозга на темпы старения и определить эффективность нейрогеропротекторной терапии.
Цереброваскулярные заболевания относятся к распространенной патологии человека. По данным профилактических осмотров населения, они диагностируются в 20–30 % случаев даже у лиц трудоспособного возраста и являются важнейшей медико-социальной проблемой, поскольку обусловливают самые высокие показатели смертности и инвалидизации [1, 7].
Высокая чувствительность головного мозга к гипоксии обусловлена его физиологическими особенностями. В первую очередь следует отметить высокий уровень потребления кислорода на единицу массы; большое количество липидов с остатками ненасыщенных жирных кислот; присутствие железа в структуре многих белков-переносчиков; низкий уровень местной антиоксидантной защиты. Дефицит кислорода приводит к ограничению аэробного образования энергии вследствие нарушения энергосинтезирующей функции дыхательной цепи митохондрий. В результате происходит накопление активных форм кислорода, истощение запасов эндогенных антиоксидантов и активация перекисного окисления липидов (ПОЛ) клеточных мембран, что может приводить к гибели клеток мозга [2, 6]. Ранее было показано, что активация ПОЛ наблюдается не только при острых нарушениях мозгового кровообращения (ОНМК), но и при хронических цереброваскулярных заболеваниях, таких как дисциркуляторная энцефалопатия (ДЭ), и последствиях ОНМК, так как мозг больных при этих состояниях находится в условиях хронической гипоксии вследствие развития гипертонической или атеросклеротической ангиопатии. В связи с этим становится очевидной целесообразность использования в комплексной терапии хронических сосудистых заболеваний мозга препаратов, способных защищать мозг от гипоксии и тем самым тормозить повреждающее действие ПОЛ, что, в свою очередь, может улучшить функционирование центральной нервной системы (ЦНС) и, как результат, гарантировать снижение темпов старения.
Хроническая церебральная ишемия часто развивается исподволь, бессимптомно, поражает людей среднего и старшего возраста и до определенного момента никак не проявляет себя (Захаров В.В., Яхно Н.Н., 2004; Мищенко Т.С., 2007). И лишь переход в стадию, когда клинически и с помощью нейропсихологических тестов выявляются признаки поражения мозга, заставляет обращать на себя внимание. В последние годы хроническая ишемия мозга, как и острая, значительно «помолодела». Это во многом связано с различными хроническими заболеваниями, которые способствуют прогрессированию ишемии мозга. Ведущую роль играют атеросклеротическое поражение стенки сосудов, артериальная гипертензия, заболевания миокарда, сахарный диабет и др. [3]. Все эти заболевания приводят к изменению мозгового кровотока с гипоксией вещества мозга и каскадом биохимических изменений, что влечет за собой диффузные многоочаговые изменения в веществе головного мозга [4].
В условиях ишемии запускается каскад процессов: ишемия — снижение энергетического метаболизма — увеличение продукции активных форм кислорода — повышение уровня продуктов ПОЛ — повреждение ДНК — апоптоз — нарушение функций ЦНС — ускорение темпов старения.
Среди функциональных методов оценки биологического возраста в последние годы приобрело популярность исследование компонента Р300 когнитивных вызванных потенциалов, которое отражает процессы восприятия и обработки информации и является нейрофизиологическим коррелятором мнестической деятельности. Позитивная волна Р300 возникает в интервале 250–450 мс (в среднем около 300 мс) после предъявления стимула. Считается, что этот компонент наиболее тесно связан с когнитивными процессами восприятия и внимания [8]. Имеется отчетливая зависимость параметров Р300 от возраста. На основании этого построены специальные линии регрессии, кривые старения, отражающие зависимость латентности волны от возраста здоровых испытуемых. Наблюдается устойчивое увеличение латентности Р300 с возрастом (латентность Р300 удлиняется на 1,25 мс в год, а амплитуда уменьшается со скоростью 0,09 мкВ в год) [8]. Было обнаружено, что кривая латентности волны Р300 имеет более сложную зависимость. Имеется тенденция к уменьшению этого параметра до 16–17 лет, а затем начинается кривая старения. Данные линии регрессии используются для более точной оценки изменений параметров волны Р300 при когнитивных нарушениях у больных разного возраста, а также для объективизации изменений в процессе старения [8].
Ключевым патогенетическим звеном при хронической ишемии мозга является усиленная продукция активных форм кислорода с последующим запуском процесса ПОЛ. Данный факт определил направление нашего выбора в отношении препаратов с выраженным и доказанным антиоксидантным и антигипоксантным действием.
В начале 1980-х годов был синтезирован этилметилгидроксипиридина сукцинат (ЭМГПС), фармакологические эффекты которого можно разделить на основные и дополнительные. Синергизм основных эффектов определяет тройной механизм ЭМГПС при гипоксических состояниях:
1) активация основных ферментов антиоксидантных систем: супероксиддисмутазы, глутатионпероксидазы, глутатионредуктазы, каталазы — обусловливает мощный антиоксидантный эффект;
2) непосредственное связывание молекулой ЭМГПС свободных радикалов обеспечивает мембраностабилизирующий эффект и улучшение функционирования мембраносвязанных ферментов (кальцийнезависимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), ионных каналов и рецепторных комплексов, в том числе ГАМК–бензодиазепинового, ацетилхолинового;
3) активация окислительных процессов в цикле Кребса (увеличение активности сукцинатдегидрогеназы и поступление сукцината), обусловливающих увеличение продукции АТФ и снижение уровня лактата.
Комбинация основных фармакологических эффектов обусловливает эффективность ЭМГПС в уменьшении эксайтотоксичности и, как результат, обеспечении нейропротекции.
К дополнительным фармакологическим эффектам можно отнести следующие: повышение содержания в головном мозге дофамина, улучшение транспорта нейромедиаторов и синаптической передачи. Клинически данные эффекты определяют анксиолитический эффект, повышение работоспособности и когнитивных функций, повышение резистентности организма к действию различных экстремальных факторов (стресс, физические нагрузки, лишение сна, различные интоксикации), устранение нарушений, возникающих при алкоголизме и наркоманиях [1, 2].
Среди препаратов ЭМГПС на фармацевтическом рынке Украины особого внимания заслуживает –отечественный препарат Армадин НПФ «Микрохим». Армадин выпускается в виде раствора для инъекций, содержащего 50 мг/мл, и таблеток по 125 мг, что обеспечивает возможность проведения этапной терапии.
Армадин выпускается в полном соответствии с критериями качества и одновременно является одним из наиболее доступных препаратов этилметилгидроксипиридина сукцината в Украине, что существенно расширяет возможности и перспективы его применения в отечественной клинической практике.
Цель исследования: оценить влияние патогенетической этапной нейропротекторной терапии препаратом Армадин при хронической ишемии мозга путем включения его в комплекс терапевтических мероприятий, а также определить возможности использования Р300 для оценки нейрогеропротекторного эффекта проведенной терапии.
Материалы и методы
Наблюдали 70 пациентов с хронической ишемией мозга, у которых была диагностирована дисциркуляторная энцефалопатия II степени, преимущественно атеросклеротического генеза без критического стеноза сонных артерий, в возрасте от 47 до 74 лет (из них 30 женщин и 40 мужчин). В составе лечебных мероприятий основной группы (50 человек) был назначен препарат Армадин. В группу контроля вошли 20 пациентов, получавшие традиционную терапию без использования препарата Армадин. Основная и контрольная группы были сопоставимы по полу, возрасту, этиологии и тяжести течения болезни. Показатели нейропсихологических тестов, клинико-неврологического обследования, дополнительных методов обследования, магнитно-резонансная томография головного мозга и ультразвуковая допплерография экстра- и интракраниальных сосудов отражали наличие у наблюдаемых пациентов дисциркуляторной энцефалопатии ІІ ст.
Пациенты исследуемых групп наблюдались в течение 24 дней. Они были обследованы до начала лечения, затем через 7 дней (контрольный осмотр) и в конце лечения. Исследование проводилось открыто. При наборе пациентов использовали метод рандомизации. Пациенты как основной, так и контрольной групп получали базовую терапию, которая была максимально унифицирована и включала прием диуретиков, гипотензивных, кардиальных, противодиабетических, антиагрегантных препаратов по показаниям. Препараты и дозы назначались индивидуально, с учетом показателей артериального давления, липидограммы, наличия сопутствующих заболеваний. На протяжении всего курса не назначались ноотропные, психотропные препараты. Армадин назначался по следующей схеме: в/м по 100 мг 2 раза в сутки в течение 7 дней, затем по 1 табл. (125 мг) 3 раза в день через 8 часов в течение 2 недель.
Больным проводилось клинико-неврологическое обследование (жалобы, анамнез, неврологический статус), исследование сердечно–сосудистой системы, измерение артериального давления, электрокардиография, дуплексное сканирование брахиоцефальных сосудов с цветным картированием потока. Определяли показатели общего анализа крови, мочи, глюкозы крови, С-реактивного белка, билирубина, АЛТ, АСТ, общего холестерина, триглицеридов, липопротеидов низкой, высокой плотности, гемокоагуляционные свойства, коэффициент атерогенности. Лабораторные и инструментальные исследования проводились до и после лечения (день –1 и день 22).
Для объективизации субъективной симптоматики использовались соответствующие шкалы.
Головокружение оценивали по Dizziness Handicap Inventory (DHI) (1996):
— 1 балл — приступы головокружения не беспокоят;
— 2 балла — минимальные симптомы головокружения;
— 3 балла — легкие симптомы головокружения при повороте головы или вставании, которые не нарушают нормальной жизнедеятельности и не сопровождаются вегетативными нарушениями;
— 4 балла — умеренно выраженные симптомы головокружения: приступы головокружения продолжительностью до 10 секунд, минимальные ограничения двигательной активности, возможны вегетативные нарушения (тошнота, рвота, нарушение равновесия, головная боль);
— 5 баллов — выраженные симптомы головокружения: приступы головокружения продолжительностью до 30 секунд, умеренные ограничения двигательной активности, вегетативные нарушения в большинстве случаев головокружений (тошнота, рвота, нарушение равновесия, головная боль, нарушение зрения, слабость, падение, онемение в конечностях), беспокойство, тревога по поводу возможной потери равновесия и падения;
— 6 баллов — значительно выраженные симптомы головокружения: приступы продолжительностью более 30 секунд, всегда сопровождаемые вегетативными нарушениями (тошнота, рвота, нарушение равновесия, головная боль, нарушение зрения, слабость, падение, онемение в конечностях), резкое ограничение двигательной активности, страх по поводу возможной потери равновесия и падения.
Интенсивность головной боли пациенты оценивали, используя визуальную аналоговую шкалу боли (ВАШ) (Huskisson E.С., 1974). Цифровая ВАШ представляла собой отрезок длиной 10 см, на котором интенсивность боли обозначалась цифрами от 0 до 10. Пациент должен был указать интенсивность боли, учитывая, что ноль соответствует отсутствию боли, а десять — максимальной боли.
Нейропсихологическое тестирование включало скрининг-оценку психического состояния по шкале MMSE, затем осуществлялась оценка когнитивных функций по Монреальской шкале оценки когнитивных функций (МоСА).
Всем пациентам проводили исследование когнитивных вызванных потенциалов методом Р300. Исследование выполнено на аппарате «Нейрон–спектр–5». Использовалась бинауральная стимуляция.
Статистическая обработка результатов исследования проводилась с помощью современных методов математического анализа с использованием пакета статистических программ Statistica-6 и Exсel 2003. Рассчитывались средние показатели и ошибки средних. В качестве критерия достоверности отклонения показателей использовали параметрический критерий Стьюдента и непараметрический критерий U (Вилкоксона — Манна – Уитни).
Результаты исследования и их обсуждение
Наиболее частыми субъективными проявлениями дисциркуляторной, атеросклеротической и гипертензивной энцефалопатии у обследуемых больных были головокружение и головная боль.
До начала терапии с применением препарата Армадин большинство пациентов основной и контрольной групп интенсивность головокружения оценивали как легкую или умеренную (3 и 4 балла по шкале DHI). Головокружение не беспокоило лишь одного пациента основной группы (2 %) и 1 (5 %) — контрольной, минимальная интенсивность приступов (2 балла) наблюдалась у 5 (10 %) больных основной и 1 (5 %) — контрольной группы, легкая (3 балла) — у 22 (44 %) и 9 (45 %) соответственно, средняя (4 балла) — у 19 (38 %) и 7 (35 %), выраженные симптомы головокружения (5 баллов) отмечались у 2 (4 %) больных основной и 1 (5 %) — контрольной группы, значительно выраженные (6 баллов) — у 1 (2 %) и 1 (5 %) соответственно.
После проведенного лечения количество больных, у которых приступы головокружения отсутствовали полностью (1 балл по шкале DHI), в основной группе увеличилось до 6 (12 %), в контрольной группе цифры не изменились — 1 пациент (5 %). Количество пациентов с минимальными признаками головокружения (2 балла) в основной группе увеличилось до 11 (22 %), в контрольной — до 2 (10 %), с легкими признаками головокружения (3 балла) — уменьшилось в обеих группах до 21 (42 %) и 8 (40 %) соответственно. Количество больных с умеренными признаками головокружения (4 балла) в основной группе уменьшилось до 11 (22 %), а в контрольной не изменилось — 7 (35 %). Кроме того, в основной группе после проведенного лечения ни у одного больного не наблюдалось значительно выраженных приступов головокружения (6 баллов), при сохранении показателя в группе контроля — 1 (5 %).
Результаты показывают существенное уменьшение интенсивности и количества приступов головокружения после проведенного лечения с применением препарата Армадин. Наибольшее изменение в сторону уменьшения интенсивности головокружения отмечалось в группе с умеренно выраженными симптомами головокружения (4 балла по шкале DHI) — доля пациентов с данными симптомами снизилась с 38 до 22 % пациентов (–42,1 %), в то время как в контрольной группе не отмечалось динамики по группам пациентов с умеренно выраженными, выраженными и значительно выраженными симптомами головокружения (4–6 баллов по шкале DHI).
Головная боль — вторая по частоте встречаемости жалоба больных, участвовавших в исследовании. Периодические головные боли отмечали 32 (64 %) пациента основной группы и 14 (70 %) пациентов контрольной группы.
До лечения средняя оценка по ВАШ у больных основной группы составлял 6,25 балла, у пациентов контрольной группы — 6,15 балла. Уже на 7–8-й день лечения больные основной группы отмечали уменьшение интенсивности головной боли. На момент окончания лечения средняя оценка по ВАШ у больных основной группы составила 2,05 балла, у пациентов контрольной группы — 3,95 балла.
Изменение среднего балла интенсивности головной боли по визуальной аналоговой шкале при оценке периодической головной боли в основной группе составляло –67,2 %, в то время как в контрольной группе — –35,8 %.
Суммарное количество пациентов, которые отметили исчезновение симптомов и улучшение, в основной группе составило 30 (93,8 %), а в контрольной — 10 (71,4 %).
При оценке статуса когнитивных функций использовалась шкала MMSE. Когнитивные нарушения (легкие и умеренные) определялись у 48 больных (96 %) основной группы и у 19 (95 %) — контрольной. Показатели изменялись от 22 до 29 баллов. В основной группе до лечения результаты по MMSE составили: Me = 26,20 ± 0,44 балла, Q1 = 24,0, Q2 = 28,2, а в группе контроля: Me = 27,10 ± 0,39 балла, Q1 = 27,0, Q2 = 28,4. Когнитивные нарушения проявлялись в снижении памяти, в том числе профессиональной, нарушении внимания, замедлении психических процессов, а также в ограничении способностей к планированию и контролю. До лечения в обеих группах отмечалось ухудшение концентрации внимания и снижение когнитивных функций. На 21-й день терапии показатель в основной группе увеличился в среднем на 2,13 балла (7,3 %) и составил 28,30 ± 0,41 балла, в контрольной группе — на 0,2 балла (0,7 %) и составил 27,30 ± 0,40 балла.
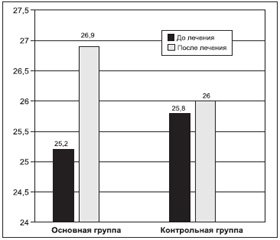
Ввиду того что наиболее чувствительной при легких когнитивных нарушениях является шкала МоСA, особое внимание было уделено анализу изменений, полученных в результате лечения, именно по разделам этой шкалы. Показатели по шкале МoСА изменялись от 21 до 29 баллов. В основной группе до лечения результаты по МоСа составили: Me = 25,20 ± 0,44 балла, Q1 = 25,2, Q2 = 22, а в группе контроля: Me = 25,80 ± 0,39 балла, Q1 = 26,0, Q2 = 28,4. Были выявлены изменения в следующих когнитивных сферах: внимание и концентрация, память, оптико–пространственные навыки, абстрактное мышление и счет. Максимально выраженными и наиболее частыми у всех обследованных больных были нарушения внимания, концентрации и памяти, а также зрительно-конструктивные навыки.
После проведения 21-дневного курса терапии препаратом Армадин отмечалось увеличение показателей когнитивных функций по данным шкалы МoСА: в основной группе Me = 26,90 ± 0,34 балла (р < 0,05), в контрольной Me = 26,00 ± 0,41 балла. Показатели в контрольной группе не достигли статистической значимости.
Таким образом, согласно оценке когнитивных функций по шкале МoСА в результате терапии препаратом Армадин отмечалась положительная динамика всех когнитивных функций — +6,75 % в основной группе и +0,78 % — в контрольной.
При исследовании у всех пациентов когнитивных вызванных потенциалов методом Р300 на аппарате «Нейрон-спектр-5» с бинауральной стимуляцией использовали: заземляющий электрод Fpz; С3- и С4-отведения, в которых регистрировался ответ; референтные электроды А1 и А2.
Всего было выполнено 100 усреднений, из которых 20 % составляли значимые стимулы, 80 % — незначимые. Частота стимуляции — 1 Гц, фильтр — 0,5–75 Гц. Значимые стимулы были в виде щелчков, имели длительность 5 мс, частоту 1000 Гц, громкость 100 дБ. Незначимые стимулы воспроизводились в виде тона, имели громкость 80 дБ, частоту 1000 Гц, длительность 100 мс.
Во время исследования была измерена латентность и амплитуда волны Р300 до и после лечения в основной и контрольной группах. После проведенной регистрации рассчитывалась разница между показателями P300 после лечения и до лечения, что составило P300 по латентности. Из табл. 2 видно, что в группе больных, которые принимали Армадин, разница Р300 между первичным и заключительным исследованием в обоих отведениях существенно уменьшилась и составила –7,19 и –7,94 мс соответственно. В контрольной группе эти показатели даже увеличились и составили +3,65 и +3,14 мс соответственно.
Для вычисления нейрогеропротекторного эффекта использовался коэффициентный показатель увеличения латентности P300 за каждый год жизни, составляющий 1,25 мс/год [8]. Нейрогеропротекторный эффект оценивался по изменению P300/1,25 мс/год.
Согласно проведенным расчетам изменение биологического возраста составило –5,752 и –6,352 года в основной группе и +2,92 и +2,512 года — в контрольной, по данным Р300 в соответствующих отведениях. Таким образом, препарат Армадин оказывал нейрогеропротекторный эффект у пациентов с хронической ишемией мозга (ДЭ ІІ ст.).
/84/84_2.jpg)
Армадин проявил себя как безопасный препарат при лечении больных с хронической ишемией мозга, обусловленной преимущественно интра– и прецеребральным атеросклерозом. По результатам применения препарата Армадин отмечены хорошая переносимость лекарственного средства, отсутствие существенных побочных эффектов при его комбинации с антигипертензивными, антитромбоцитарными и симптоматическими средствами. Пациенты, вошедшие в исследуемую группу, оценили результаты лечения как положительные: 9 больных — как «отличные», 36 — как «хорошие» и 3 — как «удовлетворительные». Два пациента не смогли оценить эффективность препарата.
Выводы
1. В результате проведенного этапного (парентерального и последующего перорального) лечения препаратом Армадин у пациентов с хронической ишемией мозга, преимущественно атеросклеротического и гипертензивного генеза (ДЭ ІІ ст.), выявлено уменьшение субъективной и объективной симптоматики дисциркуляторной энцефалопатии в виде снижения выраженности головокружения, головных болей, общего самочувствия и, как следствие, повышения качества жизни.
2. Согласно результатам оценки когнитивных функций по шкалам MMSE, МоСА после терапии препаратом Армадин отмечалась в целом положительная динамика когнитивной продуктивности, максимально выраженная в улучшении памяти, внимания и концентрации.
3. По результатам измерения латентности Р300 после проведенного 21-дневного лечения препаратом Армадин отмечалось уменьшение биологического возраста на 5,752 и 6,352 года в отведениях С3 и С4, что свидетельствует о нейрогеропротекторном эффекте препарата Армадин, который может быть рекомендован к применению в составе комплексного лечения пациентов с хронической ишемией мозга атеросклеротического и гипертензивного генеза.
4. Установлены хорошая переносимость препарата Армадин, отсутствие существенных побочных эффектов при его комбинации с другими лекарственными средствами, которые используются для лечения и профилактики хронической ишемии мозга.
Таким образом, препарат Армадин, включенный в терапию пациентов с хронической ишемией мозга, оказывает положительное влияние на показатели биологического возраста (оценка по латентности P300) и может быть рекомендован к применению в качестве нейрогеропротекторного средства.
1. Батышева Т.Т., Артемова И.Ю. и др. Хроническая ишемия мозга: механизмы развития и современное комплексное лечение // Справочник практического врача. — Т. 3. — М., 2004. — С. 18–23.
2. Болдырев А.А. Окислительный стресс и мозг // Соросовский образовательный журнал. — 2001. — № 7. — С. 21–27.
3. Гомазков О.А. Старение мозга и нейротрофическая терапия. — М.: ИКАР, 2011. — 178 с.
4. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001.
5. Маркин С.П. Современный подход к диагностике и лечению хронической ишемии мозга // Русский медицинский журнал. Неврология и психиатрия. — 2010. — № 8. — С. 445.
6. Федорова Т.Н. Окислительный стресс и защита головного мозга от ишемических повреждений: Дис… д–ра биол. наук. — М., 2004.
7. Challenging age–old ideas about stroke // Lancet Neurol. — 2012. — Vol. 11 (12). — 1013.
8. Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. — М.: МЕДпресс-информ, 2003. — С. 126–128.

/83/83.jpg)
/83/83_2.jpg)
/84/84.jpg)