Международный неврологический журнал 6 (68) 2014
Вернуться к номеру
Фактори ризику клінічної активності рецидивуючо-ремітуючого розсіяного склерозу та методи впливу на них
Авторы: Кобись Т.О. - Київський міський центр розсіяного склерозу; Київська міська клінічна лікарня № 4
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Наведені дані 9-річного спостереження за пацієнтами з рецидивуючо-ремітуючим розсіяним склерозом (РРРС). Визначені нейровізуалізаційні фактори впливу на клінічні ознаки активності перебігу захворювання. Вірогідне значення мають кількість Т2-осередків > 3 мм, Gd+-осередків та рівень співвідношення NAA/Cr. Засоби патогенетичної терапії вірогідно впливають на клінічні і МРТ-ознаки активності РРРС, зменшуючи приріст частоти загострень, кількість Т2- та Gd+-осередків. Збільшення співвідношення NAA/Cr на тлі лікування Тізабрі підтверджує нейропротективний ефект препарату.
Представлены данные 9-летнего наблюдения за пациентами с рецидивирующе-ремиттирующим рассеянным склерозом (РРРС). Определены нейровизуализационные факторы влияния на клинические признаки активности течения заболевания. Достоверное значение имеют количество Т2-очагов > 3 мм, Gd+-очагов и уровень соотношения NAA/Cr. Средства патогенетической терапии достоверно влияют на клинические и МРТ-признаки активности РРРС, уменьшая прирост частоты обострений, количество Т2- и Gd+-очагов. Повышение уровня соотношения NAA/Cr на фоне лечения Тизабри подтверждает нейропротективный эффект препарата.
The data of 9-year follow-up of patients with relapsing-remitting multiple sclerosis (RRMS) are provided. We determined the neuroimaging factors of influence on the clinical signs of the disease activity. The number of T2-lesions > 3 mm, Gd+-lesions and the NAA/Cr ratio are significantly important. Means of pathogenetic therapy have a significant impact on clinical and MRI signs of RRMS activity, reducing the increase in the incidence of exacerbations, the number of T2- and Gd+-lesions. Increased NAA/Cr ratio during treatment with Tysabri confirms the neuroprotective effect of the drug.
клінічна активність захворювання, осередки, співвідношення NAA/Cr, Тізабрі.
клиническая активность заболевания, очаги, соотношение NAA/Cr, Тизабри.
clinical activity of the disease, lesions, NAA/Cr ratio, Tysabri.
Статья опубликована на с. 38-44
Розсіяний склероз (РС) — хронічне прогресуюче автоімунне захворювання центральної нервової системи. Головним критерієм діагностики розсіяного склерозу є дисемінація (розсіювання) симптомів у просторі й часі. Під цим терміном розуміють хронічний хвилеподібний перебіг захворювання із включенням у патологічний процес декількох провідникових систем. Складно передбачити тривалість ремісій і частоту загострень, ступінь відновлення функцій і швидкість прогресування необоротних уражень [4, 15]. Різні темпи прогресування РС і терміни досягнення вираженої інвалідизації обумовлюють інтерес до подальшого вивчення можливих прогностичних факторів активності перебігу захворювання на підставі комплексного клініко-нейровізуалізаційного дослідження хворих.
Дані магнітно-резонансної томографії (МРТ) сприяють розумінню патофізіологічних змін при РС, що призводять до клінічних проявів захворювання. Відомо, що активність демієлінізуючого процесу за даними МРТ може в 5–10 разів перевищувати клінічну [1, 3–6, 14]. У літературі давно обговорюється питання про існування дисоціації клінічних та МРТ-проявів РС. Так, нові Т2-осередки, діагностовані методом МРТ, часто не супроводжуються клінічними симптомами. З іншого боку, клінічні симптоми загострення можуть спостерігатися без змін нейровізуалізаційної картини [15]. Існує декілька варіантів пояснення так званого клініко-радіологічного парадоксу, тобто невідповідності картини МРТ клінічним проявам захворювання. Деякі дослідники [15] так пояснюють цей парадокс:
— недоліки існуючих клінічних та МРТ-досліджень;
— наявність стратегічних (тих, що клінічно проявляються) і нестратегічних вогнищ;
— подвійна роль імунної системи: захист і пошкодження;
— роль нейродегенеративного процесу в прогресуванні захворювання;
— аномалії білої і сірої речовини, що виглядають нормально;
— роль адаптації й реорганізації в компенсації пошкоджень, викликаних захворюванням.
Усе це підтверджує існування інших патогенетичних механізмів, які обумовлюють активність і прогресування захворювання. Однією з нейровізуалізаційних методик, що дозволяє пояснити наростання неврологічного дефіциту під час клінічного погіршення, є магнітно-резонансна спектроскопія [9, 10, 12–14]. Цей метод дозволяє виявити зміни рівня церебральних метаболітів в активних і неактивних вогнищах, інтактній білій і сірій речовині головного мозку, на що вказує зниження вже на ранніх стадіях захворювання піку основного церебрального метаболіту, так званого нейронального маркера NAA.
Лікування РС завжди вважалося надзвичайно важливою проблемою неврології, воно радикально змінилося з 1993 року, коли був зареєстрований перший імуномодулюючий препарат для лікування РС — бетаферон. З того часу спектр лікарських засобів превентивної терапії РС став надзвичайно широким. На сьогодні існує 10 схвалених FDA препаратів для лікування РС. Вони не є панацеєю, але їх застосування, як свідчать численні рандомізовані дослідження, може змінити перебіг хвороби, зменшити кількість і тяжкість рецидивів, сповільнити прогресування захворювання за рахунок зменшення числа нових уражень нервової системи [2, 7, 8]. Однією з проблем як для лікаря, так і для пацієнта є прийняття рішення про необхідність патогенетичного лікування з оцінкою його ефективності. Це особливо актуально для України, тому що патогенетичне лікування в більшості випадків є ще й фінансовою проблемою для пацієнтів.
Мета роботи: визначення нейровізуалізаційних факторів ризику клінічної активності перебігу рецидивуючо-ремітуючого РС (РРРС) з оцінкою впливу на них засобів патогенетичної терапії.
Матеріали і методи
Обстежені 180 хворих (88 жінок і 92 чоловіки) з РРРС, які спостерігалися в Київському міському центрі розсіяного склерозу на базі міської клінічної лікарні № 4 протягом 2005–2013 рр. Діагноз РС встановлювався на підставі критеріїв Мак-Дональда (2005). Вираженість неврологічних симптомів оцінювали за шкалою EDSS (Kurtzke, 1983).
МР-зображення головного мозку отримані на МР-томографі GE, Signa Excite HD 1,5 Т медичної клініки «Борис» із використанням таких імпульсних послідовностей: швидка спінова луна — FSE, спінова луна — SE, Т2-Flair, а також Dual Echo — для зображень, зважених за Т2- і Т1-протонною щільністю. Оцінювали кількість гіперінтенсивних вогнищ на Т2-зважених зображеннях, у тому числі кількість вогнищ розміром більше ніж 3 мм, кількість Т1-вогнищ, Gd+-вогнищ. Оцінка кількості вогнищ на МР-томограмах проводилася на всіх отриманих зрізах, а не тільки в ділянці інтересу (ДІ), що використовували для подальшого протонного магнітно-резонансного спектрального аналізу. Спектри були отримані за допомогою імпульсної послідовності SVS STEAM із такими параметрами збору даних: ТР = 1500 мс, ТІ = 140 мс, Тм = 13 мс, об’єм ділянки, у якій отримують спектр (ДІ): VRДI = 2 × 2 × 2 cм3.
Статистичну обробку отриманих даних проводили з використанням програмного пакета Statistiсa 10.0 (StatSoft, Inc, США) і Microsoft® Excel 2010 (Microsoft Corporation, США). Для графічного зображення даних використовувався редактор Microsoft Graph (©Microsoft Corporation, версія 2010).
Результати та їх обговорення
Основною клінічною характеристикою активності перебігу РРРС є частота загострень. У групі спостереження були хворі з частотою загострень від 0,39 до 6 на рік. Середня частота загострень — 1,63 ± 0,12 на рік (min — 0,3; max — 6).
Середній рівень інвалідизації за шкалою EDSS був 3,27 ± 0,11 бала (від 1.5 до 5.5 бала).
Для визначення прогностичних факторів клінічної активності захворювання хворих розділили на три підгрупи залежно від частоти загострень (табл. 1).
Першу підгрупу з високим ступенем клінічної активності захворювання становив 61 пацієнт із високою частотою загострень (від 2 до 6 на рік). Другу підгрупу із середнім рівнем активності захворювання (від 1 до 1,7 загострення на рік) — 66 пацієнтів із РРРС. У третю підгрупу ввійшли 53 пацієнти з низьким рівнем активності захворювання (від 0,3 до 0,9 загострення на рік).
У кожній із досліджуваних підгруп визначали середню кількість Т2-осередків, у тому числі Т2-осередків розміром понад 3 мм, Т1- і Gd+-осередків. Загальне число Т2-осередків статистично вірогідно відрізнялось у кожній із досліджуваних підгруп і становило від 18,84 ± 6,84 до 15,62 ± 5,79 (p < 0,02). Але воно було більшим у групі з меншим числом загострень і неактивним перебігом захворювання і меншим — у групі пацієнтів з 2 і більше загостреннями на рік. Що стосується середньої кількості Т2-осередків розміром понад 3 мм у групах із різною кількістю загострень, то вона була статистично вірогідно більшою у хворих із клінічно активнішим перебігом: 11,24 ± 4,9 у групі з 2 і більше загостреннями на рік проти 8,63 ± 3,8 — у групі, де було менше одного загострення на рік (p < 0,009). Ці результати підтверджують те, що клінічні ознаки загострення не завжди спостерігаються в пацієнтів, у яких прогресує захворювання, і поява нових дрібних осередків часто не має клінічного наслідку. Вірогідної різниці кількості Т1-осередків у підгрупах із різною частотою загострень не було виявлено. Високий рівень вірогідності виявили при порівнянні значень середньої кількості Gd+-осередків у трьох підгрупах із різною частотою загострень. У підгрупі з високою частотою загострень середнє число Gd+-осередків становило 2,91 ± 2,09, із низькою — 0,77 ± 1,04 (p < 0,0001).
Для виявлення прогностичного значення клініко-параклінічних факторів активності захворювання у хворих із РРРС ми оцінювали кумулятивну частку відсутності рецидивів у пацієнтів за методом Каплана — Майєра з оцінкою критерію Фішера.
Одним із факторів ризику більш активного перебігу при РРРС є наявність > 9 вогнищ Т2 > 3 мм (рис. 1). При наявності > 9 вогнищ Т2 > 3 мм на 3-му році спостереження у 65,1 % пацієнтів є ризик виникнення наступного загострення, у той час як при кількості вогнищ Т2 > 3 мм число таких пацієнтів зменшується більше ніж у 2 рази (25,7 %, F = 1,780; p = 0,00006).
Більш активний перебіг захворювання з підвищенням ризику виникнення загострення пов’язаний із високою МРТ-активністю — кількістю Gd+-осередків (рис. 2). При наявності ≥ 3 Gd+-осередків ризик виникнення загострення зростає більше ніж у 2 рази (F = 1,99; p = 0,0002).
Кумулятивна частка хворих без загострень за період спостереження при відсутності або наявності менше ніж 3 Gd+-осередків становила 58,2 %, при наявності ≥ 3 Gd+-осередків вона зменшувалась до 25,6 %.
При аналізі клінічної активності захворювання має значення швидкість прогресування інвалідизації за шкалою EDSS. У випадках, коли в пацієнтів виникають часті загострення з повною редукцією неврологічних розладів, пацієнти тривалий час залишаються неінвалідизованими. Частіше це спостерігається при атаках захворювання у вигляді чутливих розладів. Хворі залишаються повністю амбулаторними з мінімальним або помірним неврологічним дефіцитом при оцінці за шкалою EDSS до 3.0 бала. За період спостереження при кількості Т2-осередків менше ніж 20 47 % пацієнтів не досягли оцінки за шкалою EDSS 3.0 бала, при збільшенні числа вогнищ Т2 понад 20 кількість таких пацієнтів становила 13,7 % (F = 2,08; p = 0,00008).
Проведено аналіз впливу рівня церебральних метаболітів на швидкість прогресування інвалідизації. Виявлено статистично вірогідну різницю швидкості досягнення оцінки за шкалою EDSS 3.0 бала залежно від співвідношення NAA/Cr, що є індикатором нейродегенеративних процесів, за період спостереження (F = 3,38; p = 0,00001) (рис. 3).
За період спостереження при збереженні рівня NAA/Cr ≥ 2,5 кумулятивна частка пацієнтів з оцінкою за шкалою EDSS менше ніж 3.0 бала становить 67,2 %. При зниженні рівня NAA/Cr < 2,5 швидкість прогресування інвалідизації зростає, частка пацієнтів з оцінкою за шкалою EDSS менше ніж 3.0 бала зменшується втричі і становить 22,1 %.
Таким чином, на підставі отриманих результатів можна стверджувати, що факторами високої клінічної активності захворювання, яка визначається частотою загострень у хворих із РРРС, є кількість Т2-осередків розмірами понад 3 мм та Gd+-осередків. Швидкість прогресування інвалідизації за шкалою EDSS залежить від кількості Т2-осередків та рівня співвідношення NAA/Cr. Визначені нейровізуалізаційні фактори клінічної активності перебігу РРРС можуть бути критеріями ефективності патогенетичного лікування.
Ми проаналізували вплив різних засобів патогенетичної терапії на вказані фактори ризику активності захворювання. Протягом двох років проведено спостереження за 180 хворими на РРРС, які отримували патогенетичне превентивне лікування. Залежно від препарату, який отримували пацієнти, вони були розподілені на групи. 1-ша група — 28 хворих, які приймали інтерферон бета-1а 30 мкг/мл (Авонекс) в/м, 2-га група — 24 пацієнти, які отримували глатирамера ацетат 20 мг (Копаксон) п/ш, 3-тя група — 29 пацієнтів, які приймали інтерферон бета-1а 44 мкг/мл (Ребіф) п/ш, 4-та група — 20 пацієнтів, які отримували наталізумаб (Тізабрі) 15 мл в/в краплинно. У 5-ту групу ввійшли 79 пацієнтів із РРРС, які не отримували патогенетичного превентивного лікування протягом усього періоду спостереження. Показником клінічної ефективності лікування вважали частоту загострень за рік. Через 12, 24 місяці визначали приріст частоти загострень, відсоток хворих без загострень на тлі патогенетичного лікування і без застосування превентивної терапії. Протягом 24 місяців було оцінено частоту нових загострень. Вона була найбільшою в групі пацієнтів, які не отримували патогенетичного лікування, і становила 0,2 на рік протягом перших 12 місяців і 0,28 на рік — протягом наступних 12 місяців (рис. 4). У пацієнтів, які отримували Авонекс і Тізабрі, нові загострення спостерігались лише протягом першого року спостереження і становили відповідно 0,12 і 0,1 на рік. Протягом другого року спостереження в цих пацієнтів загострень не було. У групі пацієнтів, які отримували Ребіф, частота нових загострень протягом першого року була 0,1 на рік, протягом другого — 0,07, у групі Копаксону — відповідно 0,14 і 0,03 на рік.
При аналізі кількості пацієнтів без загострень отримали такі дані. Протягом першого року спостереження в групі пацієнтів без патогенетичного лікування загострень не було в 68,1 % пацієнтів, протягом другого року їх кількість збільшилась до 69,7 % (рис. 5). У 1-й групі (Авонекс) протягом першого року не було загострень у 83,4 % пацієнтів, протягом другого року — у 100 %. У 2-й групі (Копаксон) не відмічалося загострень протягом першого року спостереження у 78,1 % пацієнтів, протягом 2-го року — у 95,3 %. У 3-й групі (Ребіф) протягом як першого, так і другого року не було загострень у 83,1 % пацієнтів. У 4-й групі (Тізабрі) протягом першого року спостереження не було загострень у 90 % пацієнтів, протягом другого року — у 100 %.
Проведений аналіз впливу засобів патогенетичного лікування на МРТ-прояви активності РРРС. Враховували частку пацієнтів (%) у кожній групі лікування, у яких кількість Т2-осередків не змінювалася, зменшувалась або зростала. У групах лікування засобами превентивної терапії (інтерферон бета-1а 30 мкг/мл (Авонекс) в/м, глатирамера ацетат 20 мг (Копаксон) п/ш, інтерферон бета-1а 44 мкг/мл (Ребіф) п/ш, наталізумаб (Тізабрі) 15 мл в/в краплинно) частка пацієнтів, у яких кількість Т2-осередків не змінювалася протягом 24 міс., становила відповідно 64; 69; 56 і 25 % (рис. 6). У групі пацієнтів, які не отримували патогенетичної терапії, таких було 27 %. Суттєвий лікувальний ефект у групі лікування пацієнтів, які отримували наталізумаб (Тізабрі) 15 мл в/в краплинно, підтверджений зменшенням кількості Т2-вогнищ. Частка таких пацієнтів — 60 %. У 1, 2, 3-й групах лікування, які отримували патогенетичну терапію першої лінії, таких пацієнтів було 21; 4 і 10 % відповідно. Серед хворих, які не отримували патогенетичного лікування, у 6 % випадків кількість Т2-вогнищ зменшилась.
/42/42_2.jpg)
Суттєве збільшення нових Т2-осередків виявлено в групі пацієнтів, які не отримували патогенетичного лікування, — 67 %. Найменше пацієнтів із новими Т2-осередками було в групі лікування наталізумабом (4-та група) — 3 %. У 1, 2 і 3-й групі частка пацієнтів із новими Т2-вогнищами відповідно становила 15; 18 і 22 %.
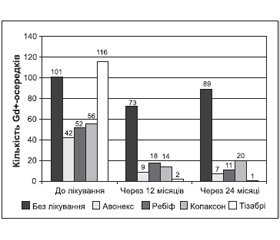
Оцінено протизапальний ефект патогенетичної терапії за часткою хворих (%) із виявленими Gd+-осередками протягом 24 міс. спостереження. Найбільший лікувальний ефект отримано при застосуванні наталізумабу 15 мл в/в краплинно: лише в 10 % пацієнтів було виявлено Gd+-осередки. Найбільше число пацієнтів із Gd+-осередками (54 %) виявлено в групі пацієнтів, які не отримували патогенетичного лікування (рис. 7). Абсолютна кількість Gd+-осередків у 1–5-й досліджуваній групі до лікування становила 101; 42; 52; 56; 116 осередків відповідно, тобто найбільшою була в групі без патогенетичного лікування і в групі пацієнтів, які отримували наталізумаб (рис. 8). Але середнє число Gd+-осередків до лікування було найбільшим у групі пацієнтів, які отримували наталізумаб, — 5,8 ± 0,7, що відповідає критеріям включення до лікування препаратами другої лінії, а в групі пацієнтів, які не отримували патогенетичного лікування, — 1,4 ± 0,7. Середнє число Gd+-осередків у пацієнтів 1–3-ї груп лікування, які отримували патогенетичну терапію 1-ї лінії, становило 1,8 ± 0,7; 2,3 ± 0,7; 2,5 ± 0,7 відповідно. Абсолютна кількість Gd+-осередків зменшилась у кожній із досліджуваних груп (1–5-й) відповідно на 27; 78; 65; 75 і 98 % через 12 місяців спостереження на тлі лікування. У наступні 12 місяців у групі без патогенетичного лікування та в пацієнтів, які отримували глатирамера ацетат, кількість Gd+-осередків збільшилася відповідно на 22 і 30 %. У групах, які отримували інтерферон бета-1а 30 мкг, інтерферон бета-1а 44 мкг та наталізумаб, зменшилась на 27; 39 і 50 % відповідно.
Проведено аналіз нейропротективного ефекту засобів патогенетичної терапії на підставі вивчення динаміки рівня співвідношення NAA/Cr. Cтатистично вірогідними було зменшення рівня співвідношення NAA/Cr в групі пацієнтів, які не отримували патогенетичного лікування, з 2,13 до 2,02 через 12 місяців спостереження і до 1,94 — у наступні 12 місяців (рис. 9). Ці дані відповідають наведеним у літературі, де вказується, що рівень цього показника у хворих на РС може зменшуватися щорічно на 4–5 %. Також за нашими результатами виявлено нейропротективний ефект лікування наталізумабом, що підтвердило статистично вірогідне збільшення співвідношення NAA/Cr з 2,14 до 2,47 протягом першого року і з 2,47 до 2,67 — протягом другого року спостереження.
Висновки
1. Нейровізуалізаційними факторами впливу на клінічні ознаки активності перебігу РРРС є кількість Т2-осередків розміром понад 3 мм та Gd+-осередків.
2. Серед факторів, що визначають швидкість прогресування інвалідизації за методом Каплана — Майєра, є загальна кількість Т2-осередків та співвідношення NAA/Cr.
3. Засоби патогенетичної терапії РРРС вірогідно зменшують частоту нових загострень і збільшують частку пацієнтів без загострень із зростанням тривалості лікування.
4. Клінічний ефект патогенетичного лікування пов’язаний з вірогідним зменшенням загальної кількості Т2-осередків та Gd+-осередків.
5. Вірогідне збільшення співвідношення NAA/Cr протягом двох років лікування підтверджує нейропротективний ефект терапії наталізумабом.
1. Волошина Н.П., Гапонов И.К. Возможности магнитно-резонансной томографии в диагностике и прогнозе течения рассеянного склероза в зависимости от пола и возраста больных // Український вісник психоневрології. — 2010. — Т. 2, № 3(64). — С. 19–23.
2. Демина Т.Л., Хачанова Н.В., Давыденковская М.В. Терапия бета-интерфероном после первого клинического эпизода демиелинизации при рассеянном склерозе // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2006. — Т. 106, № 3. — С. 15–19.
3. Cadavid D., Kim S., Peng B. Clinical cosequences of MRI activity in treatyd multiple sclerosis // MS Journal. — 2011. —Vol. 17, № 1. — P. 32–42.
4. Fillipi M., Rocca M.A., Arnold D. L. et al. EFNS guidlines on the use of neuroimaging in the management of multiple sclerosis // Eur. J. Neurol. — 2008. — Vol. 131. — Р. 1444–1452.
5. Fisnaci K.L., Brex P.A., Altmann D.R. Disability and T2 MRI lesions: 20-year follow-up of patients with relapse onset of multiple sclerosis // Brain. — 2005. — Vol. 128. — Р. 2675–2688.
6. Inglese M., Grossman R.I., Filippi M. Magnetic Resonance Imaging Monitoring of Multiple Sclerosis Lesion Evolution // J. of Neuroimaging. — 2006. — Vol. 15(4 Suppl.). — 22S–29S.
7. Khan O., Bao F., Shah M. Effekt of disease-modifying therapies on brain volume in relapsing-remitting multiple sclerosis: results of five-years brain MRI study // J. Neurol. Sci. — 2012. — Vol. 312. — Р. 7–12.
8. Miller A., Aidan N., Tzunz-Henig N. Translation toards personalized medicine in Multiple Sclerosis // J. of the Neurolog. Sc. — 2012. — Vol. 274. — P. 8–75.
9. Madera I., Rosera W., Kapposa L. Serial Proton MR Spectroscopy of Contrast-enhancing Multiple Sclerosis Plaques: Absolute Metabolic Values over 2 Years during a Clinical Pharmacological Study // AJNR. — 2000. — Vol. 21. — Р. 1220–1227.
10. Mostert J.P., Blauw Y., Koch M.W. et al. Reproducibility over a 1-month period of 1H-MR spectroscopic imaging NAA/Cr ratios in clinically stabіle multiple sclerosis patients // Eur. Radiol. — 2008. — Vol. 18(8). — P. 1736–1740.
11. Mostert J.P., Sijens P.E., Oudkerk M., De Keyser J. Fluoxetine increases cerebral white matter NAA/Cr ratio in patients with multiple sclerosis // Neurosc. Lett. — 2006. — Vol. 10. — P. 402.
12. Narayana P.A. Magnetic Resonance Spectroscopy in the Monitoring of Multiple Sclerosis // J. Neuroimaging. — 2005. — Vol. 15(4 Suppl.). — Р. 46S–57S.
13. Sijens P.E., Mostert J.P., Oudkerk M., De Keyser J. HMR spectroscopy of the brain in multiple sclerosis subtypes with analysis of the metabolite concentrations in gray and white matter: initial findings // Eur. Radiol. — 2006. — Vol. 16(2). — P. 489–495.
14. Simon J.H. MRI outcomes in the diagnosis and disease course of multiple sclerosis // Handb Clin. Neurol. — 2014. — Vol. 122. — Р. 405–425.
15. Ziemsenn T., Tintore M. A new era in multiple sclerosis: new consideration for therapeutic approaches. — Elsevier, 2010. — 94 p.

/39/39.jpg)
/40/40.jpg)
/41/41.jpg)
/42/42.jpg)
/43/43.jpg)