Международный неврологический журнал 6 (68) 2014
Вернуться к номеру
Інсульт та біль у плечі
Авторы: Луц В.В. - Мукачівська центральна районна лікарня; Орос М.М. - Ужгородський національний університет
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Проведене дослідження показало, що біль у плечі є частим ускладненням інсульту, особливо в пацієнтів із геміплегією або вираженим геміпарезом. Біль у плечі спостерігався в кожного п’ятого пацієнта, який переніс інсульт (19,9 %).
Набряк кисті може служити предиктором розвитку больового синдрому в ураженій руці, а регрес набряку корелює з регресом больового синдрому.
Прийом препарату Ксефокам у дозі 16 мг на добу пацієнтами, які перенесли інсульт, з першими проявами болю в плечі, що супроводжуються набряком руки, вірогідно покращує стан пацієнта упродовж 2 тижнів і зменшує ризик розвитку хронічного больового синдрому в плечі. Тому прийом Ксефокаму, адекватна фізіотерапія, правильний догляд і своєчасна реабілітація є основними методами лікування больового синдрому в плечі в цих пацієнтів.
Проведенное исследование показало, что боль в плече является частым осложнением инсульта, особенно у пациентов с гемиплегией или выраженным гемипарезом. Боль в плече наблюдалась у каждого пятого пациента, перенесшего инсульт (19,9 %).
Отек кисти может служить предиктором развития болевого синдрома в пораженной руке, а регресс отека коррелирует с регрессом болевого синдрома.
Прием препарата Ксефокам в дозе 16 мг в сутки пациентами, пренесшими инсульт, с первыми проявлениями боли в плече, сопровождающимися отеком руки, достоверно улучшает состояние пациента в течение 2 недель и уменьшает риск развития хронического болевого синдрома в плече. Поэтому прием Ксефокама, адекватная физиотерапия, правильный уход и своевременная реабилитация являются основными методами лечения болевого синдрома в плече у данных пациентов.
The study showed that the shoulder pain is a common complication of stroke, especially in patients with hemiplegia or marked hemiparesis. Shoulder pain was observed in each fifth stroke patients (19.9 %).
Hand swelling can serve as a predictor of pain syndrome in the affected hand, and regression of swelling is correlated with regression of pain syndrome.
Use of Xefocam in a dose of 16 mg per day by stroke patients with the first manifestations of shoulder pain, accompanied by hand swelling, significantly improves the condition of the patient within 2 weeks, and reduces the risk of chronic pain syndrome in the shoulder. Therefore use of Xefocam, adequate physiotherapy, proper care and timely rehabilitation are the main methods of treatment for pain syndrome in the shoulder in these patients.
інсульт, біль у плечі, Ксефокам.
инсульт, боль в плече, Ксефокам.
stroke, shoulder pain, Xefocam.
Статья опубликована на с. 47-51
Актуальність
Найбільш часто у хворих із постінсультними парезами в перші 4–5 тижнів після інсульту виникає синдром больового плеча. Крім випадків ураження плечового суглоба, спостерігаються зміни й інших суглобів (артропатії) в середньому в 15 % хворих із постінсультними геміпарезами [23, 25]. Локалізуються артропатії переважно в суглобах пальців руки і променево-зап’ястковому суглобі, у 45 % хворих з артропатіями вони поширюються на ліктьовий і плечовий суглоби, у 22 % — на суглоби паретичної ноги. Розвиваються артропатії в середньому протягом перших 2 місяців після інсульту.
Біль у плечі є частим ускладненням після інсульту, зареєстрована захворюваність коливається від 9 до 64 % [1–6]. Кілька досліджень показали, що частково втрачена моторна функція руки є предиктором болю в плечі після інсульту [1–3, 6–7]. Два дослідження (одне проводилося через 6 місяців, друге — через 16 місяців після інсульту) виявили високий відсоток болю в плечі через 2 тижні після інсульту (55 і 32 % відповідно) [1, 2].
В одному дослідженні описане порушення нормальної функції й уразливість паретичного плеча. Розширений діапазон руху руки контролюється складною системою зчленувань, що залежать від м’язової координації та стабілізації опорно-рухового апарату. Втрата стабілізації м’язів плечового суглоба створює сприятливі умови для ураження м’яких тканин та зв’язок [7]. Правильна терапевтична тактика ведення пацієнта після інсульту з урахуванням можливих наслідків щодо плечового суглоба може зменшити ймовірність виникнення хронічного болю в плечі [9]. Ультразвукове дослідження показало, що пацієнти після перенесеного гострого інсульту з поганим функціонуванням рук більше схильні до травм м’яких тканин плеча під час реабілітації [10]. Дослідження з використанням магнітно-резонансної томографії встановило наявність посттравматичного капсуліту як можливої причини болю в плечі після інсульту [12, 13]. Основні ознаки й симптоми останнього включають біль і значне зменшення обсягу рухів у плечі, зап’ястку та кисті. Капсуліт зазвичай розвивається протягом 1–6 місяців після інсульту з болем і втратою діапазону руху спочатку в плечі, а потім — у дистальній частині кінцівки. Синдром має три послідовні етапи: I — гострий, II — дистрофічний і III — атрофічний. Поширеність болю в плечі — 12,5–27 % у пацієнтів з інсультом. Вважається, що розвиток синдрому пов’язаний із порушенням біомеханіки геміплегічного плеча. Стабільність суглоба значно змінюється у зв’язку з парезом або паралічем м’язів плечового поясу, що призводить до часткового підвивиху головки плечової кістки. Повторні мікротравми плечового суглоба можуть викликати хронічний біль та ініціювати розвиток ненормальної сенсорно-симпатичної рефлекторної дуги, що призводить до сенсибілізації нейронів у задньому розі спинного мозку; цей стан може змінити механізми обробки сенсорних стимулів. Діагноз синдрому ґрунтується на клінічній практиці. Трифазна сцинтиграфія кісток вважається найбільш корисним додатковим діагностичним тестом. Лікування синдрому плече — рука включає використання стероїдів. Важливою є роль належної фізичної терапії в покращенні результатів лікування, а також у профілактиці цього синдрому. Враховуючи той факт, що багато хто з пацієнтів, які перенесли інсульт, можуть мати протипоказання до терапії стероїдами, важливим є використання інших методів ефективного лікування. Вважається, що своєчасне лікування раннього болю в плечі (що виникає через 1–2 тижні після інсульту) є одним з основних методів профілактики хронізації больового синдрому та виникнення синдрому плече — рука. Ряд дослідників вважає, що наявність набряку кисті з ураженого боку є предиктором виникнення хронічного больового синдрому в плечі [7, 10, 12, 20]. Тому є необхідність активно проводити профілактику саме в цієї групи пацієнтів.
Метою нашого дослідження було встановлення частоти виникнення больового синдрому в пацієнтів, які перенесли інсульт, виявлення предикторів та розробка методів профілактики виникнення хронічного больового синдрому у плечі в цій групі хворих.
Матеріали та методи
Нами були обстежені 562 пацієнти, які перебували на лікуванні у відділенні судинної неврології Мукачівської ЦРЛ із діагнозом інсульту з жовтня 2012 по червень 2014 року. Основним критерієм включення в дослідження був парез руки в пацієнта, який переніс інсульт. Рухова активність та функція руки оцінювалися за модифікованою шкалою M-MAS UAS-95, що була розроблена у шведському університеті міста Упсала (0 балів — відсутність рухів, 5 балів — нормальна функція) [14, 15]. Пацієнти були включені в дослідження, якщо в них оцінка функції руки була низькою (за М-MAS UAS-95 відповідно 0–2 бали), тобто при стартовій позиції на спині пацієнт не може витягнути руку догори, зігнути її в ліктьовому суглобі і свідомо торкнутися лоба [15].
Критерії виключення пацієнтів з дослідження: відсутність болю в плечі та розвиток у пацієнта центрального болю (таламічного). Із 562 пацієнтів тільки 112 відповідали критеріям включення. Крім того, ще сімнадцять пацієнтів були виключені через такі причини: труднощі в оцінках (n = 2), раніше отримане травматичне пошкодження плеча з сильним болем (n = 1), раніше виражений парез руки з приводу іншого діагнозу (n = 1), смерть до першого оцінювання (n = 10) та ін.
У 112 пацієнтів, які залишилися в дослідженні, біль у плечі виникав протягом 4 тижнів після інсульту.
Аналіз пацієнтів проводився за такими критеріями: вік, стать, дата початку інсульту, постраждала півкуля за результатами комп’ютерної томографії та/або клінічними симптомами. Функціональна класифікація (Functional ambulation classification — FAC) була використана для оцінювання ходьби (0 балів — пацієнт не ходить, 5 балів — пересувається довільно). Тяжкість інсульту на початку була виміряна за допомогою шкали інсульта Національного інституту здоров’я США (NIHSS) із високим ступенем надійності та валідності [19, 20]. NIHSS включає 11 пунктів: рівень свідомості, горизонтального переміщення очей, тест поля зору, параліч лицьового нерва, рухи руки, рухи ніг, атаксія, мова, неуважність тощо. Під час перебування в лікарні дослідження виконувалися щоденно й дані записувалися кожні 2 тижні після початку інсульту і при виписці з лікарні. Були зареєстровані зміни у функції руки (М-MAS UAS-95), ходьбі (FAC), наявність і початок набряку руки, наявність нижнього підвивиху в плечовому суглобі. Також було зазначено, чи потрібна пацієнту допомога при одяганні верхньої частини тіла, чи потрібна допомога з особистої гігієни в ліжку і чи використовували хворі ліфт при пересуванні на один поверх. При болі в плечі клінічні фізіотерапевти просили вказати дату початку болю, можливу причину, початок набряку руки та початок прийому медикаментів, що впливають на запалення та біль.
Середній вік хворих у досліджуваній групі — 69,0 ± 1,2 року. Серед 112 пацієнтів було 67 жінок (59,9 %) і 45 чоловіків (40,1 %) (рис. 1).
/48/48.jpg)
Обговорення результатів
Нами було проведено аналіз тривалості перебування у стаціонарі 112 пацієнтів із болем у плечі та 450 пацієнтів без больового синдрому. Середня тривалість перебування в стаціонарі становила 29 днів для пацієнтів із болем у плечі та 22 дні — для пацієнтів без нього. Обидві групи також значно відрізнялися (р = 0,02) за типом інсульту: геморагічний інсульт був поширенішим у групі пацієнтів із болем в плечі (24 %), ніж у групі без нього (5 %).
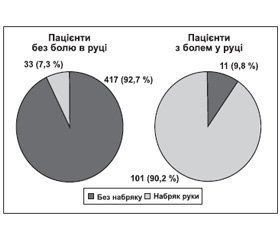
У пацієнтів, які перенесли інсульт та мали геміплегію чи геміпарез, виникає набряк руки на боці парезу чи геміплегії. Набряк руки та кисті ми виявили у 134 пацієнтів досліджуваної групи. Причому набряк руки було виявлено в 101 пацієнта з тих, у кого в подальшому розвинувся біль у плечі, та в 33 пацієнтів без больового синдрому (рис. 2).
/49/49.jpg)
Аналізуючи рис. 2, бачимо, що набряк кінцівки мали 90,2 % пацієнтів, у яких виник біль у руці, тоді як у групі пацієнтів, у яких не розвинувся больовий синдром у руці, набряк кінцівки було зафіксовано тільки в 7,3 % обстежуваних осіб. Тобто ми можемо стверджувати, що наявність набряку на ураженій кінцівці є клінічним предиктором виникнення хронічного больового синдрому в цій же кінцівці.
Для лікування больового синдрому в плечі та ефективної його профілактики на даному етапі використовують ряд фізіотерапевтичних та медикаментозних методів, серед яких ми як протибольове лікування використовували методи знеболюючої електроімпульсної терапії: черезшкірну стимуляційну аналгезію, діодинамічні синусоїдально-модульовані струми, а також імпульсну магнітотерапію. Для поліпшення стану трофіки суглобів та оточуючих їх тканин застосовується теплолікування (парафіно- або озокеритотерапія), вакуумний або турбулентний масаж, анаболічні гормони (ретаболіл 10 мл внутрішньом’язово 1 раз на 7–10 днів, курс 5–6 ін’єкцій). Кращі результати спостерігаються в тих випадках, коли лікування проводиться на самому початку розвитку больового синдрому, коли з’являється невелика припухлість в ділянці суглоба, нерізка болючість при рухах (активних і пасивних) і при натисненні. Постає питання ефективності використання нестероїдних протизапальних препаратів (НПЗП) у цієї групи пацієнтів. Із літературних даних відомо, що НПЗП є препаратами вибору (рівень А) в пацієнтів із болем у суглобах та спині. Для лікування болю в плечі у цієї групи пацієнтів, окрім описаних вище фізіотерапевтичних методик, ми використовували лорноксикам (Ксефокам)перорально у дозі 16 мг на добу. Лорноксикам, як і інші препарати цієї групи, пригнічує синтез простагландинів шляхом інгібування циклооксигенази (ЦОГ), проте не впливає на 5-ліпоксигеназу. Співвідношення потенціалу інгібування ЦОГ-1 і -2 для лорноксикаму, за даними Byzav P. і співавторів (2009), становить 1. Також, як свідчать результати досліджень, дія цього препарату прирівнюється до дії морфіну і трамадолу в купіруванні постопераційного болю після гінекологічних або ортопедичних втручань та є такою ж ефективною, як інші НПЗП в усуненні симптомів остеоартрозу, ревматоїдного артриту, анкілозуючого спондилоартриту і болю в нижній частині спини (Balfour J. et al., 1996).
Окрім відсутності пригнічення 5-ліпоксигенази та впливу на метаболізм арахідонової кислоти, лорноксикам запобігає руйнуванню кісток, як показано на експериментальних моделях у щурів. Причиною такого ефекту, швидше за все, є інгібування міграції поліморфнонуклеарних лейкоцитів і вивільнення ними супероксиду, а також пригнічення тромбоцитарного фактора росту і стимулювання синтезу протеогліканів в хрящовій тканині.
З урахуванням збалансованого інгібування ЦОГ-1 та ЦОГ-2, високої біодоступності при пероральному прийомі і періоду напіввиведення 4–5 год застосування лорноксикаму з метою зниження вираженості запалення й купірування болю має значні переваги порівняно з іншими НПЗП при ряді патологій (Hitzenberger G. et al., 1990; Pruss T.P. et al., 1990). Ці переваги значною мірою стосуються профілю безпеки препарату. Особливо це важливо в пацієнтів, які перенесли інсульт і мають ряд супутніх патологій. Важливо пам’ятати, що слід обережно застосовувати комбінацію лорноксикаму з іншими НПЗП через підвищений ризик побічних рекацій, а також комбінувати його з варфарином, оскільки препарат через зменшення активності згортальної системи крові і потенціювання дії варфарину потребує додаткового контролю міжнародного нормалізованого відношення.
Існують переконливі докази того, що лорноксикам інгібує цитокін-індуковану синтетазу оксиду азоту (nitric oxide — NO), при цьому рівень інгібування залежить від його дози. Водночас піроксикам, диклофенак, ібупрофен, кеторолак і напроксен значно меншою мірою впливають на утворення NO-сполук. Крім того, на стимульованих моноцитарних клітинах лорноксикам демонструє сильне пригнічення інтерлейкіну-6 (ІЛ-6) і помірне — фактора некрозу пухлини a, ІЛ-1b і -8, що обумовлює більш сильну аналгезію при його застосуванні порівняно з деякими іншими НПЗП (Berg J. et al., 1999).
Нашим завданням було не тільки підтвердження ефективності використання лорноксикаму при больовому синдромі, а й встановлення того, чи раннє призначення НПЗП може бути методом лікування гострого болю та профілактики хронізації больового синдрому у плечі пацієнтів, що перенесли інсульт. Для цього групу пацієнтів (112 осіб), які були включені в дослідження та мали біль у плечі ураженої руки, було розділено на дві підгрупи. Перша підгрупа включала 60 осіб (із них 30 жінок та 30 чоловіків), середній вік — 62,1 ± 1,1 року, друга підгрупа — 52 пацієнти (25 чоловіків та 27 жінок), середній вік — 60,8 ± 1,4 року. Тобто підгрупи були порівнянними за віком, даними шкали NIHSS (розбіжність за середнім балом ± 1,7) та статтю. В обох групах пацієнтів проводили стандартну фізіотерапію болю в плечі та загальну реабілітацію. Але в першій підгрупі ми призначили пацієнтам 16 мг лорноксикаму перорально протягом 14 днів, а в другій групі пацієнтів не використовували лорноксикам або використовували НПЗП спорадично, тільки при больовому синдромі. Аналіз стану пацієнтів оцінювали через 2 тижні, а для аналізу наявності хронічного больового синдрому оцінку стану пацієнтів проводили кожні 2 тижні до 12-го тижня включно. Оцінка болю проводилася за 10-бальною шкалою. Причому на початку дослідження у всіх пацієнтів оцінка болю становила більше ніж 5 балів за цією шкалою. На рис. 3 наведено динаміку зміни кількості пацієнтів за шкалою болю (тобто показана та кількість пацієнтів, яка оцінювала біль у плечі на 5 балів і більше на момент огляду).
/50/50.jpg)
Отже, ми можемо стверджувати, що в підгрупі пацієнтів, які отримували Ксефокам у дозі 16 мг на добу, біль у плечі регресував швидше та в більшої кількості осіб, ніж у пацієнтів, які при використанні стандартних методів фізіотерапії та реабілітації не отримували Ксефокам. Через 12 тижнів біль у плечі відмічали 25 пацієнтів (41,6 %) із підгрупи Ксефокаму та 39 пацієнтів (75 %) із підгрупи, яка не отримувала Ксефокам.
Необхідно відмітити, що біль у плечі приблизно в 50 % випадків розвивався протягом тижня після інсульту. Подібні зауваження, що стосуються раннього болю в плечі, зроблені Gamble і співавт. [1] і Lindgren та співавт. [2]. Це здається логічним, бо є втрата стабілізації м’язів плеча, що, ймовірно, спровокована попередньою травмою. Ще однією причиною для раннього початку болю в плечі може бути те, що пацієнти знаходяться в найбільш тяжкому і вразливому стані відразу після інсульту. Було б цікаво простежити за учасниками дослідження протягом більше ніж 3 місяців, щоб отримати більше інформації про довгострокові результати.
Геморагічний інсульт частіше провокував біль у плечовому суглобі, але, наскільки нам відомо, жодні інші дослідження не повідомляли про подібні результати. Різні результати були отримані про зв’язок між підвивихом у плечовому суглобі й розвитком больового синдрому в плечі після інсульту [2, 7, 8, 21]. Lindgren та співавт. [2] повідомляли про взаємозв’язок між ними, але ми це не відмітили, хоча використовували їх метод оцінки. Ця різниця, імовірно, пов’язана з відмінностями в критеріях включення у результаті різних конструкцій порівняння.
Серед пацієнтів, які перенесли інсульт із вираженим парезом руки, розвивається біль у плечі, а набряк може бути ще одним симптомом травми плеча. При дослідженні факторів, що виникають при постінсультній травмі плеча, ми повинні розглянути повторювані травми при щоденному догляді (навчання, тренування, вдягання, особиста гігієна). Ці чинники можуть слугувати підставою для подальшого дослідження.
Висновки
Проведене дослідження довело, що біль у плечі є частим ускладненням інсульту, особливо в пацієнтів із геміплегією або вираженим геміпарезом. Біль у плечі спостерігався в кожного п’ятого пацієнта, який переніс інсульт (19,9 %).
Набряк кисті може слугувати предиктором розвитку больового синдрому в ураженій руці, а регрес набряку корелює із регресом больового синдрому.
Використання препарату Ксефокам у дозі 16 мг на добу для пацієнтів, які перенесли інсульт та мають перші прояви болю в плечі, що супроводжуються набряком руки, вірогідно покращує стан пацієнта протягом 2 тижнів та зменшує ризик розвитку хронічного больового синдрому у плечі. Тому прийом Ксефокаму, адекватна фізіотерапія, правильний догляд та своєчасна реабілітація є основними методами лікування та профілактики больового синдрому в плечі для пацієнтів, які перенесли інсульт.
1. Gamble G.E., Barberan E., Laasch H.U., Bowsher D., Tyrrell P.J., Jones A.K.P. Post stroke shoulder pain: A prospective study of the association and risk factors in 152 patients from a consecutive cohort of 205 patients presenting with stroke // Eur. J. Pain. — 2002. — 6. — 467–74.
2. Lindgren I., Jönsson A.C., Norrving B., Lindgren A. Shoulder pain after stroke. A prospective population-based study // Stroke. — 2007. — 38. — 343–8.
3. Ratnasabapathy Y., Broad J., Baskett J., Pledger M., Marshall J., Bonita R. Shoulder pain in people with a stroke: A population-based study // Clin. Rehabil. — 2003. — 17. — 304–11.
4. Langhorne P., Stott D.J., Robertson L., MacDonald J., Jones L., McAlpine C. et al. Medical complications after stroke: A multicenter study // Stroke. — 2000. — 31. — 1223–9.
5. McLean D.E. Medical complications experienced by a cohort of stroke survivors during inpatient, tertiary-level stroke rehabilitation // Аrch. Phys. Med. Rehabil. — 2004. — 85. — 466–9.
6. Aras M.D., Gokkaya N.K.O., Comert D., Kaya A., Cakci A. Shoulder pain in hemiplegia: Results from a national rehabilitation hospital in Turkey // Am. J. Phys. Med. Rehab. — 2004. — 83. — 713–9.
7. Turner-Stokes L., Jackson D. Shoulder pain after stroke: A review of the evidence base to inform the development of an integrated care pathway // Clin. Rehabil. — 2002. — 16. — 276–98.
8. Zorowitz R.D., Hughes M.B., Idank D., Ikai T., Johnston M.V. Shoulder pain and subluxation after stroke: Correlation or coincidence? // Am. J. Occup. Ther. — 1996. — 50. — 194–201.
9. Griffin A., Bernhardt J. Strapping the hemiplegic shoulder prevents development of pain during rehabilitation: A randomised controlled trial // Clin. Rehabil. — 2006. — 20. — 287–95.
10. Pong Y.P., Wang L.Y., Wang L., Leong C.P., Huang Y.C., Chen Y.K. Sonography of the shoulder in hemiplegic patients undergoing rehabilitation after a recent stroke // J. Clin. Ultrasound. — 2009. — 37. — 199–205.
11. Lee I., Shin Y.B., Moon T.Y., Jeong Y.J., Song J.W., Kim D.H. Sonography of patients with hemiplegic shoulder pain after stroke: Correlation with motor recovery stage // Am. J. Roentgenol. — 2009. — 192. — W40–W44.
12. Pompa A., Clemenzi A., Troisi E., DiMario M., Tonini A., Pace L. et al. Enhanced-MRI and ultrasound evaluation of painful shoulder in patients after stroke: A pilot study // Eur. Neurol. — 2011. — 66. — 175–81.
13. Távora D.G.F., Gama R.L., Bomfim R.C., Nakayama M., Silva C.E.P. MRI findings in the painful hemiplegic shoulder // Clin. Radiol. — 2010. — 65. — 789–94.
14. Barkelius K., Johansson A., Kõrm K., Lindmark B. Reliabi–lity and validity testing of modified motor assessment scale according to Uppsala University Hospital-95 // Nordisk Fysioterapi. — 1997. — 1. — 121–6.
15. Carr J., Shepherd R., Nordholm L., Lynne D. Investigation of a new Motor Assessment Scale for stroke patients // Phys. Ther. — 1985. — 65. — 175–80.
16. Holden M.K., Gill K.M., Magliozzi M.R., Nathan J., Piehl-Baker L. Clinical gait assessment in the neurologically impaired. Reliability and meaningfulness // Phys. Ther. — 1984. — 64. — 35–40.
17. MacKnight C., Rockwood K. Assessing mobility in elderly people. A review of performance-based measures of balance, gait and mobility for bedside use // Clin. Gerontol. — 1995. — 5. — 464–86.
18. Mehrholz J., Wagner K., Rutte K., Meissner D. et al. Predictive validity and responsiveness of the functional ambulation category in hemiparetic patients after stroke // Arch. Phys. Med. Rehabil. — 2007. — 88. — 1314–9.
19. Lyden P., Brott T., Tilley B., Welch K.M.A., Mascha E.J., Levine S. et al. Improved reliability of the NIH stroke scale using video training // Stroke. — 1994. — 25. — 2220–6.
20. Kasner S.E., Chalela J.A., Luciano J.M., Cucchiara B.L. et al. Reliability and validity of estimating the NIH stroke scale score from medical records // Stroke. — 1999. — 30. — 1534–7.
21. Paci M., Nannetti L., Rinaldi L.A. Glenohumeral subluxation in hemiplegia: An overview // J. Rehabil. Res. Dev. — 2005. — 42. — 557–68.
22. Кадиків А.С., Чернікова Л.А., Калашнікова Л.А., Шахпаронова Н.В. Рання реабілітація хворих з порушеннями мозкового кровообігу // Неврологіч. журн. — 1997. — № 1. — С. 24–27.
23. Кадиків А.С., Чернікова Л.А., Шведков В.В. Життя після інсульту. Популярно-практичний посібник з реабілітації хворих, що перенесли інсульт. — М.: Міклош, 2002. — 46 с.
24. Кадиків А.С. Реабілітація після інсульту. — М.: Міклош, 2004. — 176 с.