Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Анестезіологічне забезпечення операції кесарева розтину
Авторы: Підгірний Я.М. - Львівський національний медичний університет ім. Данила Галицького, кафедра анестезіології та інтенсивної терапії
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У цій лекції висвітлені питання анестезіологічного забезпечення операції кесарева розтину. Також наведені класифікація рівнів невідкладності згідно з клінічним протоколом акушерської допомоги «Кесарів розтин» і суперечливі питання. Описані передопераційна підготовка вагітних при екстрених і планових операціях і моніторинг роділлі та новонародженого. Через відмінності, знайдені в протоколах із профілактики аспірації в різних клініках, у статті висвітлено і це ускладнення. Розглядаються аспекти невдалої пре- та інтраопераційної блокади. Також описані фармакокінетика й фармакодинаміка місцевих анестетиків, опіоїдів та ад’ювантів при регіональній анестезії. Особливий акцент робиться на протоколах складної інтубації й екстубації.
В данной лекции освещены вопросы анестезиологического обеспечения операции кесарева сечения. Также представлены классификация уровней неотложности согласно клиническому протоколу акушерской помощи «Кесарево сечение» и спорные вопросы. Описаны предоперационная подготовка беременных при экстренных и плановых операциях и мониторинг роженицы и новорожденного. Из-за отличий, обнаруженных в протоколах по профилактике аспирации в различных клиниках, в статье освещено и это осложнение. Рассматриваются аспекты неудачной пре- и интраоперационной блокады. Также описаны фармакокинетика и фармакодинамика местных анестетиков, опиоидов и адъювантов при региональной анестезии. Особый акцент сделан на протоколах трудной интубации и экстубации.
Issues of anesthetic management of cesarian section are enlightened in this lecture. Classification of urgency levels according to clinical protocol in obstetrics «Cesarian section» and controversies there are also shown. Preoperative preparation of pregnant women in urgent and planned surgery modes and monitoring of woman in childbirth and a child are also described. Because of differences found in protocols for aspiration preventing depending on different clinics the problem of this complication is included in this lecture. Issues of pre- and intraoperative block failure are also described. Pharmacokinetics and pharmacodynamics of local anesthetics, opioids and adjuvants in regional anesthesia are described as well. Difficult intubation and extubation protocols are in special focus and are accented.
анестезія, кесарів розтин, антациди, місцева й загальна анестезія.
анестезия, кесарево сечение, антациды, местная и общая анестезия.
anesthesia, cesarian section, antacids, local and general anesthesia.
Статья опубликована на с. 13-27
Як зазначається в клінічному протоколі з акушерської допомоги «Кесарів розтин» (Наказ МОЗ України № 977 від 27.12.2011), протягом останніх десятиріч частота кесаревого розтину (КР) зростала як у розвинутих країнах, так і в країнах, що розвиваються. Дослідження, проведене ВООЗ у 2005 р., показало, що збільшення частоти КР асоціюється з підвищенням частоти призначення антибіотиків у післяпологовому періоді, збільшенням частоти тяжкої материнської захворюваності та смертності. Збільшення частоти КР вище ніж 15 % не рекомендовано ВООЗ, тому що це не впливає на зниження показників перинатальної захворюваності та смертності серед дітей, які народились шляхом КР, порівняно з такими серед немовлят, які народились природним шляхом.
З урахуванням частоти оперативного розродження будь-яка спроба зменшити асоційовані з КР ризики буде мати суттєві переваги з точки зору як економічних витрат, так і покращення здоров’я жінок.
Класифікація невідкладності операції кесарева розтину
Категорія 1. Негайне рятування життя матері чи дитини: операція має бути розпочата не пізніше ніж через 15 хвилин від визначення показань (С).
Категорія 2. Загроза матері/дитині, але нема потреби негайно рятувати життя — операція має бути розпочата не пізніше 30 хвилин від визначення показань (С).
Категорія 3. Потреба раннього розродження, але нема загрози матері чи дитині — операція має бути розпочата впродовж 75 хвилин (С).
Категорія 4. За попереднім планом у запланований день та час (at a time to suit the woman and staff).
Враховуючи низький рівень доказовості цих тверджень, слід зазначити:
— Традиційно прийнятий час 15 хв від моменту прийняття рішення до «добування» дитини є недоліком, який висвітлений у рекомендаціях NICIE.
— «Добування» дитини в межах 15 хв може бути недостатньо швидким. При кровотечі в матері чи стійкій брадикардії плода може виникнути необхідність у швидшому розродженні.
— Загальна анестезія (ЗА) може мати перевагу для категорії 1, однак проблеми зі сторони матері, наприклад передбачувані труднощі з дихальними шляхами чи патологічна вагітність повинні бути взяті до уваги при вирішенні техніки анестезії й обговорені наперед із вагітною й акушерською командою.
— Недоречна поспішність дотримуватися правила 15 хвилин може ставити під надмірну загрозу безпеку матері.
— Необхідною є добра комунікація між акушерами та анестезіологом.
— Внутрішньоматкова реанімація плода повинна обговоритись на цьому етапі, оскільки може покращити стан плода й категорія 1 може бути переведеною в категорію 2, що дає час на застосування регіональної техніки.
Анестезіолог повинен брати активну участь у реанімації матері та дитини, як тільки прийняте рішення про кесарів розтин:
— припинити введення окситоцину;
— позиція матері повністю на лівому боці чи коліно-ліктьова поза (якщо персистує порушення серцебиття плода або компресія корди);
— застосування інгаляції кисню зі швидкістю потоку 10–15 л/хв;
— інфузійна терапія (болюсно, наприклад, 1000 мл розчину Гартмана), остерігаючись при цьому прееклампсії;
— лікування гіпотензії внутрішньовенним введенням вазопресорів та інотропних препаратів, враховуючи їх вплив на адренергічні рецептори;
— вирішити питання токолізу (особливо якщо дистрес плода асоційований із застосуванням простагландинів чи окситоцину) — обговорити з акушером імовірність застосування 250 мкг тербуталіну підшкірно чи гліцерил тринітрату у вигляді під’язикового спрея.
Підготовка до планового КР
— Жінка повинна бути оглянута анестезіологом за 1–3 дні до планового КР, підписати інформовану згоду на анестезіологічне забезпечення операції.
— Профілактика регургітації й аспірації.
— Вагітна повинна бути проінформована щодо режиму голодування.
— Анестезіолог повинен провести ретельний огляд пацієнтки — звернути увагу на дихальні шляхи, спину, шуми серця.
— Обговорити заплановану техніку анестезії.
Підготовка до негайного КР:
— Складно підписати інформовану згоду. Мати може відчувати гострий біль, бути виснаженою, перебувати під впливом ліків, бути вкрай стривоженою. Однак це не впливає на принципи чи обсяг інформації, необхідної для одержання інформованої згоди для анестезії.
— Дослідження продемонстрували, що, незважаючи на вплив болю чи ліків, жінки люблять бути проінформованими і здатні пригадати інформацію про ризик і переваги регіональної анестезії (РА). Використання простих і чітких інформаційних карт покращує пригадування інформації і підвищує рівень вдоволення пацієнта.
— Якщо час обмежений, інформаційний процес повинен відбуватись під час підготовки пацієнтки. У вкрай невідкладному стані згода може бути усною і задокументованою пізніше.
— Обсяг інформації може бути меншим, проте принципи інформованої згоди залишаються, необхідно згадати як основний ризик для матері, так і ймовірні серйозні наслідки.
— Біль при РА є частою причиною судових позовів у США та країнах Європи, тому необхідно його детально обговорити до проведення маніпуляції з запевненням жінки, що він буде швидко усуненим, у тому числі застосуванням ЗА.
Моніторинг матері та плода
Для гарантування безпеки пацієнта моніторинг (спостереження) слід розпочати до та продовжувати після завершення як місцевої, так і загальної анестезії. Обладнання для моніторингу слід перевіряти перед кожним новим пацієнтом. Дослідження CEMACH (2000–2002) показало важливість капнографії, оскільки хоча і рідко, але все ж таки трапляються випадки смерті внаслідок невстановленої інтубації стравоходу. Частий вербальний контакт із жінкою є основним і одним із найбільш надійних методів моніторування матері.
Мінімальний моніторинг матері включає:
— пульсоксиметрію;
— неінвазивний моніторинг АТ;
— ЕКГ;
— капнографію;
— аналіз FiO2, VEO2 і VECO2;
— нейром’язовий моніторинг;
— контроль температури.
Крововтрату слід моніторувати у кожної жінки:
— Темп сечовиділення — прискіпливий моніторинг у післяопераційний період після значної крововтрати і при прееклампсичній токсемії (не менше 0,5 мл/кг/год, а бажано більше 1 мл/кг/год).
— Інвазивний моніторинг (артеріальний і центральний венозний тиск).
— Відповідні аналізи крові. Моніторинг серцевого викиду, наприклад трансторакальна або черезстравохідна ЕхоКГ.
Моніторинг плода
Моніторинг може бути непостійним, наприклад доплер-УЗД, або постійним — кардіотокографія.
Аортокавальна компресія (АКК)
Gideon Ahltorp у 1931 році описав, що симптоми серцевої недостатності (нудота, задишка, блідість, відсутність свідомості та слабкий пульс) часто виникають, коли вагітна матка лежить на задній черевній стінці. Ці симптоми зникають при латеральній позиції або піднятті матки вгору. У 1953 році Howard описав концепцію синдрому супінальної гіпотензії при пізньому терміні вагітності. Він виявив, що в 11,2 % вагітних після декількахвилинного перебування в супінальній позиції розвивається гіпотензія зі зниженням систолічного тиску більше ніж на 30 мм рт.ст.
Аортокавальна компресія зумовлена частковою оклюзією нижньої порожнистої вени (НПВ) і меншою мірою аорти вагітною маткою. Оклюзія НПВ суттєво знижує венозне повернення й серцевий викид. Незважаючи на зниження серцевого викиду, АТ часто підтримується завдяки артеріальній вазоконстрикції. Оклюзія аорти підвищує постнавантаження, що призводить до зниження серцевого викиду.
Барорецептор-медіаторна вагальна брадикардія розвивається вторинно до зростання системного артеріального тиску внаслідок компресії аорти і може спричинити розвиток гіпотензії. Вважається, що виражена брадикардія, асоційована з дуже низьким серцевим викидом і колапсом вагітної, спричинена гострим зниженням венозного повернення до ПШ (рефлекс Бецольда — Яриша).
Супінальна гіпотензія найшвидше може розвинутись після 20 тижнів вагітності і стає більш вираженою в третьому триместрі. Іншими факторами, що спричинюють АКК, є:
— полігідрамніон;
— анормальне положення плода (сідничне, поперечне);
— багатоплідна вагітність;
— ожиріння матері;
— міоми матки.
Супінальна гіпотензія менш виражена після розриву плідного міхура, проходження голівки й опущення крізь таз і рідко спостерігається після народження дитини. Ефект аортокавальної компресії може бути мінімізований чи нівельований шляхом повної латеральної позиції на обох сторонах:
Нахил ліворуч на 15°. Методика запропонована Crawford у 1970-х роках і запозичена багатьма як оптимальна позиція матері до і під час кесарева розтину:
— практично нівелює кавальну компресію;
— може не підходити вагітним високого ступеня ризику;
— посилення нахилу до 20° зменшує гіпотензію, але є небезпечною позицією для матері;
— кесарів розтин можливий у цій позиції.
«Клин» під праву сідницю:
— досягається легше зміщення матки;
— Вигин хребта матері може спричиняти дискомфорт.
Ручне зміщення матки ліворуч:
— ефективне;
— є корисним тимчасовим заходом;
— потребує асистента.
Антацидна профілактика
1. Регургітація й аспірація шлункового вмісту може спричинити пневмоніт, особливо якщо рідина є кисла — рН шлунку < 2,5 (синдром Мендельсона).
2. Гастроезофагеальна регургітація може відбутись і при загальній анестезії, коли шлунок наповнений, оскільки анестетики зменшують тонус нижнього сфінктера стравоходу.
Вагітна повинна розглядатись як особа з підвищеним ризиком регургітації, оскільки:
— гормони вагітності, прогестерон і релаксин, спричиняють розслаблення гладких м’язів шлунка;
— підвищений інтраабдомінальний тиск. Біль, тривожність і застосування опіоїдів збільшують ризик.
З часу, коли Мендельсон описав синдром аспірації кислоти у 1946 році, частота випадків синдрому дуже зменшилась. У дослідженні CEMACH наведено, що на 1 випадок синдрому Мендельсона у 2000–2002 рр. припадало 66 таких випадків у 1946 році. Причина такого різкого зниження кількості випадків обумовлена багатьма факторами:
— застосування регіональної анестезії для кесарева розтину;
— краще проведення антацидної профілактики;
— наявність досвідчених в акушерстві анестезіологів та їх асистентів;
— ідентифікація і лікування жінок високого ступеня ризику аспірації: ті, які одержують опіоїди, із прееклампсією, багатоплідною вагітністю, попередніми кесаревими розтинами, ожирінням, діабетом.
Методи, що застосовуються для зниження ризику аспірації, включають:
1) голодування матері хоча б 6 год до планового кесарева розтину для зменшення об’єму шлункового вмісту;
2) обмеження перорального вживання будь-чого під час пологів (особливо твердої їжі);
3) застосування таких препаратів для зменшення об’єму і/або кислотності шлункового вмісту:
3. Антациди — лужні субстанції, що знижують чи нейтралізують кислотність шлункового вмісту:
— Трисилікат магнезії:
а) перший антацид, що широко застосовувався при пологах, але рідко використовується сьогодні (ефективно знижує рН шлунка, але потенційно небезпечний).
— Цитрат натрію:
а) найбільш широко використовується;
б) застосовується 30 мл 0,3М розчину;
в) швидкий ефект (10 хв за результатами лабораторних досліджень);
г) короткої дії і непередбачуваний ефект у межах 60 хв;
д) не збільшує об’єму шлунка;
е) неприємний на смак;
є) короткий термін придатності.
4. Н2-антагоністи:
— антагоністи Н2-рецепторів зменшують секрецію кислоти в шлунку;
— цей вплив не є негайним, тому антагоністи Н2-рецепторів часто застосовуються в комбінації з антацидами при початку невідкладної анестезії;
— ефект перорального застосування ранітидину в дозі 150 мг проявляється через 60 хв;
— ефект внутрішньовенного введення проявляється через 30 хв, тому препарат слід ввести при індукції невідкладної анестезії для безпеки екстубації (коли ефект цитрату натрію є ненадійним);
— побічні ефекти цієї групи можуть включати головокружіння, втомлюваність, висип, біль голови, розлади збоку ШКТ.
5. Антагоністи допаміну:
— широко і безпечно застосовуються у вагітних;
— 10 мг метоклопраміду перорально або повільно внутрішньовенно;
— інгібують блювоту і пришвидшують спорожнення шлунка;
— можуть підвищити низький тонус стравоходу;
— більш ефективні в поєднанні з ранітидином чи омепразолом;
— побічні ефекти включають сонливість, неспокій, діарею й аритмії.
6. Інгібітори протонної помпи:
— блокують продукцію шлункового соку шляхом впливу на механізм протонної помпи у парієтальних клітинах шлунка;
— омепразол є єдиним інгібітором протонної помпи, широко вивченим в акушерській практиці;
— доза 80 мг перорально ефективна через 60 хв;
— ефект внутрішньовенного введення 40 мг проявляється через 30 хв;
— нема чітких переваг над ранітидином;
— більш дорогий;
— побічні ефекти включають висип і розлади ШКТ.
Докази, що підтримують рутинне застосування антацидів із метою профілактики аспірації кислого шлункового вмісту при звичайних пологах, є недостатніми.
Протокол профілактики аспірації відмінний у різних клініках.
Типова профілактика аспірації при кесаревому розтині включає:
1) плановий КР:
— за 12 год преоперативно 150 мг ранітидину перорально;
— за 2 год преоперативно 150 мг ранітидину перорально ± метоклопрамід 10 мг перорально безпосередньо перед операцією;
— деякі госпіталі додають 0,3М цитрату натрію 30 мл перорально. Оскільки ефект триває лише 20 хв після вживання, багато клінік застосовують його лише при загальній анестезії;
2) негайний КР:
— 150 мг ранітидину перорально, якщо дозволяє час;
— негайно преоперативно 0,3М цитрату натрію 30 мл;
— під час операції ранітидин 50 мг і метоклопрамід 10 мг внутрішньовенно;
— наприкінці КР шлунок може бути спорожненим орогастральним зондом, який слід видалити перед екстубацією.
Технології анестезії
Епідуральна анестезія (ЕА)
— У минулому ЕА розглядалась як техніка вибору при КР у матерів із серцево-судинною патологією чи прееклампсією, яка дозволяє уникнути раптових змін гемодинаміки, асоційованих зі спінальною анестезією (СА). Комбінована спінально-епідуральна техніка замінила потребу в епідуральній анестезії в цієї категорії вагітних.
— Найбільш загальними показаннями для епідуральної анестезії при КР є розширення сенсорного блоку з доповненням існуючої епідуральної анестезії, якщо вона застосовувалася для аналгезії в пологах. Більш концентровані розчини і в більших об’ємах необхідні для одержання щільного сенсорного блоку для оперативного розродження (табл. 1).
— Якщо ЕА була неефективною під час звичайних пологів, незважаючи на застосування адекватних доз місцевого анестетика, то малоймовірно, що додаткове введення місцевого анестетика забезпечить адекватне знеболювання під час КР. У таких випадках можна вирішувати питання про зміну позиції епідурального катетера. Якщо клінічна ситуація не дозволяє цього зробити, потрібно провести спінальну чи загальну анестезію.
Вибір ліків
Локальний анестетик (ЛА)
— Імовірні препарати:
– 0,5% бупівакаїн 20–25 мл;
– 0,5% левобупівакаїн 20–35 мл;
– 2% лідокаїн (часто з адреналіном у розведенні 1 : 200 000) 15–20 мл;
– 50/50 суміш 0,5% бупівакаїну і 2% лідокаїну 15–25 мл;
– 0,5% ропівакаїн 15–25 мл;
– 0,75% ропівакаїн 15–20 мл.
— Бупівакаїн 0,5% є загальноприйнятим для проведення епідуральної анестезії. Виявлено його ефективність при застосуванні разом з опіоїдами, наприклад 50–100 мкг фентанілу.
— Левобупівакаїн може бути корисним у такій же чи більшій дозі (до 35 мл 0,5%) і має додаткові переваги завдяки його нижчій кардіотоксичності.
— Деякі дослідження показали, що початок анестезії є швидшим при використанні 2% лідокаїну, якщо застосовувати його як єдиний препарат чи в комбінації з бупівакаїном. Також є деякі докази, що лідокаїнумісні розчини є менш надійними. При застосуванні лідокаїну потрібно використовувати адреналін для зменшення системної абсорбції локального анестетика і покращення щільності блоку.
— Якщо на фоні застосування 20 мл анестетика у високій концентрації спостерігається адекватна поширеність, проте неадекватна щільність блоку, слід застосувати ще 5–10 мл того ж розчину.
Опіоїди
— Додавання ліпофільних опіоїдів, наприклад 50–100 мкг фентанілу чи 20–50 мкг суфентанілу до розчину локального анестетика продемонструвало зростання якості сенсорного блоку та покращення інтраоперативної аналгезії.
— Місцем впливу всіх спінальних опіоїдів є опіоїдні рецептори дорзального рогу спинного мозку.
— Введені епідурально опіоїди підлягають системній абсорбції і можуть спричинити побічні ефекти, наприклад нудоту та блювання, свербіж, седацію і депресію дихання.
— Опіоїди тривалої дії (діаморфін 2,5–5 мг чи морфін 3–5 мг) можуть бути введені через епідуральний катетер після народження дитини з метою післяопераційної аналгезії. Вони можуть викликати такі ж побічні ефекти, включаючи віддалену депресію дихання, тому матір слід моніторувати в післяопераційному періоді.
Допоміжні засоби
— Натрію бікарбонат (2 мл 8,4%) без консервантів до розчину для «довведення» продемонстрував швидше настання епідуральної анестезії. Неіонізована фракція локального анестетика теоретично перетинає периневральну оболонку з більшою ефективністю. На практиці не виявлено клінічної значимості цієї переваги.
— Додавання 0,1 мл адреналіну 1 : 1000 до 2% лідокаїну зменшує системну абсорбцію лідокаїну і посилює та пролонгує неавральну блокаду. Має прямий антиноцицептивний ефект, діючи як a2-агоніст у спинному мозку.
— Клонідин є незначним a2-адренергічним агоністом, вважається, що він викликає аналгезію, впливаючи на задній ріг спинного мозку. Застосовується епідурально болюсно в дозі 75–100 мкг. Перевагою клонідину порівняно з опіоїдами є нижча здатність викликати нудоту, блювоту, свербіж чи пригнічувати дихання. Проте він спричиняє гіпотензію та седацію. Може бути використаний в основному завдяки його післяопераційному ефекту.
— Неостигмін вивчений у дозі 30–300 мкг. Продукує дозозалежну нудоту і седацію, чинить помірний анальгезуючий вплив.
Ведення невдалого блоку
До операції
— Якщо блок залишається неадекватним до початку операції та дозволяє час і стан роділлі, можна використати додаткову дозу місцевого анестетика (наприклад, 5–10 мл бупівакаїну чи левобупівакаїну 0,5%).
— Якщо не настає подальше розширення блоку, більшість анестезіологів відстоюють припинення будь-яких епідуральних введень і введення зменшеної дози спінального анестетика, наприклад, 1–1,5 мл 5% бупівакаїну в лівій латеральній оксфордській позиції (рис. 1). Матір слід вкласти на спину з лівим бічним нахилом, з двома подушками, добре розміщеними під «грудну кривизну» (дослівно) для попередження високого блоку.
/17/17.jpg)
Під час операційного втручання
— Неадекватний блок може бути очевидним уже на початку операції, наприклад при перитонеальному розрізі, вивертанні матки чи тампонуванні паракишкового простору. Будь-який біль повинен бути обговореним із хірургом.
— Важливо на кожній стадії диференціювати біль і відчуття тиску/потягування, що може викликати значний дискомфорт. Вербальний контакт і підтримка анестезіологічної команди є необхідними під час КР під РА.
— Якщо біль виник при розтині очеревини, тобто перед добуванням дитини, повинні бути зроблені спроби покращити блок довведенням локального анестетика ± опіоїдів. Хірурга слід попросити припинити операцію й зачекати, коли в жінки відновиться комфорт.
— Якщо додаткові введення неефективні або невідкладність ситуації вимагає продовження операційного втручання, слід негайно перейти до загальної анестезії.
— Якщо біль з’явився після народження дитини, операція повинна бути призупинена та слід додатково епідурально ввести місцевий анестетик. Внутрішньовенне введення 10 мг кетаміну є додатковою опцією. Якщо це неефективне, слід перейти до ЗА.
— Якщо наближається кінець операції, можна провести локальну інфільтрацію місцевим анестетиком.
— Всі пацієнти повинні бути під спостереженням у післяпологовому періоді. Специфічна інформація про ймовірні причини невдалого блоку повинна бути чітко роз’яснена.
Спінальна анестезія
СА створює щільніший блок, який настає швидше й забезпечує анестезію кращої якості, ніж ЕА. У дослідженні 1996 року ця техніка була методом вибору серед анестезіологів для проведення планового чи ургентного КР. Роль СА при першій категорії КР залежить від досвіду анестезіолога й гінеколога, який приймає рішення про проведення КР. Існує дуже мало ситуацій, коли ступінь ургентності КР не залишає часу провести СА (табл. 2).
Вибір ліків
Місцевий анестетик
У Британії для інтратекального введення ліцензований лише 0,5% гіпербаричний бупівакаїн. Показано, що в дозі 12,5 мг викликає надійний сенсорний блок при операції; однак часто застосовується (і визнана достатньою) нижча доза (8–10 мг), особливо в поєднанні з епідуральною технікою, що може асоціюватись із меншим рівнем гіпотензії.
— Використання 0,5% гіпербаричного лідокаїну залишилось у минулому у зв’язку з повідомленнями про пролонгований неврологічний дефіцит при інтратекальному (внутрішньооболонковому) введенні (табл. 3).
— Бупівакаїн є докладно вивченим і може забезпечити надійний блок, який є менш чутливим до позиції матері.
— Фінальний блок є більш залежним від маси (кількості) препарату, ніж від об’єму ін’єктату. Так, 10 мг бупівакаїну, введеного як 2 мл 0,5% або як 10 мл 0,1%, має еквівалентний ефект.
— Левобупівакаїн 0,5% та ропівакаїн 0,5–0,75% також дають достатній блок, але відсутні у формі гіпербаричного розчину.
— Необхідний об’єм локального анестетика залежить від додаткових факторів:
– pregnant term wonen — потребує на 25 % менше локального анестетика;
– зріст матері — докази щодо зросту є обмеженими, можна незначно зменшувати або збільшувати дозу при крайніх відхиленнях росту;
– передчасні пологи — оскільки матка є меншою, меншою є компресія нижньої порожнистої вени, що зменшує кефальне поширення ЛА. Рекомендовано збільшити дозу чи застосувати комбіновану спінально-епідуральну техніку;
– збільшений розмір матки при багатоплідній вагітності чи полігідрамніоні може спричинити більш швидке настання блоку і його силу завдяки пришвидшеному кефальному поширенню.
Опіоїди
— Додаткове застосування ліпофільних опіоїдів, наприклад 10 мкг фентанілу, 2,5–10 мкг суфентанілу, 250 мкг діаморфіну до локального анестетика посилює якість сенсорного блоку і покращує інтраопераційну аналгезію. Інтратекальне введення діаморфіну забезпечить постопераційну аналгезію до 12 год.
— Дія морфіну настає значно повільніше (45–60 хв) і не забезпечує доброї інтраопераційної аналгезії, хоча препарат є ефективним для лікування післяопераційного болю.
— Місцем дії всіх спінальних опіоїдів є опіоїдні рецептори дорзального рогу спинного мозку.
— Опіоїди, введені спінально, підлягають певній системній абсорбції, спричиняючи небажані побічні ефекти (нудоту, блювоту, свербіж, седацію, пригнічення дихання).
— Короткодіючі опіоїди (фентаніл, суфентаніл) мало впливають на післяопераційну аналгезію. Тому введення довготривалого опіоїду додатково (100 мкг морфіну) рекомендоване для забезпечення оптимальної постопераційної аналгезії, проте необхідний персонал та кошти для забезпечення моніторування вітальних функцій кожні 2 год протягом 24 год у післяопераційному періоді, оскільки є, хоча і невелика, ймовірність пізнього розвитку депресії дихання після інтратекального введення морфіну.
— Введений інтратекально діаморфін продемонстрував меншу ймовірність виникнення нудоти, блювоти, свербежу порівняно з морфіном, проте тривалість його впливу є коротшою — 12 год порівняно з 24 год на фоні морфіну.
Допоміжні ліки
— Інтратекально клонідин — a2-адренергічний агоніст — забезпечує аналгезію в межах заднього рогу спинного мозку шляхом вивільнення оксиду азоту. Продемонстровано, що додавання клонідину в дозі 75 мкг до гіпербаричного бупівакаїну покращує інтраопераційну та післяопераційну аналгезію. Побічні ефекти включають пролонгований моторний блок, гіпотензію, брадикардію і седацію.
— Інтратекально мідазолам (1 мг) — має аналгетичні властивості. Однак, якщо комбінувати з діаморфіном, ефект не відрізнятиметься від такого при застосуванні лише діаморфіну.
— Інтратекально неостигмін спричиняє аналгезію, інгібуючи розпад ацетилхоліну. Застосовуються дози від 10 до 100 мкг, продемонстрували поліпшення контролю постопераційного болю до 24 год. Однак є багато випадків дозозалежної нудоти, блювоти, які й обмежують клінічне застосування препарату.
Визначення блоку
— Виконати першу повірку блоку достатньо рано, в межах декількох хвилин від надання матері лівого положення, щоб врахувати позиційні зміни й адекватність блоку перед тим, як фіксувати інтратекально місцеву анестезію.
— Сила сенсорного блоку повинна бути діагностована з великою уважністю, включаючи визначення нижньої межі блоку.
— Блок зазвичай є білатеральним і час від часу є неоднаковим. Є корисною постуральна маніпуляція (postural manipulation), особливо коли застосовується «важкий» бупівакаїн.
— Мати може бути нахилена чи повернена на бік неадекватного блоку, щоб його покращити.
— Якщо верхній рівень блоку є неадекватним, ефективними є як нахил стола в напрямі голови, так і згинання стегон.
— Сенсорний блок на льодяно-холодне від Т4 до S5 і до легких дотиків до Т5 повинен забезпечити безбольовий КР.
— Мати повинна бути повністю підготовлена до того, що вона може відчувати під час операції і попереджена про ймовірність інтраоперативного дискомфорту чи болю і ймовірні методи їх усунення.
Лікування невдалого блоку
До операції
Якщо блок неадекватний для того, щоб в очікуваний час (до 15 хв) приступити до операції, існує кілька можливих лікувальних опцій:
— Змінити позицію матері — опустити голову чи повернути латеральну позицію.
— Рекомендовано повторити спінальну анестезію, якщо нема доказів сенсорного чи моторного блоку або верхньої межі блоку до Т12. Якщо нема блоку або є мінімальний блок, рекомендовано повторити ту ж дозу. Якщо є докази рівня блоку до Т12, рекомендовано ввести меншу дозу місцевого анестетика (1–1,5 мкг 0,5% важкого бупівакаїну, щоб уникнути високого блоку. Матері обережно повинна бути надана позиція з двома подушками під грудний вигин хребта для уникнення високого блоку.
— Якщо верхній рівень сенсорного блоку знаходиться між Т12 і Т4 дерматомами, для посилення блоку рекомендоване введення епідурального катетера з додатковим довведенням місцевого анестетика.
— Загальна анестезія — якщо ургенція не дозволяє витратити час для покращення регіональної анестезії. Мати і плід повинні бути ще раз оцінені спільно з акушером щодо ризику, оскільки рішення перейти до загальної анестезії при патологічному ожирінні та гострій прееклампсії має суттєвий ризик для дихання.
Протягом операції
— Інадекватний блок може стати очевидним після початку операції, наприклад під час перитонеального розтину, вивертання матки, промокання білякишкових западин. На будь-якій стадії операції при цьому першорядним є запевнення матері та партнера, що чутливість буде ліквідована, також усі скарги на біль чи дискомфорт повинні бути обговорені з хірургом.
— Якщо біль проявився під час перитонеального розтину, тобто ще до добування дитини, єдиною опцією є перехід до загальної анестезії. Хірурга слід попросити призупинити операцію на час підготовки ліків та інструментарію для проведення загальної анестезії.
— Якщо біль стає очевидним після добування дитини, хірург повинен зупинитись. Внутрішньовенно кетамін 10 мг є додатковою опцією. Якщо це неефективно, слід перейти до загальної анестезії.
— Якщо біль з’являється наприкінці операції, слід застосувати місцеву інфільтрацію місцевим анестетиком.
— Важливо віддиференціювати біль від неприємних відчуттів тиску/потягування. Вербальний контакт між командою анестезіологів та пацієнткою є дуже важливим при КР під регіональною анестезією.
— Всі пацієнти повинні бути оглянуті в післяпологовому періоді. Специфічна інформація про ймовірні причини неадекватності блоку повинні бути чітко пояснені.
Поєднана спінально-епідуральна анестезія (ПСЕА)
У великій кількості клінічних випадків як при плановому, так і ургентному КР ПСЕА є технікою вибору. Вона поєднує швидке настання блоку і надійність спінального анестетика з гнучким у плані тривалості сенсорним блоком унаслідок введення локального анестетика повільними болюсами через епідуральний катетер. Дозволяє зменшити дозу інтратекального локального анестетика, тому мінімізує багато побічних ефектів, що часто зустрічаються при спінальній техніці.
Показання до ПСЕА
Показання поділяються на такі категорії.
Мінімізація гіпотензії
— Інтратекально низькі дози місцевого анестетика (1,5 мл 0,5% гіпербаричного бупівакаїну), і сенсорний блок може бути доповнений додатковим введенням цього анестетика епідурально (він титрується залежно від АТ). ПСЕА суттєво зменшує потребу у ЗА в матерів з серцевою патологією.
— Збільшення розміру матки (багатоплідна вагітність, полігідрамніон), асоційоване зі зростанням аортокавальної компресії і поширенням інтратекального анестетика цефально, що призводять до наростання гіпотензії і гіпоперфузії матки. Зменшена спінальна доза мінімізує ці симптоми й ускладнення.
Непередбачуваність висоти блоку
— Коли тяжко визначити оптимальну інтратекальну дозу для бажаної висоти блоку (низький чи високий зріст), найуспішнішим методом є ПСЕА.
— Ранній розвиток анестезії асоційований із меншим кефальним поширенням локального анестетика і разом із тим менш передбачуваним сенсорним блоком. Тоді корисним і необхідним є наявність епідурального катетера для поглиблення блоку.
Пролонгована хірургія
— Якщо передбачається пролонгована або складна хірургія, блок може бути поширеним епідурально (приросла плацента, КР в анамнезі, наявність спайок після перенесеної абдомінальної хірургії, складний доступ у зв’язку з патологічним ожирінням).
Протипоказання до загальної анестезії
— Загальна анестезія строго протипоказана чи небажана при злоякісній гіперпірексії, у випадках попередньо невдалих інтубацій чи при передбачуванні складних особливостей дихальних шляхів.
Післяопераційна аналгезія
— Коли визначено, що епідуральна анестезія буде корисною у постопераційний період (хронічний біль, алергія на опіоїди).
Переваги
— Швидкий початок анестезії.
— Добра якість сенсорного блоку.
— Гнучкість і можливість титрування для запобігання швидким змінам АТ.
— Можливість швидкого поширення регіонального блоку.
— Зниження потреби в переході до загальної анестезії.
— Епідуральний доступ може бути використаним для постопераційної аналгезії.
Недоліки
— Більш складна техніка для вивчення і виконання.
— Вища частота невдалого спінального компонента.
— Все ще ймовірне швидке зниження АТ.
— Нетестований епідуральний катетер, через що ви не можете повністю покладатися на функцію, якої очікуєте.
— Ускладнення як епідуральної, так і спінальної технік наявні.
— Ймовірність зростання частоти інфекційних ускладнень.
— Ймовірність ушкодження конуса.
Вибір ліків
Локальний анестетик
Доза інтратекально введеного ЛА буде залежати від показань до ПСЕА:
1. «Запасний варіант» у випадку неадекватності спінальної анестезії чи передбачувано тривалої чи складної хірургії:
— може бути використана стандартна доза 10–12,5 мг бупівакаїну;
— слід обережно промивати катетер сольовим розчином після введення, оскільки малий об’єм (2–3 мл) введеної речовини може спричинити суттєве цефальне поширення ЛА і швидке настання високого блоку.
2. Мінімізація гіпотензії:
— інтратекальна доза 5–7,5 мг бупівакаїну може зменшити швидкість настання і поширення блоку;
— показано, що зниження дози може спричинити необхідний сенсорний блок при безбольовій хірургії, що менше асоціюється з гіпотензією;
— протяжність (ширина) сенсорного блоку може реалізуватись введенням 5–10 мл сольового розчину через голку Tuohy перед введенням катетера;
— епідуральний катетер може також бути промитим 5 мл сольового розчину для поширення блоку;
— сенсорний блок, спричинений такою малою дозою, може бути достатнім у 50 % випадків залежно від exact точності дози і додаткового введення опіоїдів;
— основним недоліком є час анестезії (до 1 год при введенні зменшеної дози інтратекально);
— анестезіолог, перш ніж практикувати техніку з застосування низьких доз, повинен бути ознайомлений із методикою визначення інтратекального блоку і «доливання» епідурального компонента перед і під час хірургії;
— якщо є потреба додатково посилити сенсорний блок, необхідно додатково повільно ввести через епідуральний катетер 3–5 мл бупівакаїну 0,5% і провіряти блок кожні 5 хв.
Опіоїди
— Додаткове введення інтратекально опіоїдів (фентаніл 15–25 мкг чи суфентаніл 2,5–10 мкг) посилить якість сенсорного блоку і покращить інтраоперативну аналгезію, мусить завжди застосовуватись при введенні бупівакаїну менше 10 мг.
— Опіоїди тривалої дії забезпечують оптимальну постопераційну аналгезію.
Визначення блоку
— Ступінь сенсорного блоку повинен бути занотованим дуже уважно, включаючи визначення нижньої межі блоку. Білатеральний моторний блок є очікуваним унаслідок спінального компонента.
— Після кожного болюсного введення слід повторно визначати рівень.
— Матір повинна бути повністю готовою до відчуттів, які можуть бути під час хірургії і попереджена про ймовірність інтраопераційного болю чи дискомфорту і щодо методів їх усунення.
Ведення невдалого блоку
До операції
— Якщо нема справжнього сенсорного чи моторного блоку від спінального компонента ПСЕА, є два варіанти — повторити ту ж дозу спінально або поширити епідуральну анестезію de novо, застосовуючи болюси 5–10 мл бупівакаїну 0,5% чи левобупівакаїну 0,5%. Якщо є складності в постановці епідуального катетера, можна рекомендувати повторити всю ПСЕА.
— Якщо наявний певний ступінь сенсорного блоку, наростаючі дози локального анестетика повинні бути введені епідурально, наприклад, 5–10 мл бупівакаїну 0,5% чи левобупівакаїну 0,5% титровано.
— Якщо блок залишається інадекватним, ПСЕА або лише епідуральна анестезія повинна бути повторно виконана, тоді слід провести епідуральне «доливання» повільно в наростаючих дозах.
— Залежно від ургентності ситуації може виникнути необхідність у загальній анестезії. Оперуючий гінеколог повинен бути проінформованим про всі неочікувані складності чи відстрочення проведення регіональної анестезії.
Протягом операції
— Інадекватний блок може стати очевидним після початку операції, наприклад під час перитонеального розтину, вивертання матки, промокання білякишкових западин (кишень). На будь-якій стадії операції при цьому першорядним є запевнення матері та партнера, що чутливість буде ліквідована, також усі скарги про біль чи дискомфорт повинні бути обговорені з хірургом.
— Якщо біль проявився під час перитонеального розтину, тобто ще до добування дитини, можна покращити блок з подальшим «доливанням»локального анестетика ± опіоїди. Хірурга слід попросити призупинити операцію, поки не відновиться комфорт пацієнтки.
— Якщо епідуральне «доливання» є неефективним або ситуація вимагає невідкладного розродження і хірург не може призупинитись, єдиним шляхом є перехід до загальної анестезії.
— Якщо біль стає очевидним після добування дитини, хірург повинен зупинитись. Внутрішньовенно кетамін 10 мг є додатковою опцією. Якщо це неефективно, слід перейти до загальної анестезії.
— Якщо біль з’являється наприкінці операції, слід застосувати місцеву інфільтрацію місцевим анестетиком.
— Важливо віддиференціювати біль від неприємних відчуттів тиску/потягування. Вербальний контакт між командою анестезіологів та пацієнткою є дуже важливим при КР під регіональною анестезією.
— Всі пацієнти повинні бути оглянуті в післяпологовому періоді. Специфічна інформація про ймовірні причини неадекватності блоку повинна бути чітко пояснена.
Типові ускладнення
Гіпотензія — зниження систолічного та діастолічного тиску часто спостерігається при проведенні регіональної анестезії як наслідок аортокавальної компресії на фоні раптової блокади автономної нервової системи (у нормі автономна нервова система пом’якшує гемодинамічні ефекти аортокавальної компресії). Брадикардія менше 60 за 1 хв часто пов’язана з раптовою гіпотензією.
Лікування
— Посилити зміщення матки ліворуч шляхом нахилу на 20° або покласти в повну ліву латеральну позицію.
— Заохочується терапія вазопресорами ± ваголітиками (глікопіролат 200–400 мкг).
— Збільшити внутрішньовенне введення рідини.
— Прискорити хірургічне добування дитини, якщо для неї є загроза.
Проблеми з диханням
Не є рідкістю скарги матері на неможливість зробити глибокий вдих, покашляти або на тяжкість у грудях при поширенні блоку цефально. Це відбувається внаслідок парезу нижніх міжреберних м’язів, що призводить до пришвидшення дихання, зростання об’єму живота, обмеження рухів діафрагми в супінальній позиції. Стан покращується після добування дитини.
Лікування
— Перевірити верхній рівень блоку, досліджуючи моторну функцію рук.
— Помістити подушку під плечі і до середини грудної клітки. Це покращить діафрагмальне дихання.
— Моніторувати показання пульсоксиметра і застосувати кисень через маску при сатурації менше 95 %.
Біль голови
1. Вважається, що раптовий початок болю голови під час спінальної пункції чи негайно при ляганні є наслідком потрапляння повітря в інтратекальний простір і піднімання його краніально.
2. Біль голови в день опісля анестезії завжди повинен бути додатково досліджений.
3. Особливості болю такі:
— фронтальний біль, зазвичай білатеральний і позозалежний;
— затерпання шиї, знову ж таки залежне від пози;
— нудота, блювота;
— дзвін у вухах;
— розлади зору чи фотофобія.
4. Біль голови, що виникає внаслідок пункції твердої оболонки спинного мозку, часто є не таким гострим, як біль, асоційований із випадковою пункцією твердої оболонки голкою Tuohy. Іншими причинами болю голови в післяпологовому періоді, які слід виключити, є дегідратація, прееклампсія.
Внутрішньовенна прегідратація (пренавантаження)
Кристалоїди
— У 1960-ті роки Волман і Маркс продемонстрували, що гіпотензія може бути нівельована болюсним введенням кристалоїдів до початку проведення спінальної анестезії. Роут та інші (2011) відкрили, що лише застосування великих доз кристалоїдів болюсно (20 мл/кг) знижує інциденти гіпотензії до 55 % порівняно з 71 % без застосування кристалоїдів болюсно.
— Багато досліджень згодом не підтвердили ефективність цього методу і в цей час кристалоїди не є необхідними при внутрішньовенній прегідратації перед спінальною анестезією.
— Незначна ефективність кристалоїдів зумовлена їх коротким періодом перебуванням в судинах. Тому їх застосування слід розпочинати паралельно з початком спінальної анестезії.
— Введення великої кількості кристалоїдів спричиняє гемодилюцію і вивільнення натрійуретичного пептиду (вазодилататор), що призводить до стійкої гіпотензії.
— Низький онкотичний тиск у вагітних може бути додатково знижений великим пренавантаженням, що потенційно може призвести до набряку легень.
Колоїди
— Колоїди є більш ефективними в запобіганні гіпотензії. Пренавантаження 500 мл 10% ГЕК знижує випадки гіпотензії до 40 % порівняно з 80 % при використанні розчину Рінгера.
— Причиною ефективності колоїдів є їх повільний перерозподіл із судинного русла, що призводить до більш сталого зростання ЦВТ.
— Ефективність колоїдів повинна порівнюватись із негативними сторонами їх застосування (сприяють виникненню гострого пошкодження нирок, негативно впливають на гемостаз та ін.).
Обмотування нижніх кінцівок
— Існують докази, що обмотування ніг еластичними бинтами до проведення спінальної анестезії зменшує ймовірність виникнення гіпотензії.
— Піднімання ніг є простим і швидким методом лікування гіпотензії.
Вазопресори
Ефедрин
— Неспецифічний адренергічний агоніст, який в основному підвищує АТ шляхом збільшення серцевого викиду через вплив на bадренорецептори.
— Незначною мірою дія пов’язана з підвищенням системного судинного опору шляхом стимуляції a1-рецепторів.
— Унаслідок цього ефедрин має мінімальний або не має жодного впливу на матково-плацентарний кровообіг, що призвело до великої популярності препарату як засобу першої ліній.
— Дослідження у Британії у 1999 р. показало, що понад 95 % анестезіологів, які працюють в акушерстві, застосовують один ефедрин для контролю АТ під час спінальної анестезії при КР. Понад 60 % респондентів використовують його профілактично.
Переваги:
— простота розведення і застосування;
— може застосовуватись перорально, внутрішньо-м’язово, внутрішньовенно;
— має хороший показник безпеки.
Недоліки:
— при зростанні ЧСС і скоротливості міокарда збільшується його потреба в кисні, що важливо враховувати в жінок із захворюваннями серця;
— повільний початок дії і, відповідно, довготривалість впливу спричиняють складність акуратного титрування;
— ризик виникнення ектопій, тахіаритмій та тахіфілаксії;
— застосування препарату пов’язане зі зниженням рН артеріальної пупкової крові. Найвірогідніше це пов’язане з прямим впливом на метаболізм плода. Ефедрин проникає через плаценту, стимулює b-адренорецептори плода, збільшує споживання кисню і продукцію лактату.
Фенілефрин
— Базуючись на тваринних моделях, цей препарат викликає вазоконстрикцію, погіршуючи матково-плацентарний кровообіг. На підставі цього вважалося, що його застосування в акушерстві не рекомендоване.
— Клінічні дослідження у людей із застосуванням невеликих доз препарату не показали побічних впливів на плід чи новонароджену дитину.
— Фенілефрин підвищує АТ шляхом збільшення системного судинного опору внаслідок прямого впливу на a1-рецептори.
— З огляду на механізм його дії, для корекції гіпотензії, зумовленої вазодилатацією при симпатичному блоку, логічніше застосовувати фенілефрин, ніж ефедрин.
Режими дозування:
— внутрішньовенно 100 мкг/мл (10 мг у 100 мл 0,9% Sol. NaCl розчину) зі швидкістю 60 мл/год (висока доза);
— внутрішньовенно 12,5 мкг/мл (приготованого розчину) зі швидкістю 80–100 мл/год (низькодозова інфузія);
— внутрішньовенно болюсно 12,5–50 мкг за необхідності.
Показання:
— стабілізація АТ матері (разом з тим є позитивний ефект на утероплацентарну перфузію);
— швидкий початок і короткочасність дії забезпечують легке титрування порівняно з ефедрином.
Протипоказання:
— типовим є виникнення рефлекторної брадикардії, тому завжди повинен бути доступними антихоліноергіки;
— фенілефрин доступний у різних концентраціях (10 мг/мл, 1 мг/мл, 250 мкг/мл, 12,5 мкг/мл), що використовуються під час невідкладної допомоги.
Поєднання двох вазопресорів:
— ризик брадикардії зменшується при поєднанні ефедрину з фенілефрином;
— проте є небагато доказів користі поєднання цих двох препаратів;
— у дослідженнях, у яких показано розвиток нудоти і блювання при поєднанні цих двох препаратів, не було оптимального співвідношення, комбінації доз;
— метарамінол: існує небагато досліджень його використання.
Підсумок
— Гіпотензія, поєднана з нейроаксіальною блокадою при кесаревому розтині, повинна бути швидко мінімізована для запобігання ускладненням зі сторони матері та плода.
— Для запобігання гіпотензії досліджувалось багато методів, але все-таки єдиного загальновизнаного методу на цей час немає.
— Ефективність навантаження кристалоїдами є спірною, але швидке введення кристалоїдів у процесі проведення спінальної анестезії може бути корисним.
— Колоїди є більш ефективними, ніж кристалоїди для профілактики гіпотензії.
— Фенілефрин має численні переваги над ефедрином і розглядається в цей час препаратом вибору для профілактики гіпотензії при проведенні спінальної чи епідуральної анестезії в акушерстві.
Загальна анестезія
Доопераційна підготовка
1. Профілактика регургітації та аспірації (див. вище).
2. При виникненні невідкладного стану продовжувати активні заходи з ресусцитації плода:
— припинити інфузії окситоцину;
— покласти матір у повне латеральне положення на лівому боці під час транспортування її в пологову залу;
— оксигенотерапія;
— внутрішньовенна інфузія кристалоїдів;
— гіпотензію слід коригувати застосуванням вазопресорів внутрішньовенно.
— токоліз.
Індукція
— Покласти матір супінально з нахилом латерально вліво, надати оптимальну позицію голові.
— Преоксигенація (при невідкладній ситуації 8 глибоких вдихів у межах 1 хв зі швидкістю потоку кисню 15 л/хв).
— Застосовується притискання перснеподібного хряща.
— Швидка поступова індукція анестезії здійснюється за допомогою:
– тіопенталу натрію 5–7 мг/кг;
– суксаметоніуму 1,5 мг/кг;
– рокуроніуму 0,6–0,8 мг/кг, якщо пацієнт має протипоказання до суксаметоніуму.
— У пацієнтів із прееклампсією застосувати болюсно 60 мг/кг магнезії.
Утримання анестезії
Перед народженням
— Вентилювати до нормокапнії (4,0–4,5 кРа) сумішшю кисню й закису азоту 50 : 50.
Після народження
— Рівень стола для покращення хірургічного доступу.
— Знизити О2 до 30 %.
— Ввести окситоцин 5 МО внутрішньовенно повільно.
— Антибіотикопрофілактика згідно з локальним протоколом.
— Внутрішньовенна опіатна аналгезія:
– 100 мкг фентанілу.
– 10 мг морфіну.
– Або застосувати морфін 4 мг, або діаморфін 2,5 мг епідурально, якщо встановлений катетер.
— Диклофенак 100 мг ректально, якщо попередньо одержана інформована згода, або в/в 75 мг розведеного диклофенаку у 100 мл 0,9% Sol. NaCl.
— Парацетамол 1 г внутрішньовенно.
— Розглянути білатеральну ілеоінгвінальну блокаду.
Локальна анестезія
— Локальна інфільтрація рани хірургом.
— Білатеральна ілеоінгвінальна блокада, субфасціальна інфільтрація або інфільтрація під прямим м’язом є доповненням або альтернативою системної аналгезії.
Екстубація і післяопераційне лікування
— Якщо у пацієнта були складності при інтубації, слід застосувати екстремальну обережність при екстубації.
— Тривають дебати, яку позицію надати матері під час екстубації — ліву латеральну чи сидячу:
– ліва бокова позиція застосовується рентгенологами для підтримки шлунка порожнім, сприятиме виведенню щелепи наперед, є оптимальною позицією при регургітації та блювоті;
– сидяча позиція у вертикальному положенні забезпечує вільну екскурсію діафрагми, що важливо в пацієнток з ожирінням. Якщо внутрішньочеревний тиск є високим, все ще ймовірна регургітація в лежачому положенні.
— Ларингеальна функція порушена протягом декількох годин після анестезії, таким чином, пацієнт знаходиться в стані підвищеного ризику аспірації шлункового вмісту.
— Постопераційний догляд повинен здійснюватись лікарями-акушерами, які мають тренінги щодо лікування обструкції дихальних шляхів.
— Якщо були будь-які труднощі з інтубацією, мати повинна бути повністю проінформована про це. Потрібно видати матері лист для зберігання з повним описом проблеми і методів її усунення. Копія зберігається в документації про проведену ЗА.
Медикаментозні засоби для проведення ЗА
Індукційні агенти
Тіопентал натрію
— Залишається золотим стандартом.
— Швидкий прогнозований сон із заплющенням очей робить його найлегшим засобом, коли є необхідність швидкого застосування суксаметоніуму.
— Забезпечує надійну анестезію тривалістю 5–7 хв.
— У дозі 4 мг/кг седація дитини є мінімальною.
— У вищій дозі (8 мг/кг) може відбутись седація дитини.
— Швидкий перерозподіл у циркуляції матері та дитини може призвести до народження дитини в бадьорому стані.
Пропофол
— Незважаючи на високу популярність в акушерській практиці, не є препаратом першого вибору в акушерстві.
— Брак чіткої індукції кінцевих точок і ненадійний сон робить його складним засобом для послідовної індукції наркозу.
— У дозі 2,5 мг/кг дитя народжується бадьорим, у вищих дозах (6 мкг/кг/год) — у стані седації.
— Швидке прокидання.
Кетамін
— Описаний для індукції анестезії у матерів із гострими гемодинамічними розладами.
— Не є ідеальним засобом. Оскільки індукція є повільною, а кінцеві точки складно визначити.
— Викликає галюцинації та делірій, особливо у непремедикованих матерів.
— У дозі 1 мг/кг вплив на стан дитини порівнянний із тіопенталом.
— У дозі 2 мг/кг (ймовірно, краща доза для матері) може очікуватись пригнічення новонародженого.
Етомідат
— Описаний для індукції в матерів із тяжкими розладами гемодинаміки.
— У дозі 0,3 мг/кг дитина народжується бадьорою. Тривалість сну при дозі етомідату 0,2 мг/кг становить 2–3 хв, при дозі 0,3 мг/кг — 4–5 хв.
— Засіб асоційований із відчуттям болю при ін’єкціях, міоклонічною ригідністю, мимовільними рухами, що робить його складним для швидкої послідовної індукції.
— Больова чутливість і рефлекторна діяльність при моноанестезії зберігаються, тому інтубація трахеї і виконання інших болючих маніпуляцій є недопустимими.
Бензодіазепіни
— Через повільний початок дії і підвищений ризик аспірації є менш придатними порівняно з іншими засобами.
— Мідазолам у початковій дозі 0,2 мг/кг асоційований із пролонгованою седацією новонародженого, подовжуючи час відновлення дихання (порівняно з тіопенталом натрію).
— Асоціюються з поганим вигодовуванням, неонатальною гіпотермією, гіпотонією і жовтяницею новонароджених.
Нейромускулярні агенти
Суксаметоніум
— У даний час залишається препаратом вибору в акушерстві, оскільки створює швидкі ідеальні умови для інтубації і швидкий реверс ефекту.
— Застосовується в дозі 1–1,5 мг/кг.
— Спонтанне дихання відновлюється протягом 1–5 хв.
— Час нейромускулярного відновлення може бути дещо подовженим у вагітних через фізіологічне «розведення» псевдохолінестерази.
— Суксаметоніум не проникає через плаценту, тому не впливає на дитину.
— Описано випадок неонатального паралічу новонародженого з дефіцитом псевдохолінестерази, народженого матір’ю з таким ж дефіцитом.
— Ефект нейромускулярного блокування не усувається введенням магнію сульфату, але фасцикуляції послаблюються і стають складними для візуалізації.
Протипоказання до суксаметоніуму такі ж, як у неакушерській популяції.
Недеполяризуючі міорелаксанти
— Досить широко вивчені векуроніум, атракуріум, рокуроніум.
— Вони не проникають через плаценту.
— Широко описано, що застосування рокуроніуму сприяє настанню швидкого послідовного початку анестезії, якщо є протипоказання до суксаметоніуму.
— Може застосовуватись у дозі 0,6–0,8 мг/кг, забезпечуючи добрі умови для інтубації в межах 70 с.
— Така доза спричиняє міорелаксацію на 45 хв.
— Дія всіх недеполяризованих препаратів ослаблюється магнезією. Слід добре моніторувати нейромускулярну функцію у період її відновлення, а також у післяопераційний період.
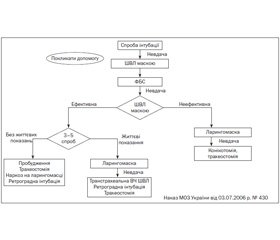
Одним із найпоширеніших ускладнень є тяжка інтубація, яка в акушерстві зустрічається значно частіше (1 : 250), ніж в інших галузях медицини (1 : 2000). Завжди треба пам’ятати алгоритм тяжкої інтубації трахеї і бути готовим до неї (рис. 2).
Інгаляційні засоби
Закис азоту
— Вільно проникає через плаценту і концентрація у новонароджених зростає протягом 15 хв при застосуванні у матері.
— Концентрація понад 50 % призводить до депресії новонародженого.
— Застосування лише закису азоту і кисню спричиняє легку анестезію, збільшує рівень катехоламінів матері, побічні ацидоз-залежні стани у дитини, також збільшує ризик прокидання під час операції.
— Його основними перевагами є те, що він не спричиняє релаксації матки, може використовуватися для зменшення потреби в летких речовинах.
Опіоїди
— Опіоїди зазвичай є частиною швидкої послідовної індукції в акушерській практиці.
— Спричиняють депресію новонародженого.
— 100–200 мкг фентанілу або 10 мг морфіну повинні бути введені після народження дитини.
— 1 мг алфетанілу чи 100 мкг фентанілу при індукції допоможуть притупити реакцію на інтубацію (щоб уникнути тахікардії чи гіпертензії).
Вкрай важливим моментом є екстубація породіль, особливо з проявами прееклампсії/еклампсії. Критерії екстубації подані в табл. 4.
Медикаменти для скорочення матки
Існує 4 основні фармакологічні засоби для скорочення матки під час пологів:
— Синтоцинон — синтетичний аналог окситоцину.
— Ергометрин.
— Карбопрост — аналог простагландину F2.
— Мізопрост — аналог простагландину Е2.
Окситоцин (синтоцинон) — синтетичний нонапептид
— Ін’єкції показані для виникнення чи посилення скорочення матки під час пологів і для контролю післяпологових кровотечі чи геморагій.
— Після внутрішньом’язового введення ефект розпочинається через 3–7 хв і триває 30–60 хв.
— При внутрішньовенному введенні ефект настає через 1 хв і триває менше.
— Дозування — 5 МО повільно внутрішньовенно болюсно і/або 30–50 МО в 500 мл кристалоїдного розчину внутрішньовенно титровано.
Метаболізм
— Виводиться швидко з плазми шляхом гідролізу в печінці й нирками під впливом окситокінази.
— Час напіввиведення — 1–7 хв.
Побічні ефекти: нудота, блювота, гіпотензія, гіпертонус матки, інтоксикація водою і гіпонатріємія.
Протипоказання: захворювання серця, гіпотензія.
Ергометрину малеат
Препарат застосовується для запобігання післяпологовій кровотечі, викликає сильну контракцію матки зазвичай після періоду релаксації.
Доза і час дії:
— післяпологова доза — 200 мкг внутрішньо-м’язово;
— При невідкладному стані 200 мкг можна ввести внутрішньовенно повільно (довше 1 хвилини);
— Після внутрішньовенного введення контракція матки настає через 1 хв і триває до 45 хв;
— Після внутрішньом’язового введення контракція настає через 2–5 хв і триває ≥ 3 год.
Метаболізм і виведення: метаболізується печінкою, виводиться з калом.
Побічні ефекти: вазоконстрикція, гіпертензія і брадикардія, біль голови.
Протипоказання: гіперчутливість до препарату, еклампсія або прееклампсія, сепсис, захворювання периферійних судин, серця, гіпертензія, Порушена функція печінки чи нирок.
Синтетичний окситоцин і ергометрину малеат (синтометрин)
— Синтометрин поєднує швидкий вплив на матку окситоцину зі стійким ерготонічним ефектом ергометрину.
— Використовується для попередження і лікування післяпологової кровотечі, асоційованої з атонією матки.
Дози і час дії:
— кожен 1 мл ампули містить 5 МО синтетичного окситоцину і 500 мкг ергометрину малеату;
— 1 мл внутрішньом’язово після експульсії плаценти або при виникненні кровотечі. Ще 1 мл можна ввести після 2 год;
— сумарна доза в межах 24 год не повинна перевищувати 3 мл.
Метаболізм і виведення: такі ж, як у окситоцину і ергометрину.
Протипоказання: підвищена чутливість до будь-якого компонента, гостра гіпертензія, прееклампсія/еклампсія, серцева, печінкова та ниркова дисфункції.
Побічні ефекти: нудота, блювання, гіпертонус матки, гіпертензія, брадикардія, аритмія, анафілактоїдні реакції.
Карбопросту трометамін, ін’єкції (гемабат)
— Карбопрост — окситоцин, який вміщує трометамінову сіль 15S–15-метил, аналог натурального простагландину F2.
— Карбопрост застосовується для лікування післяпологової кровотечі лише тоді, коли окситоцин і ергометрин не були ефективними для зупинки кровотечі.
Дозування і час дії:
— 1 мл гемабату містить 250 мкг карбопросту і застосовується глибоко внутрішньом’язово (небезпечно внутрішньовенно);
— наступна доза 250 мкг можу бути введена через 90 хв, однак інтервал може бути скороченим до 15 хв при гострій кровотечі;
— загальна доза карбопросту не може перевищувати 2 мг.
Побічні ефекти: нудота, блювота, діарея, гіпертермія, бронхоспазм, ризик набряку легень зі збільшенням дози.
Протипоказання: відома гіперчутливість, астма, гострі запальні захворювання таза, захворювання серця, печінки, нирок, легень.
Мізопростол
— Аналог простагландину Е2, часто застосовується для індукції пологів.
— Також відіграє важливу роль як препарат третьої чи четвертої лінії лікування атонії матки, коли синтоцинон і ергометрин були неефективними.
1. Запорожан В.Н., Тарабрин О.А. Спинальная анестезия при оперативном родоразрешении. — К.: Старт–98. — 2013. — 316 с.
2. Корячкин В.А., Страшнов В.И. Спинальная и эпидуральная анестезия: Пособие для врачей. — М., 1998. — 80 с.
3. Суслов В.В. Эпидуральная анестезия и анальгезия. — Харьков: СИМ, 2011. — 254 с.
4. NHS Caesarean section clinical guideline. National institute for Health and Clinical Excellence 2005. http://www/nice/org/uk
5. Levy D.M. Emergency caesarean section: best practice. Review article // Anaesthesia. — 2006. — 61. — 786–791.

/16/16.jpg)
/18/18.jpg)
/19/19.jpg)
/25/25.jpg)
/26/26.jpg)