Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Использование пропофола у детей, или немного новой информации об известном препарате
Авторы: Дмитриев Д.В. - Винницкий национальный медицинский университет, курс анестезиологии
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье обобщена информация по препарату пропофол. Изложены история его создания, механизм действия, дан обзор исследований этого препарата, сделан вывод о целесообразности его использования, в том числе в детской анестезиологии.
У статті узагальнена інформація по препарату пропофол. Викладені історія його створення, механізм дії, даний огляд досліджень цього препарату, зроблено висновок про доцільність його використання, у тому числі в дитячій анестезіології.
The paper generalizes information on propofol. There are presented the history of its creation, mechanisms of action, a review of studies of this drug. Thee have been concluded about the usefulness of this drug, especially in children.
анестезиологическое пособие, дети, пропофол.
анестезіологічний посібник, діти, пропофол.
anesthesiologic measures, children, propofol.
Статья опубликована на с. 67-70
Анестезиологическое обеспечение хирургических операций у детей предъявляет жесткие требования к подбору препаратов с учетом максимальной эффективности, безопасности, управляемости и адекватности общей анестезии. Современные внутривенные анестетики и аналгетики стали доступными для использования при тотальной внутривенной анестезии у детей.
В последние 20 лет, с появлением в анестезиологической практике мощных гипнотиков и аналгетиков неингаляционного типа, тотальная или сбалансированная внутривенная анестезия в комбинации с миорелаксацией и искусственной вентиляцией легких стала повсеместно использоваться при оперативных вмешательствах у детей.
Развитие современной анестезиологии во многом определяется прогрессом фармакологии. Синтез новых анестетиков и адъювантных препаратов не только расширяет арсенал анестезиолога, но и позволяет решить некоторые специальные проблемы, ранее вызывавшие значительные затруднения.
Применение внутривенных препаратов, фармакологический профиль которых позволяет рассчитывать оптимальную дозировку и скорость введения в каждом конкретном случае, в том числе с помощью автоматизированных инфузионных систем, обеспечивает высокую надежность и безопасность анестезии.
Сказанное в полной мере справедливо в отношении пропофола, внутривенного гипнотика ультракороткого действия.
Исходя из вышеизложенного хотелось бы вспомнить, обобщить некоторые данные и осветить новую информацию об этом хорошо известном анестезиологам препарате.
История вопроса
Изначально препарат пропофол (2,6-диизопропилфенол) представлял собой 1% жировую эмульсию в составе 16% полиоксиэтилированного касторового масла. Этот препарат вызывал сильную боль при инъекции и анафилактоидную реакцию [1–3]. Начиная с 1982 года пропофол стали смешивать в объеме 10 мг/мл с жировой эмульсией (Intralipid®), состоящей на 10 % из соевого масла (триглицериды с длинной цепью). Смесь не вызывала какую-либо известную анафилактоидную реакцию, но на умеренную или сильную боль при инъекции все еще жаловались от 32 до 67 % пациентов [4–6]. Предыдущие исследования показали, что причиной болевых ощущений при инъекции является высокая концентрация свободного пропофола в водной фазе эмульсии [7–8]. Дополнительное разбавление данной смеси препаратом Intralipid® снизило частоту и интенсивность боли при инъекции [8], скорее всего, благодаря уменьшению содержания свободного пропофола в водной фазе эмульсии.
Форма выпуска — ампулы по 20 мл и флаконы по 50 и 100 мл. Кроме основного вещества (10 мг/мл), препарат содержит в своем составе воду, NaОН, глицерин, очищенные яичные фосфатиды, соевое масло. Несмотря на наличие масляных компонентов в составе препарата, он полностью соответствует требованиям международной конвенции по допущению к введению в кровеносное русло жиросодержащих веществ: случаев возникновения жировой эмболии вследствие применения пропофола в литературе не описано.
Механизм действия препарата такой же, как и большинства средств для внутривенной анестезии. Доказано, что имеет место ингибирование ГАМК-медиаторной трансмиссии, как, например, при действии бензодиазепиновых препаратов. Своему широкому применению препарат в значительной мере обязан уникальности своей фармакокинетики, которая может быть описана с помощью трехкамерной модели.
Однако прежде следует отметить высокое сродство препарата к белкам плазмы — с ними связывается до 98 % введенной дозы. В фазу распределения пропофол поступает из крови в ткани (t1/2 = 2–4 мин); затем, в фазу элиминации, происходит быстрый клиренс (в основном за счет печеночного метаболизма) (t1/2 = 30–60 мин); в заключительную фазу клиренс несколько сдерживается вследствие медленного возврата пропофола в кровь из недостаточно перфузируемых тканей. Быстрому влиянию на центральную нервную систему способствует высокая липофильность пропофола, в результате чего выключение сознания наступает очень быстро, через 30–40 с от начала введения препарата, а его концентрация в плазме крови уже через 10 мин составляет лишь около 40 % от начальной, последовательно снижаясь к исходу первого часа до 14 %. Следует подчеркнуть, что фармакокинетические параметры пропофола схожи независимо от того, вводится он посредством повторных болюсов или методом постоянной инфузии. Пробуждение наступает обычно при достижении им концентрации в крови порядка 0,01 мг/мл.
Известно, что скорость и эффективность действия любого лекарственного средства в значительной мере определяется величиной клиренса и объемами распределения. Линейность фармакокинетики препарата обеспечивает предсказуемость его действия. Неактивность продуктов метаболизма является залогом того, что препарат не будет обладать нежелательными эффектами.
Кратко вспомним влияние препарата на основные жизненно важные функции детского организма.
Пропофол способен вызывать угнетение самостоятельного дыхания вплоть до апноэ в процессе вводной анестезии, так как этот препарат обладает двухфазным действием на дыхательную функцию и вслед за фазой гипервентиляции всегда наступает фаза выраженной, вплоть до апноэ, гиповентиляции.
Важным гемодинамическим свойством пропофола является его способность вызывать гипотензию, обусловленную, по-видимому, снижением общего периферического сопротивления. При использовании пропофола для индукции в обычных дозах (1,5–2,0 мг/кг), как правило, отмечают снижение артериального давления — от 10 % у детей. Особенно ценно то, что пропофол ослабляет прес–сорную реакцию гемодинамики в ответ на интубацию трахеи. Кроме того, обусловливая гиподинамическую реакцию кровообращения, пропофол опосредованно действует и на внутричерепное, и, кстати сказать, на внутриглазное давление.
В значительной мере это и определяет успех применения препарата при анестезии в нейро- и офтальмохирургии, а также в интенсивной терапии черепно-мозговой травмы, где пропофол используется для медикаментозной седации и адаптации пациентов к аппаратам искусственной вентиляции легких.
Исходя из особенностей фармакодинамики, фармакокинетики и клиники анестезии, пропофол отвечает всем требованиям к подбору препаратов с учетом максимальной эффективности, безопасности, управляемости и адекватности общей анестезии у детей.
Клинические исследования пропофола у взрослых показали четкую дозозависимость и прогнозируемость эффектов в сочетании с практически полным отсутствием постмедикации и минимальным спектром осложнений.
Следует отметить, что на рынке Украины представлено достаточное количество данного препарата от разных производителей, что затрудняет выбор практического врача, который в большинстве случаев основывается на традициях клинического учреждения.
Именно поэтому хотелось обобщить информацию по данному препарату.
Известно, что некоторые препараты пропофола можно использовать у детей с 3 лет, а другие — с возраста 1 месяц. Следует отметить, что на рынок вышли препараты, в которых растворителем пропофола являются длинноцепочечные и среднецепочечные триглицериды. Именно на растворителях пропофола хотелось бы остановить свой взгляд и задать вопрос: зачем они нужны и что нужно знать клиницисту при выборе препаратов пропофола?
Немного новой информации к размышлению
Пропофол МСТ/ЛСТ (Пропофол Каби 1%, 2%, «Фрезениус Каби Дойчланд ГмбХ», Германия) представляет собой растворы пропофола 10 и 20 мг/мл в 10% жировой эмульсии MCT/ЛСТ, и в отличие от предыдущих препаратов масляная фаза эмульсии пропофола состоит из среднецепочечных триглицеридов (МСТ) наряду с длинноцепочечными триглицеридами (ЛСТ), что способствует улучшению переносимости препарата Пропофол Каби пациентами по сравнению с пропофолом, растворенным в чистой ЛСТ-эмульсии. Данное преимущество связано с тем, что Пропофол Каби 1% МСТ/ЛСТ жировая эмульсия служит системой доставки лекарственного вещества, преобразовывая нерастворимые и слабо растворимые в воде компоненты в парентерально применимую форму. Благодаря триглицеридам с цепью средней длины (МСТ) растворяющая способность Пропофол Каби 1% значительно выше в сравнении с жировыми эмульсиями, содержащими только триглицериды с длинной цепью (ЛСТ).
Следует отметить, что европейские регуляторы не требуют наличия консерванта в составе препарата, отсутствие консервантов не отражается на сроке годности препаратов, что доказывается результатами физико-химических анализов. Отсутствие такого консерванта, как ЭДТА, исключает дополнительное взаимодействие пропофола с препаратами, содержащими соли металлов, а также нет убедительных данных о контаминации препаратов пропофола, не содержащих консервантов, в процессе хранения.
H. Ohmizo и соавт. (2005) описали изменение состава жировой эмульсии-носителя: замена ЛCT на ЛCT/MCT не влияет на фармакокинетику и эффективность действия пропофола, но способствует улучшению переносимости препарата пациентами, снижая частоту сильных и умеренных болевых ощущений при инъекции, уменьшению частоты возникновения тромбофлебитов после введения, снижению негативного влияния на липидный обмен у больных с его выраженным исходным нарушением (несмотря на относительно небольшие количества жировой эмульсии, вводимые в процессе анестезии (рекомендации ESPEN, 2009)). Значение этого фактора увеличивается с возрастанием длительности анестезии. Пропофол ЛCT/MCT оказывает меньшее влияние на уровень липидов крови при трансплантации печени и поэтому более удобен при данном виде хирургии (Zhang и соавт., 2011) по сравнению с пропофолом, растворенным в чистой ЛСТ-эмульсии.
Давно известно, что болевые ощущения при инъекции являются наиболее распространенной побочной реакцией при введении пропофола. В рандомизированных перекрестных исследованиях с участием мужчин-добровольцев (возрастом 24–42 года), разделенных на две группы, авторы сравнивали фармакокинетику и фармакодинамику нового препарата пропофола (с концентрацией 1 и 2 %), растворенного в жировой эмульсии МСТ/ЛСТ, содержащей триглицериды со средней длиной цепи (МСТ) и триглицериды с длинной цепью (ЛСТ) по сравнению со стандартным препаратом пропофола, растворенным в ЛСТ жировой эмульсии. После внутривенной болюсной инъекции 2 мг/кг уровень пропофола в крови измерялся в течение 24 часов и оценивался с помощью открытой трехкамерной модели. Производные фармакокинетические показатели разных смесей между собой не различались.
Кроме того, электроэнцефалографические данные начала и сама длительность гипнотического действия при использовании разных смесей были практически идентичными. На сильную или умеренную боль при инъекции пожаловалось меньшее количество добровольцев (9 %) из группы, принимавшей пропофол в составе новой 1% смеси, по сравнению с теми, кто принимал стандартную смесь (59 %) (р < 0,05). Далее было изучено количество свободного пропофола в водной фазе 1% раствора пропофола в 10% жировой эмульсии, состоящей из триглицеридов со средней длиной цепи и триглицеридов с длинной цепью. После медленного перемешивания сырьевого материала пропофола в препарате MCT/ЛСТ 10% в течение 48 ч пропофол был полностью абсорбирован эмульсией. В этой смеси концентрация свободного пропофола в водной фазе эмульсии составила 14,0 ± 0,5 мкг/мл, в то время как у препарата пропофола ЛСТ 1% — 18,6 ± 0,6 мкг/мл, на 25 % больше [7]. Препараты с 10 и 20 мг/мл пропофола — Propofol 1% и 2%, которые мы исследовали, были произведены посредством прямого эмульгирования, 1% смесь пропофола вызывает существенно менее ощутимую боль при инъекции, что подтверждает предположение о том, что частотность случаев боли при инъекции пропофола коррелирует с количеством свободного пропофола в водной фазе эмульсии.
Авторы связывали эти результаты с пониженной концентрацией свободного пропофола в водной фазе новой смеси. И пришли к выводам, что изменение состава жировой эмульсии-носителя не влияет на фармакокинетику и эффективность действия пропофола, но способствует улучшению переносимости препарата пациентами, снижая частоту сильных и умеренных болевых ощущений при инъекции.
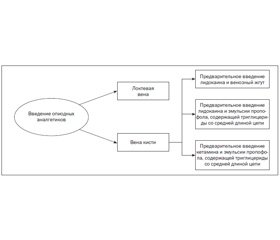
L. Jalota и соавт. представили в новом метаанализе [1] оригинальный алгоритм предотвращения боли при введении пропофола (рис. 1).
Авторы ставили перед собой цель проанализировать результаты 177 (данные более 25 000 больных) рандомизированных контролируемых исследований (РКИ), в которых изучались фармакологические, нефармакологические методы предупреждения возникновения боли при введении пропофола или их комбинация. В качестве нефармакологических методов предупреждения боли в исходных РКИ исследовано влияние различной скорости инфузии, венозного жгута, диаметра внутривенно вводимых игл, места венепункции, роли микрофильтрации, температуры раствора, бактериостатических солевых растворов. Среди них наиболее эффективным методом является использование для введения препарата локтевой вены в сравнении с венами кисти. При анализе эффективности фармакологических методов профилактики L. Jalota и соавт. пришли к следующим выводам:
— смесь лидокаин + пропофол является самым эффективным методом профилактики боли;
— аналгезирующим эффектом обладает предварительное введение наркотических аналгетиков, предварительное введение NMDA-антагониста кетамина и нестероидных противовоспалительных средств;
— позитивным эффектом обладают препараты, содержащие средне- и длинноцепочечные триглицериды, в сравнении с теми, которые содержат длинноцепочечные жиры.
В заключение следует сказать о том, что внедрение пропофола в повседневную практику детского анестезиолога улучшает качество анестезиологического обеспечения в целом, повышает безопасность пациентов. Использование в качестве растворителя жировой эмульсии, содержащей триглицериды со средней длиной цепи (МСТ) и триглицериды с длинной цепью (ЛСТ), возможно, снижает болевые проявления при введении препарата, способствует уменьшению частоты возникновения тромбофлебитов после введения, снижает негативное влияние на липидный обмен у больных с его выраженным исходным нарушением (значение этого факта увеличивается с возрастанием длительности анестезии), что особенно ценно для проведения комфортной и безопасной анестезии у детей.
1. Briggs L.P., Clarke R.S., Watkins J. An adverse reaction to the administration of disoprofol (Diprivan) // Anaesthesia. — 1982. — 37. — 1099–101.
2. Clarke R.S., Dundee J.W., Gerrett F.T. et al. Adverse reactions to intravenous anaesthetics // Br. J Anaesth. — 1975. — 47. — 575–85.
3. Dye В., Watkins J. Suspected anaphylactic reaction to Cremophor EL // BMJ. — 1980. — 280. — 1353.
4. Bryson H.M., Fulton B.R., Faulds В. Propofol: an update of its use in anaesthesia and conscious sedation // Drugs. — 1995. — 50. — 513–59.
5. Fulton B., Sorkin E.M. Propofol: an overview of its pharmacology and a review of its clinical efficacy in intensive care sedation // Drugs. — 1995. — 50. — 636–57.
6. Nathanson M.H., Gajraj N.M., Russel J.A. Prevention of pain on injection of Propofol: a comparison of lidocaine with alfentanil // Anesth. Analg. — 1996. — 82. — 469–71.
7. Babl J., Doenicke A., Mönch V. New Propofol LCT/MCT fat emulsions as solvent: approach to reducing pain on injection of Propofol? // Eur. Hosp. Pharm. — 1995. — 1. — 15–21.
8. Doenicke A.W., Roizen M.F., Rau J. Reducing pain during injection: the role of the solvent // Anesth. Analg. — 1997. — 82. — 472–4.
9. Heinzel G., Woloszczak R., Thomann P. TopFit Version 2.0: pharmacokinetic and pharmacodynamic data analysis system for the PC. — New York: G. Fischer, 1993.
10. Doenicke A., Löffler B., Kugler J. et al. Plasma concentration and E.E.G. after various regimens of Etomidate // Br. J Anaesth. — 1982. — 54. — 393–400.
11. Klement W., Arndt J.O. Pain on injection of Propofol: effects of concentration and diluent // Br. J. Anaesth. — 1991. — 67. — 281–4.
12. Johnson R.A., Harper N.J., Chadwick S., Vohra A. Pain on injection of Propofol: methods of alleviation // Anaesthesia. — 1990. — 45. — 439–42.
13. McCulloch M.J., Lees N.W. Assessment and modification of pain on injection with Propofol (Diprivan) // Anaesthesia. — 1985. — 40. — 1117–20.
14. Scott R.P., Saunders D.A., Norman J. Propofol: clinical strategies for preventing the pain of injection // Anaesthesia. — 1988. — 43. — 492–4.
15. McLeskey C.H., Walawander C.A., Nahrwold M.L. et al. Adverse events in a multicenter phase IV study of Propofol: evaluation by anesthesiologists and postanesthesia care unit nurses // Anesth. Analg. — 1993. — 77. — S3–4.
16. King S.Y., Davis F.M., Wells J.E. et al. Lidocaine for the prevention of pain due to injection of Propofol // Anesth. Analg. — 1992. — 74. — 246–9.
17. Stokes D.N., Robson N., Hutton P. Effect of diluting Propofol on the incidence of pain injection and venous sequaelae // Br. J Anaesth. — 1989. — 62. — 202–3.
18. Liljeroth E., Akeson J. Less local pain on i ntravenous infusion of a new propofol emulsion // Acta Anaesthesiol. Scand. — 2005. — 49. — 248–51.
19. Jalota L., Kalira V., Goerge E. et al. Prevention of pain on injection of propofol: systematic review and meta-analysis // BMJ. — 2011. — Online first.
20. Picard P., Tramer M.R. Prevention of pain on injection with propofol: a quantitative systematic review // Anesth. Analg. — 2000. — V. 90. — P. 963–969.
21. Wijeysundera D.N., Kavanagh B.P. Prevention of pain from propofol injection // BMJ. — 2011. — Online first.
22. Macarino A., Weinger M., Troung P. et al. Which clinical anesthesia outcomes are both common and important to avoid? The perspective of panel of expert anesthesiologists // Anesth. Analg. — 1999. — V. 88. — P. 1085–1091.

/70/70.jpg)