Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Мультимодальний підхід у періопераційному знеболенні дітей
Авторы: Міщук В.Р. - Львівський національний медичний університет імені Данила Галицького
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті наведено аналіз анестезіологічного забезпечення та післяопераційного знеболювання у 42 дітей, яким була застосована мультимодальна аналгезія. Нами показано високу ефективність і надійність цієї методики, а також її позитивний вплив на реабілітацію дітей у ранньому післяопераційному періоді.
В статье приведен анализ анестезиологического обеспечения и послеоперационного обезболивания у 42 детей, которым была применена мультимодальная аналгезия. Нами показана высокая эффективность и надежность данной методики, а также ее положительное влияние на реабилитацию детей в раннем послеоперационном периоде.
The paper presents an analysis of anesthesia and postoperative analgesia in 42 children in whom we used multimodal analgesia. We show high efficiency and reliability of this technique and its positive impact on rehabilitation of children in the early postoperative period.
мультимодальна анестезія, епідуральна блокада.
мультимодальная анестезия, эпидуральная блокада.
multimodal anesthesia, epidural blockade.
Статья опубликована на с. 71-74
Вступ
Особливість сприйняття болю в новонароджених і немовлят обумовлена функціональною незрілістю системи ноцицепції, низьким больовим порогом, довготривалою реакцією на біль, широкими рецептурними полями, а також незрілістю системи низхідного контролю болю, що регулює поріг сприйняття шкірних рецепторів і тривалість відповіді на біль [2, 3].
З ростом дитини реакція на біль змінюється не тільки за рахунок дозрівання ноцицептивних шляхів та інтеграції у вищих центрах, а й за рахунок розвитку пізнавальної та емоційної сфер, появи «досвіду болю» [3, 6].
Немовлята і діти до 3 років не здатні повідомляти про біль, тому для виявлення больового синдрому у них використовують поведінкові реакції (рух тіла, вираз обличчя, плач), а також фізіологічні реакції (тахікардія, артеріальна гіпертензія, пітливість).
Складність оцінки болю в пацієнтів даної вікової категорії спонукала клініцистів до розробки оціночних шкал і уніфікації терапевтичного підходу. Прикладом такого підходу є шкала CRIES для оцінки болю в новонароджених і дітей віком < 6 місяців, у якій аналізуються такі показники: плач, потреба в О2 для підтримки SaO2 > 95 %, показники гемодинаміки (ЧСС, АТ), вираз обличчя, а також характеристика сну.
У пацієнтів віком від 3 до 8 років для об’єктивізації болю можуть бути використані методи аналізу зовнішніх проявів, наприклад «лицьова шкала» (Wong D.L., Baker C.M., 1988), поведінкові шкали оцінки болю (шкала CHIPPS Buttner W., Finke W., 2000; шкала POPS Barrier G., Attia J. еt al., 1989). Однак їх застосування у багатьох випадках є утрудненим і не валідоване в багатоцентрових наукових дослідженнях [3–5]. У дітей старше 8 років, які є притомними, можна використати такі методи об’єктивізації болю, як вербальна рейтингова шкала, візуальна аналогова шкала, числова рейтингова шкала (NRS).
Щодо терапевтичного підходу, то антиноцептивний захист може бути застосований на кожному етапі поширення больової імпульсації (транс–дукція, трансмісія, модуляція, перцепція). Однак на сьогодні вважається, що чим раніше (дистальніше) цей захист проведений, тим він ефективніший. Це твердження пов’язане з концепцією центральної сенситизації й формуванням феномену вторинної гіпералгезії (зони зниження больового порогу) [3, 4, 8].
На сьогодні профілактичним підходом у формуванні гіпералгзії є запобіжна аналгезія (preemptive analgesia) [4, 8]. У випадку періопераційного знеболювання найбільшої популярності набула методика мультимодальної аналгезії, що базується на застосуванні препаратів, які діють на різні рецепторні поля, і їх анальгетична дія при цьому потенціюється. Застосування мультимодальної аналгезії супроводжується зниженням сумарних доз препаратів і зменшенням частоти побічних ефектів [4, 5, 8, 10].
Мета дослідження — оцінити ефективність і безпечність ноцицептивного захисту дітей, яким було застосовано мультимодальний підхід в інтраопераційному і ранньому поопераційному знеболенні при великих травматичних операціях.
Матеріали і методи
У дослідження увійшли 42 дитини віком від 3 місяців до 15 років, яким були проведені реконструктивні абдомінальні та урологічні операції. Структура оперативних втручань була такою: серединна лапаротомія, усунення кишкової непрохідності — 7 хворих, серединна лапаротомія + накладання кишкових анастомозів — 15 хворих, люмботомія, висічення звуженої ділянки мисково-сечовідного сегмента та формування мисково-сечовідного анастомозу (операція Андерсона — Хайнса) — 20 хворих. У дослідження не включались пацієнти з інфекційними процесами черевної порожнини, а також діти з органною дисфункцією серцево-судинної, дихальної систем та системи гемостазу.
Передопераційна оцінка дітей за шкалою ASA: ASA I — 7 хворих, ASA II — 35 хворих.
Анестезіологічне забезпечення проводили шляхом багатокомпонентного ендотрахеального комбінованого наркозу з поєднанням грудної епідуральної анестезії.
Індукція в наркоз проводилась внутрішньовенно (в/в) пропофолом 3 мг/кг. З метою запобіжної аналгезії (для блокади NMDA-рецепторів) усім пацієнтам під час індукції застосовано кетамін в/в 0,2 мг/кг.
Після інтубації трахеї усім пацієнтам проводилась низькопотокова (LFA) інгаляційна анестезія севофлюраном із потоком 0,5–0,8 л/хв, концентрацією севофлюрану 2–3 об/% (наркозна станція Leon).
Катетеризацію епідурального простору проводили в нижньому грудному відділі (ThXII — ThX). Для катетеризації використовувались епідуральні набори «Перифікс» фірми B. Braun діаметром 24G для грудних дітей і 20G — для дітей більш старшого віку. Як місцевий анестетик використовувався 0,25% розчин маркаїну (Astra Zeneca) у дозі 2 мг/кг.
Моніторинг: FiO2, SpO2, EtCO2, АТ, ЕКГ, ЧСС, t тіла, механіка дихання.
У післяопераційному періоді знеболювання забезпечувалось подовженою епідуральною аналгезією (маркаїн 0,2% — 0,2–0,4 мг/кг/год) + в/в парацетамол (інфулган) 20 мг/кг кожні 8 год. За потреби післяопераційна аналгезія потенціювалась фракційним введенням морфіну у дозі 0,1–0,2 мг/кг.
Схему періопераційного мультимодального знеболювання наведено в табл. 1.
Якість післяопераційної аналгезії у дітей віком до 8 років оцінювали за шкалою Wong — Baker, старшим дітям — за числово-рейтинговою шкалою. Оцінка післяопераційного пробудження проводилась за шкалою Aldrete [1].
У кожному випадку було отримано письмову інформовану згоду батьків на застосування регіонарної методики знеболювання та наркозу в цілому.
Результати дослідження та їх обговорення
Оцінка анальгетичного компонента наркозу показала високу ефективність мультимодальної анестезії як методу анестезіологічного забезпечення. У 38 (90,5 %) хворих оперативне втручання було проведене без застосування опіоїдів як основного компонента анестезії. Лише в 4 (9,5 %) дітей було додатково застосовано фентаніл із метою потенціювання анестезії.
Аналіз гемодинаміки показав, що зростання частоти серцевих скорочень (ЧСС) порівняно з вихідними даними у дітей віком до 8 років не перевищило 7,8 ± 1,1 %. Зростання ЧСС у старших дітей (після 8 років) становило 9,5 ± 1,4 %, переважно протягом першої години (рис. 1).
/72/72.jpg)
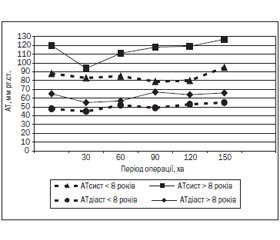
Показники систолічного артеріального тиску (АТсист) були стабільними у дітей молодшої вікової групи і коливання відносно вихідних показників становили не більше 10,3 ± 1,5 %. У дітей після 8 років спостерігалося незначне зниження АТсист, що максимально відрізнялось від вихідних даних на 21,7 ± 3,1 %. Таке зниження АТсист відмічалось на першій годині наркозу й розцінювалось як наслідок симпатичної блокади епідуральної анестезії. Застосування кристалоїдів в об’ємі 10–15 мл/кг приводило до відновлення вихідних показників АТсист протягом першої години операції (рис. 2).
Діастолічний артеріальний тиск (АТдіаст) у дітей до 8 років також характеризувався незначними коливаннями, що не перевищували 14,5 ± 2,1 % від вихідних даних. У дітей після 8 років спостерігалось зниження АТдіаст, що максимально було виражене в перші 30 хв наркозу і відрізнялось від вихідних даних на 15,4 ± 2,2 % (рис. 2).
/73/73_2.jpg)
Решта показників моніторингу включно з механікою дихання не зазнали суттєвих змін.
Після закінчення оперативного втручання 41 (97,6 %) хворий був екстубований і переведений на спонтанне дихання. Середня оцінка за шкалою пробудження Aldrete становила 7,6 ± 1,0 бала. В 1 пацієнта (2,4 %) виникла потреба в післяопераційній штучній вентиляції легень у зв’язку з інтраопераційною кровотечею, що становила > 25 % ОЦК.
Середню бальну оцінку післяопераційної аналгезії за рейтинговими шкалами наведено в табл. 2.
Аналіз післяопераційного знеболювання показав високу ефективність поєднання пролонгованої епідуральної аналгезії і фракційного застосування парацетамолу. Додаткового введення опіоїдів потребували 7 (16,7 %) хворих. Максимальна добова доза морфіну не перевищувала 0,4 мг/кг.
В усіх пацієнтів у післяопераційному періоді був адекватний рівень свідомості, відсутня медикаментозна депресія дихання. У дітей, які перенесли урологічні оперативні втручання, ентеральне харчування було розпочате в середньому через 8,4 ± 1,1 години. У пацієнтів, які перенесли абдомінальні оперативні втручання, поява перистальтики відмічалась на другу післяопераційну добу.
Висновки
1. Застосування мультимодальної анестезії є ефективним і відносно безпечним методом інтраопераційного знеболювання.
2. Мультимодальний підхід із використанням епідуральної анестезії та низькопотокової інгаляційної анестезії забезпечує швидке пробудження та екстубацію дітей раннього віку й запобігає небажаним ефектам, що пов’язані з використанням опіоїдів.
3. Пролонгована епідуральна аналгезія у поєднанні з внутрішньовенним фракційним застосуванням парацетамолу є ефективним методом післяопераційного знеболювання та сприяє швидкій реабілітації пацієнтів у ранньому поопераційному періоді.
1. Гельфанд Б.Р. Анестезиология и реаниматология / Б.Р. Гельфанд, П.А. Кириенко, Т.Ф. Гриненко и др. // Практическое руководство / Под редакцией проф. Б.Р. Гельфанда. — М.: Литера, 2006. — С. 251.
2. Грегори Дж.А. Анестезия в педиатрии / Дж.А. Грегори; пер. с англ. М.А. Карачунского. — М.: Медицина, 2003. — 1192 с.
3. Михельсон В.А. Детская анестезиология и интенсивная терапия: Учебник для студентов мед. вузов / В.А. Михельсон, В.А. Гребенников. — 3-е изд. — М.: МЕДпресс-информ, 2009. — 512 с.
4. Овечкин А.М. Послеоперационная боль и обезболивание: Современное состояние проблемы / А.М. Овечкин, С.В. Свиридов // Медицина неотложных состояний. — 2011. — № 6(37). — С. 20-31.
5. Ocипова Н.А. Место парацетамола (Перфалгана) в мультимодальной послеоперационной аналгезии / Н.А. Осипова, В.В. Петрова, Ю.С. Донскова и др. // Русский медицинский журнал. — 2006. — Т. 14, № 28(280). — С. 2014-2018.
6. Цыпин Л.Е., Лазарев В.В., Брызжева И.А. Оценка анальгетического компонента при общей анестезии севофлураном и фентанилом у детей с определением фармакокинетических параметров / Л.Е. Цыпин, В.В. Лазарев, И.А. Брызжева и др. // Детская больница. — 2011. — № 2. — С. 35-39.
7. Anderson B.J. Paracetamol (Acetaminophen): mechanisms of action / B.J. Anderson // Paediatr. Anaesth. — 2008. — № 18. — P. 915-921.
8. Moiniche S. Aqualitative and quantitative systematic review of preemptive analgesia for postoperative painrelief: the role of timing of analgesia / S. Moiniche, H. Kehlet, J.B. Dahl // Anesthesiology. — 2002. — № 96. — P. 725-741.
9. Taddio A. The effects of early pain experience in neonates on pain responses in infancy and childhood / A. Taddio, J. Katz // Paediatr Drugs. — 2005. — № 7. — P. 245-257.
10. Yaster M. Muitimodal analgesia in children / M. Yaster // Eur. J. Anaesthesiol. — 2010. — № 27. — P. 851-857.

/72/72_2.jpg)
/73/73.jpg)