Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Динаміка показників коригованого інтервалу QT і дисперсії інтервалу QT та їх прогностичне значення у пацієнтів з ішемічною хворобою серця на фоні епідуральної анестезії із застосуванням різних місцевих анестетиків
Авторы: Світлик Ю.О. - Львівський національний медичний університет імені Данила Галицького
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті проаналізовано динаміку коригованого інтервалу QT та його дисперсії в періопераційний період у пацієнтів з ішемічною хворобою серця, які оперуються з приводу пахової грижі із застосуванням епідуральної анестезії. З’ясовано взаємозв’язки між досліджуваними показниками і застосуванням лідокаїну, ропівакаїну та бупівакаїну.
В статье проанализирована динамика корригированного интервала QT и его дисперсии в периоперационный период у пациентов с ишемической болезнью сердца, оперированных по поводу паховой грыжи с применением эпидуральной анестезии. Выяснены взаимосвязи между исследуемыми показателями и применением лидокаина, ропивакаина и бупивакаина.
The paper describes the dynamics of corrected QT interval and its dispersion in the perioperative period in patients with coronary artery disease operated for the inguinal hernia using an epidural anesthesia. We have determined the relationship between the examined parameters and use of lidocaine, bupivacaine and ropivacaine.
епідуральна анестезія, місцеві анестетики, ішемічна хвороба серця, коригований інтервал QT, дисперсія інтервалу QT.
эпидуральная анестезия, местные анестетики, ишемическая болезнь сердца, корригированный интервал QT, дисперсия интервала QT.
epidural anesthesia, local anesthetic agents, coronary artery disease, corrected QT interval, dispersion of QT interval.
Статья опубликована на с. 98-102
Вступ
Окрім антиаритмічних властивостей, що мають більшість місцевих анестетиків, відомі також їх проаритмогенні ефекти, які можуть виникати при використанні бупівакаїну, ропівакаїну та інших анестетиків [3, 4].
Проаритмогенність, імовірно, пов’язана з впливом місцевого анестетика на провідну систему серця: бупівакаїн активно зв’язується з натрієвими каналами провідної системи, але дисоціює з цих каналів дуже повільно — із збільшенням частоти серцевих скорочень частотно-залежна блокада стає більш вираженою. У той же час лідокаїн швидко зв’язується з білками провідної системи серця, потім швидко дисоціює і частотно-залежна блокада не розвивається. Афінітет ропівакаїну до закритих Na+-каналів є проміжним між лідокаїном і бупівакаїном, величина частотно-залежного блоку при застосуванні ропівакаїну також займає проміжне місце серед вищезазначених препаратів. Натрієві канали тривало залишаються блокованими бупівакаїном, тому дуже тяжко уникнути аберантних ритмів і відновити нормальний електрофізіологічний стан усередині провідної системи серця. Кількісно зв’язок бупівакаїну з натрієвими каналами провідної системи серця майже в 10 разів триваліший, ніж лідокаїну, що частково пояснює, чому бупівакаїн в 9 разів кардіотоксичніший, ніж лідокаїн. Одноразово активно зв’язавшись з провідною системою серця, бупівакаїн може призвести до розвитку фібриляції шлуночків і вираженого блоку провідної системи серця. Дуже тяжко досягнути відновлення стану провідної системи серця після застосування цього анестетика в дозі, що перевищує максимально допустиму [2–5].
Останнім часом увагу лікарів привертають такі маркери шлуночкового аритмогенезу, як тривалість інтервалу QT, зокрема коригований інтервал QT (QTc) та дисперсія інтервалу QT (QTd), що вираховуються при аналізі 12-канальної ЕКГ.
Встановлено наявність асоціації між зростанням дисперсії інтервалу QT, появою тяжких шлуночкових аритмій і раптовою серцевою смертю при хронічній серцевій недостатності, гіпертрофічній кардіоміопатії, коригованій тетраді Фалло, у чоловіків-атлетів за відсутності патології серця, при вроджених синдромах подовженого інтервалу QT, ішемії міокарда, зокрема гострому інфаркті, оскільки цей показник відображає диференціацію, просторову лабільність і часову характеристику реполяризації міокарда шлуночків. QTd залежить також від скоротливої функції лівого шлуночка [11, 12].
Наявний прямий кореляційний зв’язок між QTd та симпатичною активністю. Дослідники довели, що симпатичний тонус є одним із факторів, що впливають на зміни реполяризації міокарда і вносять домінуючий вклад у механізми патогенезу застійної серцевої недостатності [6, 10].
Згідно з більшістю літературних джерел, у здорових осіб критичною верхньою межею норми тривалості інтервалу QT слід вважати 650 мс. У пацієнтів із структурними захворюваннями серця та ризиком виникнення шлуночкових аритмій QT сягає 660–1150 мс, тривалість понад 1300 мс притаманна пацієнтам із природженими синдромами подовженого інтервалу QT [8, 12].
Відзначено зростання значення коригованого інтервалу QT при збільшенні тяжкості серцевої недостатності та вираженості шлуночкових порушень ритму серця. Як зростання варіабельності інтервалу QT, так і пролонгація QTc асоціюються із гетерогенністю реполяризації шлуночків і змінами тонусу автономної нервової системи, що сприяє виникненню шлуночкових аритмій, фібриляції шлуночків і раптової серцевої смерті [1, 9].
Враховуючи вищенаведене, у поданій роботі вирішено дослідити маркери шлуночкового аритмогенезу — тривалість коригованого інтервалу QT та дисперсію інтервалу QT. Ми намагались також віднайти додаткові можливості зменшення ризику виникнення загрозливих для життя шлуночкових аритмій і раптової серцевої смерті у пацієнтів з ішемічною хворобою серця (ІХС), які підлягають оперативному втручанню, і проаналізувати особливості коригуючого впливу метаболічної терапії на частоту їх виникнення.
Мета: з’ясувати динаміку інтервалу QT (QTc і QTd) у періопераційний період і визначити критерії прогнозування виникнення загрозливих для життя порушень серцевого ритму в ранній післяопераційний період в осіб з ІХС на фоні застосування місцевих анестетиків.
Матеріали і методи
Обстежено 87 пацієнтів чоловічої статі, які оперувались з приводу пахових гриж на фоні епідуральної анестезії. Групу І становили 55 пацієнтів (середній вік 55,27 ± 1,83 року) з ішемічною хворобою серця, стенокардією напруги І–ІІІ ФК за NYHA, серед яких методом випадкової вибірки були виділені 3 підгрупи: підгрупа 1 (15 пацієнтів) — особи, епідуральна анестезія яким проводилась з використанням місцевого анестетика 2% лідокаїну, підгрупа 2 (25 пацієнтів) та підгрупа 3 (15 пацієнтів), у яких для місцевої анестезії застосовано 0,75% ропівакаїн і 0,5% бупівакаїн відповідно. До групи ІІ увійшли 32 практично здорові особи (середній вік 50,09 ± 2,24 року), які теж методом випадкової вибірки були поділені на 3 підгрупи, епідуральна анестезія в яких виконувалась з використанням 2% лідокаїну (підгрупа 1 — 8 пацієнтів), 0,75% ропівакаїну (підгрупа 2 — 13 осіб) та 0,5% бупівакаїну (підгрупа 3 — 11 осіб).
Контрольну групу становили здорові волонтери — 12 чоловіків віком від 35 до 65 років (середній вік 54,06 ± 3,74 року), у яких відсутність ІХС підтверджено згідно з даними велоергометрії. Пацієнтам контрольної групи проводили ЕхоКГ-обстеження, холтерівське моніторування ЕКГ, реєстрацію 12-канальної ЕКГ, біохімічні дослідження.
Пацієнти, які мали протипоказання до епідуральної анестезії, підвищену чутливість до місцевих анестетиків, а також особи, які отримували наркотичні анальгетики чи седативні препарати впродовж 12 годин перед оперативним втручанням, в дослідження не включались. Окрім того, критеріями виключення із дослідження служили дані амбулаторної карти пацієнта про порушення ритму і провідності серця та прийом антиаритмічних препаратів, а також наявність у хворого порушень мозкового кровообігу в анамнезі, ожиріння ІV стадії, цукрового діабету, гіпертонічної хвороби ІІІ стадії, фібриляції передсердь, автоімунних захворювань, новоутворень та іншої патології в період маніфестації клінічних проявів.
У передопераційний період усім пацієнтам проведено загальний аналіз крові та сечі, біохімічний аналіз крові з визначенням рівня електролітів, ЕхоКГ-обстеження, добовий моніторинг ЕКГ за Холтером та запис 12-канальної ЕКГ в стані спокою за добу до оперативного втручання, на висоті розвитку епідуральної анестезії, через 3 та 24 год після операції.
Місцеву анестезію проводили в положенні пацієнта лежачи на боці. Після інфільтраційної анестезії ділянки пункції на рівні Th12-L1, L1-L2 чи L2-L3 2% розчином лідокаїну верифікували епідуральний простір методом втрати опору голкою Tuohy 18G. Після негативної аспірації та введення тест-дози розчину місцевого анестетика з адреналіном (1 : 200 000) вводили основну дозу місцевого анестетика.
Фізичний стан пацієнта оцінювали згідно з класифікацією Американської асоціації анестезіологів, він становив І та ІІ в обох групах пацієнтів. Адекватність анестезії визначалась самооцінкою пацієнта відповідно до горизонтальної десятисантиметрової візуально-аналогової шкали, на якій «0» репрезентував відсутність болю і «10» — нестерпний біль згідно з відчуттями пацієнта, та словесної рейтингової шкали. Сенсорний блок оцінювали шляхом поколювання притупленою голкою по середньоключичній лінії від верхніх грудних до поперекових дерматомів. Моторний блок оцінювали через 30 хвилин після епідуральної ін’єкції місцевого анестетика, використовуючи шкалу Bromage.
Рівень електролітів (K+, Ca2+ та Mg2+), що можуть спричиняти розлади ритму та провідності серця, у всіх пацієнтів був у межах норми.
Статистичний аналіз проведено із використанням програми Microsoft Excel. Дані відображено у вигляді середньої величини (М) та стандартного відхилення (SD) середньої величини. Критерієм Стьюдента визначено вірогідність результатів, а результати з рівнем р ≤ 0,05 визнано статистично вірогідними.
Результати та їх обговорення
На фоні анестезії та в ранній післяопераційний період середні величини показників QTc та QTd у досліджуваних пацієнтів були вірогідно вищими, ніж у пацієнтів контрольної групи (табл. 1).
Згідно з отриманими результатами, під час анестезії у пацієнтів усієї вибірки відбулось вірогідне зростання середньої величини QTc на 12,20 % (р < 0,05). Через 3 години від оперативного втручання середня величина інтервалу QTc зменшилась на 2,44 %, утримуючись на даному рівні до 24 год, однак так і не набувши вихідного значення, що спостерігалось до анестезії. Середнє значення дисперсії інтервалу QT під впливом епідуральної анестезії не змінилось порівняно із відповідним у передопераційний період, а через 24 год з моменту проведення анестезії зменшилось на 20 % (р = 0,0012) порівняно з вихідною величиною.
В осіб із ІХС та без неї виявлено вірогідну різницю між показниками QTc та QTd (табл. 2).
Згідно з табл. 2, у групі пацієнтів із ІХС середня величина інтервалу QTc на фоні розвитку епідуральної анестезії статистично значимо (р < 0,001) зростала (на 7,7 %). Через 3 год спостерігаємо вірогідне зменшення величини даного показника (р < 0,001), однак через добу після оперативного втручання середня величина інтервалу QTc не повернулась до вихідного рівня і навіть була більшою, ніж після 3 год з моменту проведення анестезії, вірогідно перевищуючи середнє значення осіб контрольної групи. У пацієнтів без ІХС відбулось незначне (на 5,3 %, р < 0,05) збільшення QTc, проте вже через 3 год після проведення анестезії величина даного показника повернулась до вихідного рівня і залишалась такою і після 24 год з моменту проведення анестезії, статистично незначимо перевищуючи межі норми і одночасно вірогідно відрізняючись від відповідного значення в осіб з ІХС.
Величина QTd у пацієнтів з ІХС упродовж анестезії не змінювалась порівняно з вихідним рівнем, однак статистично значимо перевищувала значення групи контролю. Через 24 год виявлено зменшення її значення на 20 % (р < 0,05). У пацієнтів без ІХС на фоні анестезії та протягом усього раннього післяопераційного періоду величина QTd утримувалась на рівні 0,04 ± 0,02 мс, залишаючись на 20 % нижчою (р < 0,05) від вихідного рівня.
Отже, патологічні зміни показника QTc у пацієнтів із ІХС порівняно з пацієнтами без ІХС на фоні епідуральної анестезії більш виражені та повільніше відновлюються в післяопераційний період.
Дисперсія інтервалу QT під час анестезії та в найближчі години з моменту її проведення статистично значимо перевищує середні значення як осіб групи контролю, так і пацієнтів без ІХС.
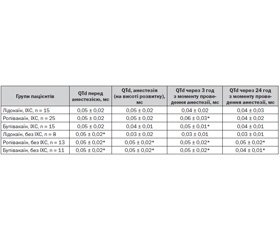
Нами з’ясовано також у досліджуваних пацієнтів особливості процесів реполяризації міокарда шлуночків залежно від використаного місцевого анестетика (табл. 3).
У пацієнтів, в яких використовувався лідокаїн, на фоні анестезії середня величина інтервалу QTc зросла на 5 % (р < 0,05), однак уже через 3 год після проведення анестезії спостерігалось повернення даної величини до вихідного рівня. Через 24 год величина інтервалу QTc мала тенденцію до незначного зростання (+2,63 %, р > 0,05).
У пацієнтів, яким вводився епідурально ропівакаїн, коригований інтервал QT в ході розвитку анестезії зріс на 10,53 % (р < 0,05). Уже через 3 год ми спостерігали зменшення його величини на 5 % (р < 0,05), однак до 24 год з моменту проведення анестезії QTc не досяг вихідного значення, статистично значимо перевищуючи межі норми.
У групі пацієнтів, яким епідурально був введений бупівакаїн, середня величина інтервалу QTc зростала на 5 % (р < 0,05). Протягом доби після оперативного втручання QTc зменшувався на 2,44 %, (р < 0,05), однак не досягав вихідного рівня.
Дисперсія інтервалу QT у пацієнтів, у лікуванні яких використовувався лідокаїн, зменшувалась на 20 % (р > 0,05) на фоні анестезії, а до кінця доби — на 40 % (р < 0,05).
На фоні застосування ропівакаїну QTd, незначно зростаючи через 3 год після проведення анестезії, до кінця доби знижувалась на 20 %, на стільки ж відсотків вона знижувалась і на фоні застосування бупівакаїну.
Отже, динаміка коригованого інтервалу QT та його дисперсії була більш сприятливою на фоні застосування лідокаїну, а з двох інших місцевих анестетиків більш стабільним (безпечним) щодо змін параметрів інтервалу QT був бупівакаїн.
Нами проаналізовано зміни характеристик інтервалу QT у пацієнтів із ІХС та без неї залежно від вибраного місцевого анестетика, що наведено у табл. 4, 5.
Вихідна величина показника QTc у пацієнтів, яким епідурально вводився лідокаїн, була одинаковою у пацієнтів як з ІХС, так і без неї. На початку оперативного втручання середня величина QTc зросла в обох групах пацієнтів, однак в осіб з ІХС — на 8 % (р < 0,05), а в пацієнтів без ІХС — на 5 % (р < 0,05). Через 3 год після розвитку анестезії QTc зменшився в обох групах, причому в пацієнтів без ІХС показник став меншим від вихідного рівня і практично наблизився до норми. Наприкінці доби після епідуральної анестезії середня величина QTc в осіб з ІХС залишилась на рівні початку оперативного втручання, а у пацієнтів без ІХС не мала тенденції до зростання.
Серед пацієнтів, у яких з метою епідуральної анестезії використовували ропівакаїн та бупівакаїн, теж більш значне зростання величини показника QTc спостерігали в осіб з ІХС. Як і передбачалось, через 3 та 24 год від початку анестезії середні значення QTc мали тенденцію до нормалізації, у той час як у пацієнтів з ІХС зростання величини QTc було менш відчутним.
Слід відмітити, що під час проведення оперативного втручання (анестезії) зростання середніх значень показника QTc у пацієнтів з ІХС було найменш вираженим у випадку застосування з метою місцевої анестезії лідокаїну і бупівакаїну.
Згідно з даними табл. 5, упродовж доби спостерігалась позитивна динаміка QTd, найбільш сприятливою вона була у пацієнтів, у яких лікування проходило із застосуванням лідокаїну і бупівакаїну (з деяк,ою перевагою лідокаїну).
Слід зауважити, що на фоні ропівакаїну в осіб із наявністю ІХС дисперсія інтервалу QT у перші години після оперативного втручання зростала на 16,67 % (р > 0,05) порівняно з вихідним рівнем, вказуючи на тенденцію до зниження електричної стабільності міокарда в цей період.
Висновки
У пацієнтів, які оперуються з приводу пахових гриж із застосуванням епідуральної анестезії, зростає тривалість коригованого інтервалу QT та його дисперсія, вказуючи на зниження електричної стабільності міокарда та зростання ризику виникнення загрозливих для життя шлуночкових аритмій — шлуночкової тахікардії і фібриляції шлуночків. Незначно зменшуючись упродовж доби, середні значення цих показників не наближаються до норми через 24 год після оперативного втручання.
Більш вираженими є зміни параметрів інтервалу QT у пацієнтів із наявністю ІХС.
Порушення гомогенності процесів реполяризації міокарда шлуночків, а отже, зниження його електричної стабільності є менш відчутним (у тому числі і в осіб з ІХС) на фоні застосування з метою місцевої анестезії лідокаїну. З двох інших анестетиків (ропівакаїну та бупівакаїну) більш безпечним щодо застосування в пацієнтів з ІХС, враховуючи проаритмогенні ефекти, є бупівакаїн.
Зростання значень коригованого інтервалу QT та його дисперсії у пацієнтів на фоні епідуральної анестезії, зокрема із наявністю ІХС, може слугувати критерієм підвищеного ризику виникнення у них загрозливих для життя аритмій у періопераційний період.
1. Бурак Т.Я. Особенности изменения интервала QT и его прогностическая роль у больных острым инфарктом миокарда / Т.Я. Бурак, С.А. Болдуева, И.А. Леонова [и др.] // Кардиология. — 2006. — № 10. — С. 21-29.
2. Лесовая М.А. Мониторинг микроциркуляторного звена системы кровообращения при регионарной анестезии. Обзор литературы / М.А. Лесовая, И.И. Красий, Г.Г. Хареба // Експериментальна і клінічна медицина. — 2009. — № 4. — С. 141-146.
3. Овечкин А.М. Наропин (ропивакаин) в лечении боли: идеальный выбор? / А.М. Овечкин, А.В. Гнездилов // Острые и неотложные состояния в практике врача. — 2010. — № 1. — С. 20-26.
4. Рафмелл Д.П. Регионарная анестезия: самое необходимое в анестезиологии / Рафмелл Д.П., Нил Д.М., Вискоуми К.М.; пер. с англ.; под общ. ред. А.П. Зильбера, В.В Мальцева. — М.: МЕДпресс-информ, 2007. — 272 с.
5. Фесенко В.С. «Серебряная пуля» получает признание: новые рекомендации относительно интоксикации местными анестетиками / В.С. Фесенко // Медицина неотложных состояний. — 2011. — № 7–8. — С. 33-45.
6. Akselrod S. Power spectrum analysis of heart rate fluctuation: a quantitative probe of beat-to-beat cardiovascular control / S. Akselrod, D. Gordon, F.A. Ubel [et al.] // Science. — 1981. — № 213. — Р. 220-228.
7. Antzelevich C. Electrical heterogeneity within the ventricular wall / C. Antzelevich, J. Fish // Basic Res. Cardiology. — 2001. — V. 96. — P. 517-527.
8. Berger R.D. QT variability / R.D. Berger // J. Electrocardiol. — 2003. — № 36. — Р. 83-87.
9. Haigney M.C. QT interval variability and spontaneous ventricular tachycardia or fibrillation in the Multicenter Automatic Defibrillator Implantation Trial (MADIT) II patients / M.C. Haigney, W. Zareba, P.J. Gentlesk [et al.] // J. Am. Coll. Cardiol. — 2004. — № 44. — Р. 1481-1487.
10. Piccirillo G. Autonomic nervous system activity measured directly and QT interval variability in normal and pacing-induced tachycardia heart failure dogs / G. Piccirillo, D. Magrı, М. Ogawa [et al.] // J. Am. Coll. Cardiol. — 2009. — № 54. — Р. 840-850.
11. Soler-Soler J. QT dispertion after myocardial infarction with heart failure: additional prognostic marker? / J. Soler-Soler, E. Galve // European Heart Journal. — 1999. — V. 20, № 16. — P. 1146-1148.
12. Spargias K.S. QT dispersion as a predictor of long-term mortality in patients with acute myocardial infarction and clinical evidence of heart failure / K.S. Spargias, S.J. Lindsay, G.I. Kawar [et al.] // European Heart Journal. — 1999. — V. 20. — P. 1158-1165.

/100/100.jpg)
/101/101.jpg)
/102/102.jpg)