Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Стратегічні напрямки інтенсивної терапії субкомпенсованої гастроінтестинальної дисфункції в пацієнтів із тяжкою черепно-мозковою травмою, поєднаною з травмою кісток скелета
Авторы: Яєчник О.Р. - Львівський національний медичний університет ім. Данила Галицького, кафедра анестезіології та інтенсивної терапії ФПДО
Рубрики: Травматология и ортопедия, Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Сьогодні питання інтенсивної терапії у хворих із черепно-мозковою травмою, поєднаною з травмою кісток скелета, актуальне внаслідок високого рівня смертності пацієнтів із даною патологією. Метою даної статті було показати результати інтенсивної терапії синдрому гастроінтестинальної дисфункції (СГІД) у стадії субкомпенсації в пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета. Нами запропоновано застосування селективної деконтамінації кишки та ентеросорбції в пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета, з ознаками субкомпенсованого СГІД. Ці методи інтенсивної терапії запропоновано на основі патогенезу з урахуванням даних літератури, згідно з якими при субкомпенсованому СГІД наявне пригнічення моторної функції, до якого приєднується порушення всмоктування спочатку газів, а потім води, електролітів. Відбуваються перерозтягнення петель кишки та накопичення в просвіті великих об’ємів газу та рідини. Хворі були розділені на дві групи, що не відрізнялися між собою за такими показниками, як вік хворих, стать, тяжкість стану, вираженість ознак поліорганної дисфункції та її компонента — СГІД. Хворі 1-ї групи отримували базисну терапію: активну волемічну, інотропну та судинну підтримку, респіраторну терапію, антибіотикотерапію, антицитокінову терапію. У хворих 2-ї групи, крім вищенаведеної терапії, застосовували селективну деконтамінацію кишок (СДК) та ентеросорбцію (ЕС). Для СДК використовували поліміксини, протигрибкові препарати, аміноглікозиди. ЕС проводили шляхом введення ентеросорбенту через зонд. Усім хворим проводили загальноклінічні та біохімічні дослідження крові. З метою діагностики ознак синдрому системної запальної відповіді (SIRS) визначали параметри, що характеризують наявність і динаміку системної відповіді організму на запалення. Інтегральну оцінку тяжкості стану хворих проводили за шкалою АРАСНЕ ІІ, тяжкості поліорганної дисфункції — за шкалою SOFA. Враховуючи те, що ініціаторами розвитку SIRS є молекулярні медіатори запалення, з прозапальних цитокінів виділяли фактор некрозу пухлини та інтерлейкін-8. З метою контролю та корекції центральної гемодинаміки, крім таких показників, як артеріальний тиск, середній артеріальний тиск, частота серцевих скорочень, центральний венозний тиск, визначали серцевий індекс. Проводилося визначення величини постачання та споживання кисню — DO2 і VO2, співвідношення раО2/FiO2. Енергетичний баланс клітини визначали за рівнем глюкози, аденозинтрифосфату, лактату. Рівень ендотоксемії оцінювали за рівнем молекул середньої маси, сорбційною здатністю еритроцитів і проникністю еритроцитарних мембран. Деструктивні зміни в клітинних мембранах характеризує рівень перекисного окислення ліпідів. Активність перекисного окислення ліпідів оцінювали за рівнем їх первинних продуктів — дієнових кон’югат та вторинного — малонового діальдегіду. Дослідження проводили в 1-шу (Н1) (етап 1), на 3-тю (Н3) (етап 2), 5-ту (Н5) (етап 3), 7-му (Н7) (етап 4), 10-ту (Н10) (етап 5) добу захворювання. У результатах дослідження звертають на себе увагу більш низька летальність, більш швидкий регрес тяжкості стану пацієнтів, зменшення проявів синдрому поліорганної недостатності та СГІД у хворих, яким проводилися селективна деконтамінація кишки та ентеросорбція. Отже, як видно з результатів дослідження, селективна деконтамінація кишки та ентеросорбція позитивно впливають на стан пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета, у яких наявні ознаки субкомпенсованого СГІД, і дають можливість зменшити летальність і кількість ускладнень, скоротити терміни лікування.
На сегодняшний день вопрос интенсивной терапии у больных с черепно-мозговой травмой, сочетанной с травмой костей скелета, актуален вследствие высокой смертности пациентов с данной патологией. Целью данной статьи было показать результаты интенсивной терапии синдрома гастроинтестинальной дисфункции (СГИД) у пациентов с черепно-мозговой травмой, сочетанной с травмой костей скелета. Нами предложено применение селективной деконтаминации кишки и энтеросорбции у пациентов с черепно-мозговой травмой, сочетанной с травмой костей скелета, с признаками субкомпенсированного СГИД. Данные методы интенсивной терапии предложены на основе патогенеза с учетом данных литературы, согласно которым при субкомпенсированном СГИД имеется угнетение моторной функции, к которому присоединяется нарушение всасывания сначала газов, а затем воды, электролитов. Происходят перерастяжение петель кишки и накопление в просвете больших объемов газа и жидкости. Больные были разделены на две группы, которые не отличались между собой по таким признакам, как возраст больных, пол, тяжесть состояния, выраженность признаков полиорганной дисфункции и ее компонента — СГИД. Больные 1-й группы получали базисную терапию: активную волемическую, инотропною и сосудистую поддержку, респираторную терапию, антибиотикотерапию, антицитокиновою терапию. У больных 2-й группы, кроме вышеприведенной терапии, применяли селективную деконтаминацию кишок (СДК) и энтеросорбцию (ЭС). Для СДК использовали полимиксины, противогрибковые препараты, аминогликозиды. ЭС проводили путем введения энтеросорбента через зонд. Всем больным проводили общие клинические и биохимические исследования крови. С целью диагностики признаков синдрома системного воспалительного ответа (SIRS) определяли параметры, которые характеризуют наличие и динамику системного ответа организма на воспаление. Интегральная оценка тяжести состояния больных осуществлялась по шкале АРАСНЕ ІІ, тяжесть полиорганной дисфункции — по шкале SOFA. Учитывая то, что инициаторами развития SIRS являются молекулярные медиаторы воспаления, из провоспалительных цитокинов выделяли фактор некроза опухоли и интерлейкин-8. С целью контроля и коррекции центральной гемодинамики, кроме таких показателей, как артериальное давление, среднее артериальное давление, частота сердечных сокращений, центральное венозное давление, определяли сердечный индекс. Проводилось определение величины поступления и потребления кислорода — DO2 и VO2, соотношения РаО2/FiO2. Энергетический баланс клетки определяли по уровню глюкозы, аденозинтрифосфата, лактата. Уровень эндотоксемии оценивали по уровню молекул средней массы, сорбционной способности эритроцитов и проницательности эритроцитарных мембран. Деструктивные изменения в клеточных мембранах характеризует уровень перекисного окисления липидов. Активность уровень перекисного окисления липидов оценивали по уровню их первичных продуктов — диеновых конъюгат и вторичного — малонового диальдегида. Исследования проводили в 1-е (Н1) (этап 1), 3-и (Н3) (этап 2), 5-е (Н5) (этап 3), 7-е (Н7) (этап 4), 10-е (Н10) (этап 5) сутки заболевания. В результатах исследования обращают на себя внимание более низкая летальность, более быстрый регресс тяжести состояния пациентов, уменьшение проявлений синдрома полиорганной недостаточности и СГИД у пациентов, которым проводились селективная деконтаминация кишки и энтеросорбция. Итак, как видно из результатов исследования, селективная деконтаминация кишки и энтеросорбция положительно влияют на состояние пациентов с черепно-мозговой травмой, сочетанной с травмой костей, у которых имеются признаки субкомпенсированного СГИД, и дают возможность уменьшить летальность и количество осложнений, сократить сроки лечения.
Today the question of intensive care in patients with traumatic brain injury, combined with the trauma of skeletal bones, is relevant because of the high mortality rate of patients with this pathology. The objective of this article is to show the outcomes of intensive therapy for gastrointestinal dysfunction syndrome (GIDS) under subcompensation in patients with traumatic brain injury, combined with the trauma of skeletal bones. We have proposed the use of selective decontamination of the gut and enterosorption in patients with traumatic brain injury, combined with the trauma of skeletal bones, with signs of subcompensated GIDS. These methods of intensive care are proposed on the basis of pathogenesis in view of literature data, according to which inhibition of motor function present in subcompensated GIDS is associated with malabsorption of first gas and then water, electrolytes. Hyperextension of intestine loops and accumulation in the lumen of large volumes of gas and liquid occur. Patients were divided into two groups, which did not differ by such parameters as patient age, sex, severity of the condition, the severity of multiple organ dysfunction symptoms and its component — GIDS. Patients in group 1 received basic therapy: active volemic, inotropic and vascular support, respiratory therapy, antibiotics, anticytokine therapy. Patients in group 2, except the above mentioned therapy, used selective decontamination of the gut (SDG) and enterosorption (ES). In SDG we used: polymyxins, antifungals, aminoglycosides. ES has been carried out by introducing enterosorbent via probe. All patients underwent general clinical and biochemical blood tests. To diagnose signs of systemic inflammatory response syndrome (SIRS) we defined parameters that characterize the presence and dynamics of systemic response against inflammation. Integral assessment of the severity of patients was carried out on a scale of APACHE II, severity of multiple organ dysfunction — on a scale of SOFA. Considering that triggers of SIRS development are molecular inflammatory mediators, tumor necrosis factor and interleukin-8 were isolated from the proinflammatory cytokines. In order to control and correction of central hemodynamics, except such indicators as blood pressure, mean arterial pressure, heart rate, central venous pressure, we have measured cardiac index. We have determined the parameters of supply and consumption of oxygen — DO2 and VO2, the ratio of PaO2/FiO2. The energy balance of the cell was determined by the level of glucose, adenosine triphosphate, lactate. The level of endotoxemia was evaluated by level of the average weight molecules, the sorption capacity of erythrocytes and erythrocyte membranes permeability. Destructive changes in the cell membranes are characterized by the level of lipid peroxidation. Activity of lipid peroxidation was assessed by the level of their primary products — diene conjugates and secondary — malondialdehyde. Investigations were carried out on the 1st (H1) (stage 1), 3rd (H3) (stage 2), 5th (H5) (stage 3), 7th (H7) (stage 4), 10th (H10) (stage 5) days of the disease. In the results of the research attention is drawn to a lower mortality rate, more rapid regression of the severity of the patient’s state, reducing the manifestations of multiple organ dysfunction syndrome and GIDS in patients who underwent selective decontamination of the gut and enterosorption. Thus, as can be seen from the results of the study, selective decontamination of the gut and enterosorption have positive effect on state of patients with traumatic brain injury, combined with the trauma of skeletal bones, who have signs of subcompensated GIDS, and provide an opportunity to reduce mortality and complications, to shorten treatment time.
черепно-мозкова травма, травма кісток скелета, субкомпенсована гастроінтестинальна дисфункція.
черепно-мозговая травма, травма костей скелета, субкомпенсированная гастроинтестинальная дисфункция.
traumatic brain injury, trauma of skeletal bones, subcompensated gastrointestinal dysfunction.
Статья опубликована на с. 125-132
Вступ
Сьогодні вважається, що однією з основних причин летальності постраждалих із тяжкою черепно-мозковою травмою, поєднаною з травмою кісток скелета, є розвиток у посттравматичному періоді синдрому поліорганої недостатності (СПОН) [5]. Цій проблемі присвячено значну кількість досліджень, але досі залишаються повністю не розкритими основні патогенетичні механізми розвитку СПОН. Разом із тим усі теорії розвитку СПОН визнають недостатність гастроінтестинального тракту як одну із провідних ланок його патогенезу [6].
Ушкодження слизової оболонки гастроінтестинального тракту внаслідок порушення мезентеріального кровотоку призводить до транслокації ендотоксину та ентерогенної флори. Все це вважається причиною розвитку інфекційних ускладнень і синдрому поліорганної недостатньості в посттравматичному періоді [2, 3]. Розвиток у травмованих недостатності гастроінтестинального тракту обмежує забезпечення організму пластичними й енергетичними субстратами, що на фоні гіперкатаболічної реакції обов’язково призводить до імуносупресії та прогресування інфекційних ускладнень [5]. Таким чином, у постшоковому періоді для запобігання розвитку та лікування синдрому поліорганної недостатності доцільне використання стратегій інтенсивної терапії, спрямованих на корекцію порушених функцій гастроінтестинального тракту [6].
Незважаючи на постійне вдосконалення якості діагностики синдрому гастроінтестинальної дисфункції (СГІД) у пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета (ЧМТпТКС) та ефективність її лікування, летальність при даній патології залишається високою [6]. Переважною причиною незадовільних результатів лікування хворих із ЧМТпТКС є розвиток ендогенної інтоксикації (ЕІ) та гнійно-септичних ускладнень, частота яких коливається в межах 19,3–86,0 % і призводить до післяопераційної летальності в 25,0–35,0 % випадків [4, 5].
Матеріал і методи
Нами обстежено 59 хворих із ЧМТпТКС (на момент надходження до стаціонару рівень свідомості становив 8–9 балів за шкалою коми Глазго). У всіх пацієнтів був наявний синдром поліорганної дисфункції та його компонент — синдром гастроінтестинальної дисфункції в стадії субкомпенсації (2–3 бали). Бальну оцінку дисфункції шлунково-кишкового тракту проводили на основі модифікації методики В.Ф. Саєнко та співавт. (2002) і І.В. Люлько та співавт. (2002), Я.М. Підгірного (2009), В.В. Ніконова та співавт. (2011).
Хворі були розділені на дві групи, що не відрізнялися між собою за такими показниками, як вік, стать, тяжкість стану, вираженість ознак поліорганної дисфункції та її компонента — СГІД. Хворі першої групи отримували базисну терапію, що включала хірургічну санацію вогнища, активну волемічну, інотропну та судинну підтримку, респіраторну терапію, антибіотикотерапію, антицитокінову терапію. Хворим другої групи, крім вищенаведеної терапії, застосовували селективну деконтамінацію кишок (СДК) та ентеросорбцію (ЕС).
Для СДК використовували: поліміксини (поліміксин Е — 200 мг), протигрибкові препарати, аміноглікозиди.
Методика ЕС + СДК
Через назогастральний зонд після аспірації залишкового вмісту шлунка вводили ентеросорбент (діоксид кремнію 12 г 2 рази на добу), поліміксин Е застосовували ентерально через назогастральний або назоінтестинальний зонд.
Усім хворим проводили загальноклінічні та біохімічні дослідження крові. З метою діагностики ознак синдрому системної запальної відповіді (SIRS) визначали параметри, що характеризують наявність і динаміку системної відповіді організму на запалення. Інтегральну оцінку тяжкості стану хворих проводили за шкалою АРАСНЕ ІІ, тяжкості поліорганної дисфункції — за шкалою SOFA.
Враховуючи те, що ініціаторами розвитку SIRS є молекулярні медіатори запалення, з прозапальних цитокінів виділяли фактор некрозу пухлини (TNF) та інтерлейкін-8 (IL-8). Обидва цитокіни визначали шляхом твердофазового хемілюмінесцентного імуноферментного аналізу за допомогою тестів IMMULITE/IMMULITE1000 TNF-а та IMMULITE/IMMULITE1000 IL-8.
З метою контролю та корекції центральної гемодинаміки, крім таких показників, як АТ, САТ, ЧСС, ЦВТ, визначали серцевий індекс (СІ) (у даному дослідженні за допомогою ультрасонографії на апараті AlokaSSD-500/SL-450 Siemens, Німеччина).
Дослідження газового складу крові проводили на апараті ABL-520 фірми Radiometer Copenhagen (Данія). За величиною СІ та отриманими даними газового складу крові розрахунковим методом (Усенко Л.В., Шифрин Г.А., 1995, 2007; Корячкин В.А., Страшнов В.И., Чуфаров В.Н., 2001) визначали величини постачання та споживання кисню (DO2 і VO2), співвідношення раО2/FiO2. Енергетичний баланс клітини визначали за рівнем глюкози, аденотрифосфату (АТФ), лактату на біохімічному аналізаторі Doctor Muller (Німеччина) та пірувату — на аналізаторі Accutrend (США).
Оцінку кровопостачання стінки кишки проводили за допомогою методики газової тонометрії з використанням приладу TONOCAP TC-200 фірми Datex-Engstrom (Фінляндія) (Бокерія Л.А., Ярустовський М.Б., Шипова Е.А. та співавт., 2001).
Рівень ендотоксемії оцінювали за рівнем молекул середньої маси (МСМ) (Андрейчик М.А. та співавт., 1998; Назаренко Г.И., Кишкун А.А., 2002), сорбційною здатністю еритроцитів (СЗЕ) і проникливістю еритроцитарних мембран (ПЕМ) (Михайлович В.А. та співавт., 1993). Деструктивні зміни в клітинних мембранах характеризують рівень перекисного окислення ліпідів (ПОЛ). Активність ПОЛ оцінювали за рівнем їх первинних продуктів — дієнових кон’югат (ДК) та вторинного — малонового діальдегіду (МДА). Активність процесів ПОЛ визначали за Тімірбулатовим Р.А., Селезньовим Є.І. (1981). Антиоксидантну активність організму оцінювали за рівнем каталази крові (Чевари С., Андял Т., Штренир Я., 1991; Назаренко Г.І., Кишкун А.А., 2002).
Дослідження проводили в 1-шу (Н1) (етап 1), на 3-тю (Н3) (етап 2), 5-ту (Н5) (етап 3), 7-му (Н7) (етап 4), 10-ту (Н10) (етап 5) добу захворювання.
Результати та їх обговорення
Вихідні показники SIRS, тяжкості стану та вираженість проявів поліорганної дисфункції та її компонента — СГІД у хворих першої і другої групи були ідентичними. Оцінка тяжкості хворих за шкалою АРАСНЕ ІІ показала, що вихідний стан хворих обох груп практично був однаковий (рис. 1).
/127/127.jpg)
Але вже на 3-тю добу перебування хворих у відділенні анестезіології та інтенсивної терапії (ВАІТ) завдяки застосуванню СДК + ЕС вдалося суттєво зменшити тяжкість стану хворих (за шкалою АРАСНЕ ІІ до 26,62 ± 1,10 бала, р < 0,05). У хворих, у яких комбінація СДК + ЕС не застосовувалась, тяжкість стану хоча і зменшилася, але була вищою (29,25 ± 1,30 бала, р < 0,05), ніж в основній групі. У подальшому на кожному етапі дослідження тяжкість стану хворих, яким застосовували СДК + ЕС, була суттєво нижчою, ніж у хворих контрольної групи.
Вихідні прояви СПОН у хворих основної групи були дещо вищими, ніж у хворих контрольної групи (відповідно 15,95 ± 1,15 і 14,11 ± 1,10 бала, р > 0,05). Але вже упродовж 3 діб перебування хворих у відділенні анестезіології, реаніматології та інтенсивної терапії прояви СПОД значно швидше регресували в основній групі. Вже на 3-тю добу у хворих основної групи тяжкість СПОД за шкалою SOFA становила 13,64 ± 1,20 бала (р < 0,05), у хворих контрольної групи вона практично не змінилася (14,04 ± 1,10 бала, р > 0,05). Така тенденція зберігалася упродовж всього терміну дослідження (рис. 1). Тяжкість і прояви СПОД у хворих основної групи зменшувалися на 2–3 доби раніше, ніж у хворих контрольної групи.
У процесі лікування динаміка ознак системної відповіді на запалення у хворих обох груп була неоднорідною. Так, у другій (основній) групі було відмічено вірогідно (р = 0,01) швидше зменшення температурної реакції вже на другому етапі дослідження, у хворих контрольної групи — лише на 7-му добу проведення інтенсивної терапії (37,6 ± 0,5, р < 0,05). Частота серцевих скорочень у хворих другої групи також вірогідно зменшувалася упродовж перших трьох діб (табл. 1). У хворих контрольної групи тахікардія утримувалася до 7-ї доби проведення інтенсивної терапії (90 ± 8 уд. за 1 хв, р < 0,05).
Частота дихання у хворих обох груп мала однакову динаміку, але дихальний коефіцієнт вірогідно (р = 0,01) швидше нормалізувався у хворих основної групи (табл. 1).
Вихідний рівень лейкоцитозу у хворих обох груп був вищим за норму (відповідно 17,1 ± 2,1 • 109 і 17,8 ± 2,2 • 109, р < 0,05). Вже на другому етапі дослідження у хворих другої групи в процесі інтенсивної терапії вдалося досягнути суттєвого зниження кількості лейкоцитів у периферичній крові (14,1 ± 1,1 • 109, р < 0,05). Зниження лейкоцитозу у хворих першої групи настало лише на 5–6-ту добу проведення інтенсивної терапії (8,9 ± 1,6 • 109, р < 0,05). У хворих основної групи вірогідно швидше зменшувався зсув формули крові вліво.
Незважаючи на поліпшення показників гемодинаміки та киснево-транспортної системи (табл. 2), що досягалися в 1-шу добу за рахунок волемічної, інотропної та судинної підтримки, стан хворих, тяжкість поліорганної дисфункції взагалі і кишкової зокрема залишалися на попередньому рівні. Пояснити це можна реперфузійними пошкодженнями, що виникають в організмі після тяжкої гіпоперфузії.
Гіпоксія та реперфузія, у свою чергу, приводять до енергодефіциту клітин. Показники АТФ в еритроцитах у хворих обох груп у 1-шу добу були вірогідно нижчими за норму (р < 0,05) і відповідно становили 3,10 ± 0,23 мкмоль/гНв і 3,00 ± 0,22 мкмоль/гНв, але вже на 3-тю добу обстеження в групі хворих, яким застосовували СДК + ЕС, було виявлено вірогідне зростання рівня АТФ (3,43 ± 0,07 мкмоль/гНв, р < 0,05). У першій групі хворих динаміка рівня АТФ еритроцитів була невірогідною (3,20 ± 0,13 мкмоль/гНв, р > 0,05). На 5-ту добу захворювання зростання рівня АТФ також було більш значним у хворих 2-ї групи (3,97 ± 0,10 мкмоль/гНв, р < 0,05) на відміну від хворих 1-ї групи (3,81 ± 0,11 мкмоль/гНв, р < 0,05). Перевищував норму у хворих обох груп і рівень –2,3-ДФГ (табл. 2). Це свідчить про зсув кривої дисоціації гемоглобіну вправо (знижена спорідненість Нb до О2). Низькі значення патерну DO2 — VO2, співвідношення раО2/FiO2 і високий рівень 2,3-ДФГ вказують на напруженість системи тканинного дихання. Вірогідне зниження показника 2,3-ДФГ у хворих 2-ї групи настало на етапі Н3 дослідження (4,89 ± 0,20 мкмоль/мл, р < 0,05), що корелювало з підвищенням АФТ еритроцита (r = 0,76 при р < 0,05). У хворих контрольної групи нормалізація показника 2,3-ДФГ настала лише на 5-ту добу проведення інтенсивної терапії (4,80 ± 0,15 мкмоль/мл, р < 0,05), тобто покращення процесів тканинного дихання у хворих 2-ї групи відбувалося значно раніше.
На початку захворювання рівень прозапальних цитокінів у хворих обох груп вірогідно перевищував норму. Так, рівень TNF-а у хворих основної та контрольної груп відповідно становив 685,9 ± 14,1 пг/мл і 675,5 ± 15,5 пг/мл (р < 0,05), IL-8 — 4110,111 ± 21,730 пг/мл і 3970,101 ± 17,750 пг/мл (р < 0,05). У хворих 1-ї групи рівень TNF-а залишався на рівні його вихідного значення до етапу дослідження Н5 (табл. 3). На наступному етапі рівень фактора некрозу пухлини зменшувався та на 10-й день проведення інтенсивної терапії досягав 545,5 ± 9,5 пг/мл (р < 0,05), хоча і надалі перевищував норму. У хворих основної групи зниження TNF-а виникало на етапі дослідження Н5 (555,9 ± 9,1 пг/мл, р < 0,05) і наприкінці дослідження показник не перевищував норму — 435,9 ± 8,1 пг/мл (р > 0,05). Зниження IL-8 у хворих 1-ї групи настало лише на 10-й день ІТ (3670,86 ± 12,68 пг/мл, р > 0,05), хоча і надалі не досягало свого нормального значення. У хворих 2-ї групи помітне зниження рівня IL-8 настало на 5-й день ІТ (табл. 3).
Застосування СДК + ЕС у хворих із субкомпенсованим СГІД уже на 3-тю добу інтенсивної терапії приводило до вірогідного зниження (порівняно як із вихідними даними, так і з відповідними даними хворих 1-ї групи, р < 0,05) таких маркерів ендогенної інтоксикації, як лейкоцитарний індекс інтоксикації (ЛІІ), МСМ (табл. 4). ЛІІ на етапі Н3 у хворих основної групи знижувався до 1,6 ± 0,3 ум.од. (р < 0,05), тоді як у хворих контрольної групи він перевищував норму (2,0 ± 0,5 ум.од., р < 0,05) і вірогідно знижувався лише на 5-ту добу проведення інтенсивної терапії (1,7 ± 0,4 ум.од., р < 0,05). З динамікою ЛІІ корелювала динаміка таких маркерів ендотоксикозу, як СЗЕ та ПЕМ (відповідно r = 0,56 при р < 0,05 та r = 0,56 при р < 0,05). У хворих 2-ї групи значно швидше зменшувалася СЗЕ, що можна пояснити тим, що на поверхні еритроцитів зменшувалася сорбція токсинів із полярними групами (табл. 4). Уже на другому етапі дослідження у хворих основної групи наступало вірогідне зменшення СЗЕ до 41,4 ± 1,2 % (р < 0,05).
У хворих контрольної групи вірогідне зменшення цього показника наступало лише на етапі дослідження Н10 (39,1 ± 1,4 %,р < 0,05). Збільшена ПЕМ на 3-тю добу захворювання у хворих 2-ї групи (19,7 ± 0,5 ум.од., р > 0,05) в подальшому зменшувалася на 5-ту, 7-му та 10-ту добу (табл. 4). У хворих 1-ї групи цей показник залишався нижчим за норму до 3-ї доби (13,4 ± 0,8 ум.од., р > 0,05). На подальших етапах дослідження він зростав і був вищим від нормальних значень, що може вказувати на сформовану жорстку мембрану в еритроциті, яка не піддається конформації.
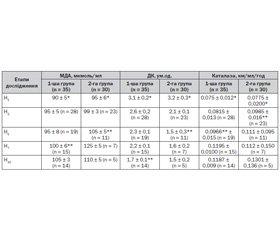
Побічно на динаміку ендотоксикозу вказує перекисне окислення ліпідів і антиоксидантний захист. Оцінюючи систему ПОЛ — АОА, треба сказати, що низький вихідний рівень МДА завжди вказував на прогностично несприятливий результат захворювання. Як видно з нижченаведених даних (табл. 5), у хворих 1-ї групи низький рівень МДА залишався довше порівняно з хворими 2-ї групи, і летальність хворих 1-ї групи також була вищою.
У першій групі хворих рівень МДА наближався до норми на 7-му добу захворювання (105 ± 5 мкмоль/мл, р < 0,05), у хворих 2-ї групи — на 5-ту (100 ± 6 мкмоль/мл, р < 0,05). Рівень ДК на початку захворювання у хворих обох груп був майже однаково підвищеним (р < 0,05) і відповідно становив 3,1 ± 0,2 ум.од. і 3,2 ± 0,3 ум.од., що вірогідно вище за норму (р < 0,05). Уже на 5-ту добу інтенсивної терапії в групі хворих, яким застосовували СДК + ЕС, було отримано зниження цього показника (2,1 ± 0,1 ум.од., р < 0,05). У хворих контрольної групи вірогідне зменшення ДК настало на етапі дослідження Н10 (табл. 5). АОА у хворих обох груп на момент надходження у відділення ВАІТ була виснаженою. Рівень каталази у хворих як контрольної, так і основної групи був набагато нижчим за норму (відповідно 0,075 ± 0,012 і 0,0775 ± 0,020 мкм/мл/год, р < 0,05). Проте у хворих 2-ї групи вже упродовж перших 3 діб їх перебування у відділенні ВАІТ відмічалося вірогідне підвищення рівня каталази до 0,0985 ± 0,0165 (р < 0,05) (причому відмічався сильний обернений кореляційний зв’язок із рівнем МДА — r = 0,78 при р < 0,05), у хворих 1-ї групи — упродовж 5 діб.
Включення СДК + ЕС до протоколу ІТ СПОН дозволило суттєво підвищити рНі (рис. 2). Як відомо, в основі розвитку СГІД лежать порушення перфузії та гіпоксія кишки, рНі може опосередковано вказувати на величину реперфузії кишки. Показники рНі в 1-шу добу розвитку критичного стану були ідентичні у хворих обох груп і відповідно становили 7,20 ± 0,02 і 7,10 ± 0,03. На 3-тю добу у хворих основної групи рНі зріс на 0,18 (р < 0,05), у хворих контрольної групи практично не змінилося порівняно з вихідним значенням (7,21 ± 0,02, р > 0,05). Треба відмітити, що і на 5-ту добу дослідження рНі контрольної групи вірогідно не змінився (7,25 ± 0,05, р > 0,05). У хворих основної групи цей показник підвищився до 7,31 ± 0,05 (р < 0,05).
Вихідна тяжкість СГІД в обох групах була майже однаковою, але вже на 3-тю добу у хворих, яким у протокол ІТ було включено застосування СДК + ЕС, прояви СГІД зменшилися та становили 2,5 ± 0,2 бала, у хворих контрольної групи — 2,7 ± 0,2 бала (рис. 3). На 7-му добу дослідження рівень СГІД у хворих основної групи вірогідно зменшувався (2,1 ± 0,1 бала, р < 0,05), у хворих контрольної групи залишався все ще високим (2,4 ± 0,3 бала, р < 0,05). Рівень СГІД у хворих контрольної групи зменшувався до рівня компенсованої недостатності лише наприкінці 10-ї доби дослідження.
Одним із критеріїв ефективності/доцільності проведення СДК була частота виникнення нозокоміальної пневмонії на 7–10-й день перебування хворого у відділенні ВАІТ.
Висновки
У групі хворих, яким у комплексній терапії було використано СДК + ЕС, значно швидше регресували ознаки SIRS, зменшувалася тяжкість стану пацієнтів, прояви СПОД і його компонента — СГІД. З 30 хворих 1-ї групи померло 7 осіб, тобто летальність становила 23,3 %, в основній групі з 29 пацієнтів померло 6 осіб. Таким чином, в основній групі хворих вдалося зменшити летальність на 3,3 %.
1. Воробьев К.П. Клинико-физиологический анализ категорий функционального состояния организма и интенсивная терапия // Вестник интенсивной терапии. — 2001. — № 2. — С. 3-8.
2. Гельфанд Е.Б., Гологорский В.А., Гельфанд Б.Р. Абдоминальный сепсис: интегральная оценка тяжести состояния больных и полиорганной дисфункции // Анест. и реаниматология. — 2000. — № 3. — С. 29-31.
3. Гирш А.О., Довгих В.Г, Мороз В.В. Комбинированная детоксикация у больных с разлитым гнойным перитонитом, протекающим на фоне сахарного диабета // Эфферентная терапия. — 2004. — № 1. — С. 13-16.
4. Григорьев Е.В., Чурляев Ю.А., Сибиль К.В. Клинико-патогенетические варианты повреждения гематоперитонеального барьера при абдоминальном сепсисе // Анест. и реаниматология. — 2006. — № 6. — С. 13-15.
5. Гутгиеррез Г., Баллик С. Гипоксия кишечника — двигатель СПОН. Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций (особая папка). — Архангельск, 2006. — С. 195-201.
6. Підгірний Я.М. Стратегічні напрямки інтенсивної терапії гастроінтестинальної дисфункції як компонента синдрому поліорганної дисфункції // Український журнал екстремальної медицини ім. Г.О. Можаєва. — 2009. — Т. 10, № 3. — С. 135-141.
7. Підгірний Я.М. Гастроінтестинальна дисфункція як компонент поліорганної дисфункції: діагностика та лікування // Український журнал клін. та лаб. діагностки. — 2009. — № 3. — С. 60-64.
8. Decludt B., Bouvet P., Mariani-Kurkidjian P. [et al.] Haemolyticuraemic syndrome and Shiga toxin-producing Esherichia coli infection in children in France // Infect. — 2000. — Vol. 124. — P. 215-220.
9. Kahlke V., Fndrich F., Brtzmann K. [et al.]. Selective decontamination of the digestive tract: Impact on cytokine release and mucosal damage after hemorrhagic shock // Crit. Care Med. — 2002. — Vol. 30, № 6. — Р. 1327-1333.
10. Komplan L., Kremzar B., Gadzijev E., Prosek M. Effects of early enteral nutrition on intestinal permeability and the developement of multiple organ failure afftermutiple injury // Inten. Care Med. — 1999. — № 25. — Р. 157-161.
11. Kotzampassi K., Grosomanidis B., Dadoukis D. // Ekeftheriadis E. Pancreas. — 2007. — Vol. 25. — P. 169-172.
12. Lwavelinq J.H., Marinq J.K., Klompmaker I.J. [et al.] Selective decontomination of the digestive tract to prevent postoperative infectoin: A randomized placebo controled trial in liver transplant patients // Crit. Care Med. — 2002. — № 6. — Р. 1204-1209.

/127/127_2.jpg)
/128/128.jpg)
/129/129.jpg)
/130/130.jpg)
/130/130_2.jpg)