Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Комплексна біохемілюмінесцентна оцінка церебропротекторної ефективності цереброгерму на моделі закритої черепно-мозкової травми
Авторы: Лук’янчук В.Д., Поліщук Є.М. - Кафедра фармакології, ФПО ДЗ «Луганський державний медичний університет»; Сейфулліна І.Й. - Кафедра загальної хімії та полімерів, Одеський національний університет імені І.І. Мечникова; Постернак Г.І. - Кафедра анестезіології, реаніматології та невідкладних станів ФПО ДЗ «Луганський державний медичний університет»; Кравець Д.С., Рисухіна Н.В. - Кафедра фармакології, ФПО ДЗ «Луганський державний медичний університет»;
Марцинко О.Є. - Кафедра загальної хімії та полімерів, Одеський національний університет імені І.І. Мечникова
Рубрики: Медицина неотложных состояний, Неврология
Разделы: Клинические исследования
Версия для печати
Відомо, що гіперініціація вільнорадикального окислення фосфоліпідів мембран церебральних нейронів у місці первинного ушкодження за умов закритої черепно-мозкової травми відіграє ключову роль у патогенезі цього екстремального стану. Отже, для переривання даного ланцюгового механізму вторинного пошкодження мембран нейронів принципове значення має здатність потенційних церебропротекторних засобів реалізовувати антирадикальний захист головного мозку, що буде визначати характер перебігу та наслідки закритої черепно-мозкової травми.
Раніше проведеними нами скринінговими дослідженнями на моделі закритої черепно-мозкової травми встановлена висока лікувальна ефективність вперше синтезованої координаційної сполуки ферум біс(цитрато)германат (цереброгерм).
Метою дослідження було провести в динаміці біохемілюмінесцентний аналіз фармакотерапевтичної дії цереброгерму за умов закритої черепно-мозкової травми.
Експериментально доведено, що досліджувана оригінальна координаційна сполука реалізує високу антирадикальну активність, на що вказує модифікація всіх параметрів біохемілюмінесцентного світіння на моделі закритої черепно-мозкової травми. Більше того, цереброгерм здатен ефективно сприяти збереженню пула ендогенних антиоксидантів, за рахунок чого частота обривів вільнорадикальних ланцюгових реакцій переважає над частотою його розгалужень і, як результат, процес ліпідного переокиснення, ініційований за умов травматичного пошкодження головного мозку, піддається різкому гальмуванню.
Известно, что гиперинициация свободнорадикального окисления фосфолипидов мембран церебральных нейронов в месте первичного повреждения в условиях закрытой черепно-мозговой травмы играет ключевую роль в патогенезе этого экстремального состояния. Поэтому для прерывания данного цепного механизма вторичного повреждения мембран нейронов принципиальное значение имеет способность потенциальных церебропротекторных средств реализовывать антирадикальную защиту головного мозга, что будет определять характер течения и последствия закрытой черепно-мозговой травмы.
Ранее проведенными нами скрининговыми исследованиями на модели закрытой черепно-мозговой травмы установлена высокая лечебная эффективность впервые синтезированного координационного соединения феррум бис(цитрато)германат (цереброгерм).
Целью исследования было провести в динамике биохемилюминесцентный анализ фармакотерапевтического действия цереброгерма в условиях закрытой черепно-мозговой травмы.
Экспериментально доказано, что исследуемое оригинальное координационное соединение реализует высокую антирадикальную активность, на что указывает изменение всех параметров биохемилюминесцентного свечения на модели закрытой черепно-мозговой травмы. Более того, цереброгерм способен эффективно способствовать сохранению пула эндогенных антиоксидантов, за счет чего частота обрывов свободнорадикальных реакций преобладает над частотой его разветвлений и, как результат, процесс липидного переокисления, инициированный в условиях травматического повреждения головного мозга, подвергается резкому торможению.
Initiation of membranes phospholipids peroxidation in the primary site of injury under conditions of closed traumatic brain injury plays a key role in the pathogenesis of this extreme condition. So, in order to interrupt the chain mechanism of secondary damage of the neuronal membranes the antiradical properties of the potential cerebroprotective remedies have particular importance that will determine the nature of the course and consequences of closed intracranial injury.
Our previous screening researches found a high therapeutic efficacy of the originally synthesized coordination compound of ferrum bis(citrate)germanate (cerebrogerm) under the conditions of closed intracranial injury.
The aim of the research was to study the influence of cerebrogerm on the course of the of free radical reactions in the blood serum in dynamics.
Experimentally it was proven that the studied original coordination compound showed a high antiradical activity, as confirmed by the change in all biochemiluminescence parameters on the model of closed intracranial injury. Moreover, Cerebrogerm is able to preserve pool of endogenous antioxidants, whereby the frequency of free radical reactions discontinuation dominates over the frequency of its ramifications and as a result, the process lipids peroxidation initiated under conditions of traumatic brain injury, is slammed a brake.
координаційні сполуки германію, церебропротектори, біохемілюмінесценція, закрита черепно-мозкова травма.
координационные соединения германия, церебропротекторы, биохемилюминесценция, закрытая черепно-мозговая травма.
coordination compounds of germanium, cerebroprotector, biochemiluminescence, closed intracranial injury.
Статья опубликована на с. 152-157
Вступ
Гіперініціація вільнорадикального окислення фосфоліпідів мембран церебральних нейронів у місці первинного ушкодження за умов закритої черепно-мозкової травми (ЗЧМТ) на тлі дії тригерного чинника патологічних змін відіграє ключову роль у патогенезі цього екстремального стану [8, 10]. Активації перекисного окислення ліпідів при ЗЧМТ сприяє високий вміст у тканині мозку ненасичених жирних кислот, а також церебральна гіпоксія, надлишок прооксидантів (Fe2+) у зоні крововиливу та лізису еритроцитів на тлі зниження рівня та активності компонентів антиоксидантного захисту. Отже, для переривання даного ланцюгового механізму вторинного пошкодження мембран нейронів принципове значення має здатність потенційних церебропротекторних засобів реалізовувати антирадикальний захист головного мозку, що врешті-решт буде визначати характер перебігу та наслідки ЗЧМТ [3, 4].
Раніше проведеними нами скринінговими дослідженнями на моделі ЗЧМТ встановлена висока лікувальна ефективність вперше синтезованої координаційної сполуки ферум біс(цитрато)германат (цереброгерм).
Мета дослідження — провести в динаміці біохемілюмінесцентний (БХЛ) аналіз фармакотерапевтичної дії цереброгерму за умов ЗЧМТ.
Матеріали і методи дослідження
Дослідження проведені на білих безпородних щурах масою 200–220 г обох статей у лабораторії кафедри фармакології ДЗ «Луганський державний медичний університет» (ЛугДМУ), сертифікованій ДП «Державний експертний центр Міністерства охорони здоров’я України», згідно з методичними рекомендаціями [5].
Експериментальною моделлю ЗЧМТ слугував патологічний процес, що розвивається у тварин на тлі нанесення дозованого за силою та орієнтованого за локалізацією удару вільнопадаючим вантажем масою 45 г на тім’яну ділянку черепа щурів, що знаходилися під легким ефірним наркозом та були зафіксовані у вдосконаленій камері Когана за допомогою спеціального пристрою оригінальної конструкції [6]. Клінічна картина форми ЗЧМТ, що моделюється, відповідає ушкодженню головного мозку середнього ступеня [9].
Усі тварини були поділені на 4 групи по 6 щурів у кожній: інтактну, контрольну, дослідну та референтну. Щурам дослідної серії після нанесення ЗЧМТ внутрішньочеревинно вводили цереброгерм у вигляді 2% розчину в дозі 126,5 мг/кг через 1 год 11 хв згідно з попередньо розробленим оптимальним режимом дозування. Як препарат порівняння обрано загальновідомий та добре вивчений фармакотерапевтичний засіб церебропротекторної дії, що широко застосовується у неврологічній практиці та експериментальній фармакології, — пірацетам («Дарниця», Україна), який тваринам референтної групи вводили таким же шляхом у дозі 100 мг/кг у вигляді 20% розчину через 30 хв після моделювання патології [2]. Контрольній серії щурів після нанесення ЗЧМТ внутрішньочеревинно вводили еквіоб’ємну кількість ізотонічного розчину натрію хлориду.
Інтенсивність надслабкого світіння вивчали в сироватці крові в динаміці: через 6, 24 і 72 години після моделювання патології. У роботі використовували удосконалений співробітниками кафедри фармакології ЛугДМУ метод визначення в тканинах надслабкого світіння, індукованого 3% розчином пероксиду водню [1].
БХЛ-аналіз фармакотерапевтичної ефективності цереброгерму за умов експерименту, що досліджується, проводили за хемілюмінограмами сироватки крові, які реєстрували протягом 5 хвилин на хемілюмінометрі «Emіllіte-1105» у такому режимі: спектральний діапазон 350–390 нм, діапазон вимірів — 103–1010 фотон/с. Сироватку крові попередньо інкубували (15 хвилин при 37 °С).
Кінетику вільних радикалів оцінювали за низкою показників: амплітуда швидкого спалаху (І1), амплітуда повільного спалаху (І2), час індукції повільного спалаху (t), а також загальна світлосума реакції (S). Для всебічної оцінки стану антирадикальної та антиоксидантної системи (АОС) організму, а також їх взаємозв’язку нами вперше запропоновано низку показників: потужність антиоксидантної
системи , радикальний пул , абсолютна радикальна активність , абсолютна антиоксидантна активність , показник проксидантно-антиоксидантної рівноваги, а також напруження антиокси-дантної системи .
Розрахунок досліджуваних параметрів проводили за допомогою комп’ютерної програми, спеціально розробленої на кафедрі фармакології ЛугДМУ.
Отримані результати обробляли за допомогою U-критерію Вілкоксона — Манна — Уїтні [7]. Відмінності вважали вірогідними при значимості не менше ніж 95 % з використанням пакета прикладних програм Statistica 6.0.
Результати досліджень та їх обговорення
Показники БХЛ, що характеризують інтенсивність надслабкого світіння в сироватці крові щурів за умов експерименту, який досліджується, наведені на рис. 1, 2 та в табл. 1.
/153/153.jpg)
Інтенсивність надслабкого світіння характеризує швидкість перебігу ліпідної пероксидації, яку в першу чергу оцінювали за показником загальної світлосуми. Як видно з рис. 1, при ЗЧМТ (контроль) кількість вільних радикалів, що утворилися, а отже, й світлосума БХЛ-реакцій, значно зростає в усі терміни дослідження. При цьому максимальний вміст вільних радикалів реєструється на 24-й годині дослідження, коли різниця в контрольній та інтактній групах сягає 41 %. Незважаючи на тенденцію до зниження, цей показник у контролі й на 72-й годині на 18 % вищий за такий, що реєструється в інтактних тварин.
Інша динаміка змін показника світлосуми БХЛ спостерігається в сироватці крові щурів із ЗЧМТ, яких лікували цереброгермом. Так, величина S у сироватці дослідних тварин у середньому на 15 % нижча, ніж у контрольній групі. Це переконливо свідчить про підвищення стійкості фосфоліпідів до вільнорадикального окислення під впливом церебропротектора, що досліджується, та вказує на його здатність значно знижувати число вільнорадикальних ланцюгів розгалуження, пригнічуючи таким чином реакції ПОЛ. Більше того, значення S в дослідній групі на 24-й та 72-й годині дослідження вірогідно нижчі, ніж у референтній групі, тобто у тварин, які отримували пірацетам (Р < 0,05) (рис. 1).
Аналіз динаміки величин І1, які графічно подані на рис. 2, вказує на суттєве підвищення показника БХЛ у контролі впродовж дослідження на 56, 79 та 29 % на 6, 24 та 72-й годині відповідно порівняно з інтактними тваринами. Ці зрушення, на нашу думку, є результатом накопичення гідропероксидів ліпідів, що обумовлено, з одного боку, інтенсифікацією ПОЛ активними формами кисню, надлишок яких, імовірно, утворюється внаслідок травматичного пошкодження головного мозку, а з іншого — уповільненням їх знешкодження.
/154/154.jpg)
У дослідній же групі під впливом цереброгерму протягом усього експерименту значення І1 вірогідно нижчі за такі, що реєструються у тварин контролю (Р = 0,028), із максимальною різницею на 24-годинній позначці в 22 % (середній показник 19,5 %). Тобто церебропротектор, що вивчається, має виражену здатність зменшувати генерацію вільних радикалів в організмі тварин із ЗЧМТ, наближаючи на 72-й годині величини І1 до таких, що зафіксовані в інтактних щурів (Р > 0,05). Крім того, значення І1 під впливом цереброгерму вірогідно нижчі за показники, що реєструються в референтній групі тварин на 24-й та 72-й годині (Р < 0,05), проте вірогідних відмінностей (Р > 0,05) від значень групи порівняння в більш ранні терміни (6 год) не відзначається.
Аналіз величин амплітуди повільного спалаху надслабкого світіння в сироватці крові при ЗЧМТ (табл. 1) показує, що цей параметр БХЛ стабільно в часі перевищує аналогічний показник, що визначається в інтактних щурів, впродовж усього спостереження, із максимальною різницею на 24-й годині, коли I2 в контролі сягає 704,17 ± 12,77 імп/с проти величини I2, що дорівнює 374,33 ± 15,98 імп/с у тварин інтактної групи (Р = 0,028).
Лікування щурів цереброгермом за умов патологічного стану, що моделюється, призводить до вірогідного (Р < 0,05) зниження показника І2 порівняно з контрольною групою в усі терміни визначення на 15–31 %. Крім того, під впливом цереброгерму амплітуда повільного спалаху протягом усього експерименту не має вірогідних відмінностей (Р = 0,028–0,043) порівняно з інтактною серією.
Встановлений характер змін амплітуди повільного спалаху БХЛ при застосуванні координаційної сполуки германію, що досліджується, на наше переконання, свідчить про здатність потенційного церебропротектора сповільнювати швидкість утилізації іонів Fe2+, попереджаючи таким чином надмірну ініціацію ланцюгових реакцій, що перебігають за участю цього металу, як у період максимальної продукції вільних радикалів, так і в інші терміни дослідження за умов ЗЧМТ.
Важливим показником, що характеризує антиоксидантну активність будь-якого біосубстрату, є час індукції повільного спалаху надслабкого світіння, за величиною якої можна судити про співвідношення у системі про- та антиоксидантів. Встановлено, що у контролі значення t у сироватці крові значно знижується протягом усього експерименту, що вказує на зміщення прооксидантно-антиоксидантної рівноваги в бік прооксидантів за умов травматичного пошкодження головного мозку (табл. 1).
При використанні ж цереброгерму час, впродовж якого фосфоліпіди чинять опір окисленню, значно збільшується. Примітно, що на тлі лікування ЗЧМТ розроблюваним церебропротектором протягом усього експерименту є чітка тенденція до підвищення значення t і на 72-й годині вірогідних відмінностей із інтактною групою вже не реєструється (Р > 0,05). При цьому порівняно з контролем величини t значно вищі (у середньому на 29,5 %). Усе це може бути свідченням сумарного підвищення вмісту екзо- та ендогенних антиоксидантів в організмі травмованих тварин за рахунок того, що цереброгерм, з одного боку, здатен попереджати витрати компонентів фонду антиоксидантної системи захисту організму, а з іншого — сам виступає як засіб безпосереднього антирадикального захисту за умов ЗЧМТ.
Узагальнюючи інтерпретації отриманих результатів, є підстави зробити висновок, що модифікація всіх параметрів БХЛ на тлі застосування цереброгерму свідчить про суттєве підвищення спроможності фосфоліпідів протистояти вільнорадикальному окисленню, що, як нам видається, реалізується вираженими мембранопротекторними властивостями даної координаційної сполуки, в основі механізму церебропротекторної дії якої лежить антирадикальна активність. Більше того, на нашу думку, цереброгерм здатен сприяти збереженню пулу ендогенних антиоксидантів, за рахунок чого частота обривів вільнорадикальних ланцюгових реакцій переважає над кількістю його розгалужень, і, як результат цього, відбувається процес різкого гальмування ліпідного переокислення, ініційованого за умов ЗЧМТ.
Особливу увагу було приділено аналізу вперше запропонованих нами показників комплексної оцінки БХЛ тканин організму, які суттєвим чином розширюють та доповнюють наші уявлення про фармакодинаміку будь-якого лікарського засобу та, зокрема, потенційного церебропротектора цереброгерму.
Отримані при цьому результати наведені у табл. 2 та на рис. 3.
/155/155.jpg)
При їх аналізі на перший погляд видається парадоксальним той факт, що потужність антиоксидантної системи, яка характеризує її спроможність попереджати інтенсивність виникнення другого спалаху БХЛ, в контрольній, дослідній та референтних групах майже не має вірогідних відмінностей між собою та з інтактною групою. Але варто врахувати, що величина Р відображає відношення І1 до І2, а у референтній та контрольній групах амплітуда І2 є відносно високою. У дослідній же групі значення амплітуд обох спалахів є помірними, тобто і їх співвідношення буде невисоким. Іншими словами, цереброгерм підвищує здатність АОС до опору генерації повільного спалаху. Також неймовірним є те, що радикальний пул у контрольній групі є найнижчим. Це пояснюється тим, що, незважаючи на високу світлосуму реакції, у контролі більшість радикалів витрачається на генерації першого та другого спалахів надслабкого світіння. У дослідній же групі радикальний пул на останньому терміні спостереження (72 год) не має вірогідних відмінностей з інтактною групою, що свідчить про антирадикальні властивості цереброгерму (табл. 2).
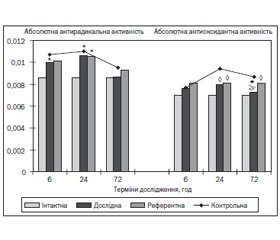
Аналіз абсолютної радикальної активності показує (рис. 3), що в контрольній, дослідній та референтній групах вона дещо підсилюється. Скоріше за все, це пов’язане з активацією процесів вільнорадикального окислення на тлі ЗЧМТ. Однак при цьому на себе звертає увагу той факт, що в дослідній групі кількість вільних радикалів, які формуються в біосубстраті після ініціації їх утворення, є найнижчою. Проте тривалість дії антиоксидантної системи, про що свідчить величина такого показника, як абсолютна антиоксидантна активність, у дослідній групі тварин зростає в середньому на 11,6 % порівняно з контрольними тваринами, а на 72-й годині експерименту різниця з показником АА, що був зафіксований в інтактній групі, не є вірогідною (> 0,05).
При аналізі показника, що характеризує стан прооксидантно-антиоксидантної рівноваги, звертає на себе увагу та обставина, що в контрольній групі тварин рівновага зміщується в бік прооксидантних процесів. Однак застосування цереброгерму реалізується підвищенням активності антиоксидантних процесів, про що свідчить збільшення величини РВ на 16,3 % порівняно с контролем (табл. 2).
Аналогічних змін зазнає і напруження антиоксидантної системи. Так, у контрольній групі тварин величина РА знижується у 2,4 раза порівняно з такою, що зареєстрована в інтактних тварин. Це свідчить про різке прогресування оксидативного стресу в організмі в умовах ЗЧМТ. Застосування ж координаційної сполуки, що досліджується, сприяє збільшенню напруження антиоксидантної системи в 1,7 раза, яке практично сягає рівня в інтактних тварин. Це свідчить про спроможність АОС зменшувати інтенсивність другого піку біохемілюмінесценції та віддаляти його в часі за рахунок наявного в системі (організмі) пулу ендо- та екзогенних антиоксидантів.
Підбиваючи підсумки комплексного біохемілюмінесцентного дослідження оригінальної координаційної сполуки ферум біс(цитрато)германат (цереброгерм), можна вважати доведеною високу антирадикальну активність цього потенційного церебропротекторного засобу, на що вказує модифікація всіх параметрів БХЛ-світіння на моделі ЗЧМТ. Більше того, цереброгерм здатен ефективно сприяти збереженню пула ендогенних антиоксидантів, за рахунок чого частота обривів вільнорадикальних ланцюгових реакцій переважає над частотою його розгалужень, як результат, процес ліпідного переокислення, ініційований за умов ЗЧМТ, піддається різкому гальмуванню.
1. Лукьянчук В.Д., Кравец Д.С., Витохина Н.В. и др. Биохемилюминесцентный анализ фармакодинамики лекарственных средств: Метод. рекомендации. — К., 2010. — 42 с.
2. Лукьянчук В.Д. Скрининг и сравнительная оценка церебропротекторной активности координационных соединений германия при закрытой черепно-мозговой травме / В.Д. Лукьянчук, И.И. Сейфуллина, А.А. Высоцкий, Е.Э. Марцинко, О.Г. Песарогло // Ліки. — 2006. — № 5–6. — С. 38-41.
3. Говорова Н.В. Влияние мексидола на оксидантный стресс у больных с тяжелой черепно-мозговой травмой // Бюллетень экспериментальной биологии и медицины. — 2006. — № 1. — С. 41-44.
4. Держинский Н.В. Интенсивность свободно-радикального окисления липидов и белков и состояние антиоксидантной системы у больных с тяжелой черепно-мозговой травмой: Автореф. дисс... канд. мед. наук по спец. 03.01.04 — «Биохимия». — Тюмень, 2012. — 20 с.
5. Доклинические исследования лекарственных средств: Метод. рекоменд. / Под ред. член-кор. АМН Украины А.В. Стефанова. — К., 2002. — 567 с.
6. Патент на корисну модель 13678, Україна, МПК G09В 23/28. Спосіб моделювання черепно-мозкової травми / В.Д. Лук’янчук, О.В. Шевчук, О.В. Бадінов. — № u200509483; Заявл. 10.10.05; Опубл. 17.04.06, Бюл. № 4. — 8 с.
7. Петри А., Сэбин К. Наглядная статистика в медицине: Пер. с англ. — М.: ГЭОТАР-Медиа, 2003. — 143 с.
8. Садова В.А. Особенности реакции системы ПОЛ-АОС при осложненном течении черепно-мозговой травмы // Вестник Южно-Уральского государственного университета. Серия «Образование, здравоохранение, физическая культура». — 2012. — № 28. — С. 12-16.
9. Травматология: национальное руководство / Под ред. Г.П. Котельникова, С.П. Миронова. — М.: ГЭОТАР-Медиа, 2008. — 808 с. (Серия «Национальные руководства»).
10.Чубарова А.С., Курченко В.П. Характеристика антиоксидантной активности субстанции силимарина в составе гепатопротекторных лекарственных препаратов // Медицинские новости. — 2013. — № 3. — C. 64-66.

/154/154_2.jpg)
/156/156.jpg)