Международный неврологический журнал 7 (69) 2014
Вернуться к номеру
Психоэмоциональные нарушения у пациентов с височной эпилепсией и их морфологическое обоснование
Авторы: Кистень О.В., Евстигнеев В.В., Сакович Р.А. — ГУО «Белорусская медицинская академия последипломного образования», г. Минск, Беларусь
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 9-13
Введение
Эпилепсия является достаточно распространенным заболеванием, находящимся на стыке неврологии и психиатрии. Разработка и применение новых противоэпилептических средств позволили не только улучшить качество жизни пациентов благодаря контролю над приступами, но и повлиять на их социальное функционирование. Однако важной проблемой остаются те или иные психопатологические расстройства, особенно при многолетнем течении болезни. Они могут проявляться в форме аффективных симптомов, поведенческих реакций, транзиторных продуктивных психопатологических расстройств, а в ряде случаев — в виде дефицитарных нарушений, включая деменцию.
До настоящего времени нет единой четкой классификации психических расстройств у пациентов с эпилепсией. Вместе с тем большинство исследователей в своих работах с целью систематизации психических нарушений соотносят их с ведущим проявлением болезни — припадками.
Известно, что психические расстройства могут возникать в качестве предвестника приступа, в рамках ауры и как проявление самого припадка.
Психические феномены в интериктальном периоде отличаются многообразием расстройств. Достаточно часто возникает изменение настроения, в меньшей степени — эпизодические острые или подострые психозы. В связи с этим с учетом развития тех или иных расстройств следует помнить об индивидуальных реакциях пациента на свое заболевание, а также о реагировании общества [1].
В настоящее время в клинической картине ведущее место занимают пограничные психические нарушения, к которым относятся вторично-невротические, отражающие преимущественно особенности личностного реагирования на заболевание и в меньшей степени зависимые от прогредиентности самого эпилептического процесса [3].
В последние годы появились публикации, посвященные изучению коммуникативных, познавательных, поведенческих и социальных нарушений и их взаимосвязи с постоянной локальной или генерализованной эпилептической активностью на ЭЭГ [1]. Подобная активность указывает на нарушения функционирования мозга, приводящие к изменению нейрональной комбинаторики и переработки информации. Все это приводит к стойкой межприступной симптоматике, проявляющейся непсихотическими психическими расстройствами, которые играют заметную роль, определяя качество жизни пациента.
Данное обстоятельство в какой-то мере отодвигает роль припадка, а на первое место выходят характерологические изменения, приводящие к дезадаптации пациента, чему в настоящее время придается большое значение. Развитие подобных состояний по своему механизму идентично патогенезу эпилептического пароксизма, реализуемого через эпилептизацию нейронов с последующим дезинтегрирующим влиянием на интерактивную деятельность мозга, приобретая пролонгированное течение у 30–80 % пациентов [3].
Наиболее часто встречаемым при эпилепсии психопатологическим коморбидным расстройством является депрессия, которая регистрируется у 40–60 % пациентов [4, 7, 8]. Депрессия при эпилепсии является плеоморфным аффективным расстройством, проявляющимся рядом симптомов: лабильными депрессивными симптомами (депрессивное поведение, астения, бессонница, боль), лабильными аффективными симптомами (страх, тревожность) и, предположительно, специфическими симптомами (приступы раздражительности, эйфоричное настроение), наблюдаемыми у 70 % пациентов [4–6].
Данное обстоятельство диктует необходимость проведения исследования, позволяющего соотнести те или иные психоэмоциональные феномены с поражением некоторых структур мозга либо их комбинаций, что обусловливает нарушение выполнения физиологических функций.
Материалы и методы
Нами проведено комплексное обследование 80 пациентов, страдающих эпилепсией. Средний возраст больных составил 28,9 ± 1,5 года. Критерием включения был достоверный диагноз с определением эпилептического синдрома и типа припадков в соответствии с рекомендациями Международной противоэпилептической лиги. Всем пациентам были выполнены нейровизуализация (56 из них — диффузионная тензорная магнитно-резонансная томография (МРТ) с трактографией) и ЭЭГ с картированием основных показателей. У 28 пациентов проведена многовоксельная протонная магнитно-резонансная спектроскопия (1Н-МРС). Для выявления интериктальной депрессии и тревожного расстройства использовались критерии МКБ-10, а для оценки степени их тяжести применялись тесты Бека и Спилбергера — Ханина. Оценку качества жизни проводили с помощью QOLIE-31 (Quality Of Life In Epilepsy), оценку степени тяжести приступов — по опроснику SSQ (Seizure Severity Questionnaire), которые рекомендованы Международной противоэпилептической лигой.
Для статистической обработки использовали программный пакет Statistica 6.0 (критерий Уилкоксона, логистическая регрессия, корреляционный анализ Спирмена, тест Фишера). Результаты представлены при уровне достоверной значимости р < 0,05.
Результаты
Все обследованные нами пациенты имели полиморфные приступы, которые представляли собой сочетание простых, сложных парциальных и генерализованных пароксизмов. Результаты анализа показали, что 55,0 % пациентов предъявляли жалобы на наличие эмоциональной лабильности и лишь 10,0 % из них — на дисфорические нарушения.
Согласно шкале депрессии Бека, у 33 из 80 (41,3 %) обследованных была выявлена депрессия. Высокий уровень личностной тревожности (ЛТ) обнаружен у 36 из 80 (45,0 %), а высокий уровень ситуативной тревожности (СТ) — у 29 из 80 (36,3 %) обследованных. Согласно результатам нашего исследования, статистически значимого влияния возраста и уровня образования на развитие депрессии и тревожных расстройств у больных эпилепсией не выявлено. Имелась достоверная связь депрессии с женским полом (r = 0,34, p = 0,045).
Наличие депрессивных симптомов четко коррелировало с количеством приступов в месяц до начала терапии (r = 0,42, p = 0,04), а также с выявленным в анамнезе перинатальным поражением нервной системы (r = 0,6, p = 0,005).
Ранний дебют, продолжительность заболевания и наличие в анамнезе генерализованных тонико-клонических припадков оказались значимыми факторами для развития тревожных расстройств. Другие факторы не показали значимого влияния на возникновение или отсутствие тревожно-депрессивных симптомов у обследованных пациентов.
При отсутствии депрессии обнаружена связь с особенностями антиконвульсивной терапии, принимаемой в течение последнего месяца (комбинация ламотриджина и депакина хроно) (r = 0,54, p = 0,02). Сопутствующая депрессия часто имела место у пациентов, которые ранее нерегулярно принимали антиэпилептические препараты (r = 0,45, p = 0,028). Все пациенты после перехода от политерапии к монотерапии сообщили об улучшении настроения, внимания и социальной адаптации. Снижение частоты либо прекращение приступов, а также изменение их характера на абортивный после начала рациональной терапии достоверно коррелировали с уменьшением степени личностной тревожности по шкале Спилбергера — Ханина.
Депрессия достоверно была связана с левосторонней латерализацией фокуса (r = 0,56, p = 0,022), наличием на ЭЭГ различных очаговых феноменов: спайков (r = 0,53, p = 0,028), острых волн (r = 0,52, p = 0,026), комплексов «острая волна — медленная волна» (r = 0,46, p = 0,039), сопутствующей ЛТ (r = 0,48, p = 0,025) и СТ (r = 0,47, p = 0,025).
Предиктором отсутствия депрессии оказалась клиническая ремиссия в течение последнего года (OR = 5,86, p = 0,03, χ2 = 4,6).
Предикторами возникновения депрессии при эпилепсии в группе обследованных нами социально адаптированных пациентов оказались следующие факторы: феномен «острая волна — медленная волна» на ЭЭГ (OR = 9,6, p = 0,0001, χ2 = 15,11); наличие латерализации эпилептического фокуса на ЭЭГ в левом полушарии (OR = 6,67, р = 0,045, χ2 = 3,46); феномен «множественные спайки» на ЭЭГ (OR = 5,6, p = 0,03, χ2 = 4,46); женский пол (OR = 4,2, p = 0,04, χ2 = 3,95); высокая частота приступов до начала рациональной терапии (OR = 3,43, p = 0,026, χ2 = 4,9); наличие фокального начала припадка (OR = 2,1, p = 0,039, χ2 = 4,27).
Итак, несмотря на рациональную терапию антиконвульсантами, отсутствие приступов или значительное сокращение их количества, около 40 % социально адаптированных и не нуждающихся в госпитализации пациентов с эпилепсией имеют тревожные (с преобладанием личностной тревожности) и депрессивные расстройства, что требует коррекции.
Полученные нами данные обозначили феномен «острая волна — медленная волна» на ЭЭГ как важнейший фактор риска, а наличие левосторонней латерализации эпилептического фокуса — как второй по значимости предиктор развития депрессии у больных височной эпилепсией.
Наличие феномена «множественные спайки» на ЭЭГ оказалось на третьем по значимости месте. Следует подчеркнуть, что наибольшая вероятность развития депрессии у пациентов с эпилепсией ассоциирована с наличием специфической для данного заболевания пароксизмальной активности.
Согласно полученным нами результатам, женский пол также является предиктором развития депрессии у пациентов с эпилепсией.
В обследованной нами группе пациентов не выявлено влияния возраста и уровня образования на возникновение депрессии, хотя некоторые исследователи отмечают статистически значимую корреляцию низкого уровня образования с наличием депрессии вследствие ограничения социальной и познавательной активности индивидуума [7].
Значимость высокой частоты приступов до начала рациональной терапии и фокального начала припадка в развитии депрессии также согласуется с некоторыми предыдущими исследованиями. Например, было показано, что развитие депрессии наиболее характерно для пациентов с симптоматической фокальной эпилепсией, частыми (более 1 раза в неделю) приступами, в особенности со сложными парциальными припадками при височной эпилепсии [7]. Сильная корреляционная связь снижения качества жизни по всем пунктам опросника QOLIE-31 выявлена у пациентов с депрессией (r = –0,76), при наличии высокой личностной (r = –0,82) и высокой ситуативной (r = –0,7) тревожности (p < 0,0001).
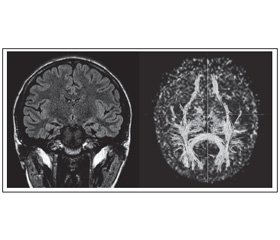
Проведение диффузионной тензорной МРТ с трактографией позволило определить микроструктурные изменения у всех обследованных нами пациентов, в то время как обычная МРТ была информативна только в 40 % случаев. Наиболее важный показатель интеграции белого вещества мозга — фракционная анизотропия (ФА) в группе здоровых добровольцев составила 0,560 (0,54/0,57) для передних и 0,565 (0,56/0,57) для задних квадрантов. Пациенты с фармакорезистентной эпилепсией (ФРЭ) имели билатеральное снижение значений ФА: для передних отделов мозга — 0,52 (0,5/0,55), для задних — 0,53 (0,52/0,54), при этом преимущественная редукция ФА определялась в полушарии с эпифокусом (p < 0,05). У пациентов, находящихся в ремиссии более 1 года, значения ФА также отличались от контрольных (p < 0,05), однако не имели различий в сравнении с группой с ФРЭ (р > 0,05). Наряду с этим имела место определенная связь ФА в полушарии с эпилептическим фокусом и показателем степени тяжести приступов по опроснику SSQ (r = –0,38, р < 0,05), что может быть прогностическим критерием в оценке эффективности лечебных мероприятий.
Корреляционный анализ выявил достоверную связь значений ФА передних отделов полушария, содержащего эпилептический фокус, с размерами центральных отделов боковых желудочков (r = –0,52, р = 0,009).
В группе здоровых добровольцев значения показателя средней диффузионной способности (СДС) составили 0,83 (0,80/0,86) для передних и 0,85 (0,80/0,88) для задних квадрантов. СДС в группе пациентов, находящихся в ремиссии, была увеличена по сравнению с контролем в полушарии, содержащем эпифокус (Z = 2,48, р = 0,013). Полученные результаты позволили выявить достоверную разницу значений СДС на стороне эпилептического очага у пациентов, находящихся в стойкой ремиссии, по сравнению с фармакорезистентными больными (для передних квадрантов — 0,87 (0,84/0,90) и 0,90 (0,86/0,93), для задних квадрантов — 0,88 (0,86/0,89) и 0,90 (0,88/0,91) соответственно (р < 0,05)). Данный показатель может быть важным фактором в отношении прогноза клинического течения заболевания. Выявлена связь снижения значений ФА (r = –0,46, p < 0,0001) и повышения СДС (r = 0,35, p < 0,0001) заднего квадранта гомолатерально эпилептогенному очагу и длительности заболевания.
Выделены четыре кластера распределения зон со сниженными по сравнению с контролем показателями фракционной анизотропии, визуализируемые при трактографии: 1) снижение представленности трактов в лобных отделах мозга; 2) снижение представленности трактов в наружных отделах полушарий мозга моно- или билатерально; 3) редукция передней и/или задней комиссуры; 4) сочетание вышеперечисленных изменений [2].
Наличие этих кластеров в определенной степени свидетельствует о «заинтересованности» различных регионов мозга в ходе реализации эпилептического приступа и является предиктором характера течения заболевания, а также наличия сопутствующих психоэмоциональных расстройств. В частности, наличие первого варианта вышеперечисленных кластеров (снижение представленности трактов в лобных отделах мозга) оказалось характерным для пациентов с фармакорезистентными формами эпилепсии (r = 0,46, p = 0,0005) (рис. 1). Данный кластер был характерен для пациентов, труд которых не отличался интеллектуальным напряжением и у которых отсутствовало творческое хобби (r = 0,39, p = 0,02), заболевание начиналось в раннем детском возрасте (r = 0,53, p = 0,0001), а эпиактивность на ЭЭГ регистрировалась билатерально (r = 0,7, p < 0,0001), отмечалось повышение средней амплитуды тета-ритма (r = 0,58, p = 0,0003).
Снижение представленности трактов в наружных отделах полушарий мозга коррелировало с типом дебюта эпилепсии: для начала заболевания в виде генерализованного тонико–клонического приступа было характерно билатеральное «обеднение» трактов, для фокального начала — монолатеральное снижение представленности проводников (r = 0,42, p = 0,03).
Отсутствие передней и/или задней комиссур больших полушарий коррелировало с латентным периодом когнитивного потенциала Р300 (r = 0,39, p = 0,029). Сопоставление результатов 1Н-МРС с данными диффузионной тензорной МРТ показало взаимосвязь низких значений NAA/(Cho + Cr) в наружных отделах височных долей с отсутствием визуализации передней и/или задней комиссуры мозга (r = 0,8, p = 0,009), что определяет значимость нормального состояния проводников белого вещества мозга для достаточного функционирования кортикальных отделов.
Таким образом, целостность передней и задней комиссур мозга взаимосвязана с когнитивными функциями.
Выявлена корреляционная связь между результатами тестирования по шкале Бека и патологическим снижением значений ФА (r = 0,11, p < 0,05) и повышением СДС (r = –0,2, p < 0,01). Латентный период Р300 коррелировал с показателями ФА лобной доли эпилептогенного полушария (r = 0,23, p < 0,001). Сочетание кластера обеднения трактографической картины в лобных отделах и кластера снижения визуализации комиссур мозга является наиболее неблагоприятным в отношении развития когнитивных и психоэмоциональных нарушений при эпилепсии (рис. 1).
/12/12.jpg)
Значения теста Спилбергера — Ханина как для личностной, так и для ситуативной тревожности имели сильную отрицательную связь с параметрами NAA/(Cho + Cr) в наружных отделах височной доли на стороне эпилептического очага (r > –0,7, p < 0,03) (рис. 2). Соотношение NAA/(Cho + Cr) в гиппокампе на стороне очага коррелировало с амплитудой основного пика N2-P3 когнитивного вызванного потенциала Р300 (r = 0,67, p = 0,047).
Корреляционный анализ показателей диффузионной тензорной МРТ и результатов электроэнцефалографии. Изучение особенностей ЭЭГ-картины и значений ФА показало наличие корреляционной связи между наличием эпилептической активности и снижением ФА (r = 0,7, t = 2,44, p = 0,01). Нормальные значения амплитуды, частоты и индекса альфа-ритма были характерны для пациентов с неизмененными параметрами ФА (p < 0,05). Инверсия альфа-ритма (r = 0,44, t = 3,12, p = 0,0033) и повышение индекса тета-ритма сопровождались снижением значений ФА (r = 0,32, t = 2,15, p = 0,038). Следует отметить, что появление вспышек тета-ритма не имело корреляционной связи ни с одним из показателей диффузионной тензорной МРТ. Определение положительной корреляции фокусирования тета-ритма и нормальных значений ФА (r = 0,27, p = 0,00001) позволяет предположить, что обнаружение данного ЭЭГ-феномена характерно для относительно сохранных структур мозга, имеющих потенциальную возможность эффективного включения ингибиторных механизмов.
Таким образом, в группе пациентов с эпилепсией, в отличие от контрольной, обнаружено наличие дискретных регионов аномально измененного белого вещества мозга, при этом патологические изменения локализовались не только в эпилептогенном, но и в противоположном полушарии.
Обсуждение результатов
Из характеристик ДТ МРТ для выявления структурных повреждений более специфичным оказалось значение ФА, а для определения прогноза течения заболевания — СДС и «обеднение» картины трактов в наружных отделах височных долей, особенно при феномене контралатеральной гиппокампальной деафферентации. Регионы белого вещества с патологическими показателями ФА и СДС соответствовали не только зонам измененных трактов лимбического круга, но и зонам внутри- и межполушарных связей, объединяющих лобные, височные, теменные и затылочные доли мозга.
Состояние целостности комиссур мозга обеспечивает стабильность когнитивного и эмоционального статуса пациента. Среди характеристик ментальных функций наиболее чувствительным к изменениям интеграции белого вещества мозга оказался латентный период Р300, что, вероятно, является следствием нарушения межполушарного интегрального взаимодействия, обеспечиваемого сохранностью мозолистого тела. Патологические изменения ЭЭГ-картины при эпилепсии во многом обусловлены нарушением интеграции трактов мозга. Проведение диффузионной тензорной МРТ с трактографией позволяет расширить представления о микроструктурных изменениях целостности серого и белого вещества при эпилепсии и уточнить этиологический структурно-метаболический подтип данного заболевания согласно рекомендациям Международной противоэпилептической лиги [9]. Полученные результаты показали, что эпилепсия характеризуется разнообразными изменениями проводников белого вещества мозга, которые приводят к разобщению отдельных регионов мозга, что, в свою очередь, обусловливает дальнейшее нарушение связей между кортикальными и субкортикальными отделами и изменяет передачу информации. В частности, отсутствие передней и/или задней комиссур мозга при трактографии является предиктором развития в последующем клинически значимых когнитивных нарушений.
Выводы
Диффузионная тензорная магнитно-резонансная томография является информативным методом в определении структурных поражений мозга у пациентов с эпилепсией. Использование данного метода позволило выявить наличие структурных поражений у всех обследованных нами пациентов, а также дать количественную оценку фракционной анизотропии и средней диффузионной способности структур белого вещества, вовлекаемого в эпилептический процесс. Выделение специфических кластеров поражения трактов мозга при эпилепсии важно для определения прогноза течения заболевания и вероятной возможности возникновения когнитивных нарушений. Обеднение визуализации или отсутствие передней и/или задней комиссур мозга при ДТИ-трактографии является предиктором развития в последующем клинически значимых когнитивных нарушений.
Психоэмоциональные нарушения при эпилепсии, согласно полученным нами результатам, ассоциированы с нейрометаболическими нарушениями в наружных отделах височных долей мозга. Снижение амплитуды основного пика Р300, являющейся объективной характеристикой процессов внимания, взаимосвязано с процессами нарушения метаболизма в гиппокампальных структурах.
Сочетание кластера обеднения трактографической картины в лобных отделах и кластера снижения визуализации комиссур мозга является наиболее неблагоприятным в отношении развития когнитивных и психоэмоциональных нарушений при эпилепсии.
Современные методы нейровизуализации открывают возможность для патогенетической диагностики, дополняя клинические критерии течения эпилепсии.
1. Зенков Л.Р. Непароксизмальные эпилептические расстройства: Руководство для врачей / Л.Р. Зенков. — М.: МЕДпресс-информ, 2013. — 279 с.
2. Кистень О.В. Транскраниальная магнитная стимуляция в эпилептологии / О.В. Кистень, В.В. Евстигнеев. — Вильнюс: Grafija, 2013. — 368 с.
3. Комплексная медико-психологическая диагностика и реабилитация больных, страдающих эпилепсией: Методические рекомендации / С.А. Громов Л.В. Липатова, О.Н. Якунина, М.Я. Киссин. — СПб.: СПб. НИПНИ им. В.М. Бехтерева, 2012. — 20 с.
4. Dudra-Jastrzebska M. Mood disorders in patients with epilepsy / M. Dudra-Jastrzebska et al. // Pharmacological reports. — 2007. — Vol. 59. — Р. 369–378.
5. Hersdorffer D.C. Psychopatology and Epilepsy: Is It the Chicken or the Egg? / D.C. Hersdorffer et al. // Epilepsy Currents. — 2006. — Vol. 6, № 5. — Р. 147–149.
6. Kanner A.M. Depression and Epilepsy: A New Perspective on Two Closely Related Disorders / A.M. Kanner // Epilepsy Currents. — 2006. — Vol. 6, № 5. — Р. 141–146.
7. Kimiskidis V.K. Depression and anxiety in epilepsy: the association with demographic and seizure-related variables / V.K. Kimiskidis et al. // Annals of General Psychiatry. — 2007. — Vol. 6. — Р. 28.
8. Lambert M.V. Depression in Epilepsy: Etiology, Phenomenology and Treatment / M.V. Lambert, M.M. Robertson // Epilepsia. — 1999. — Vol. 40, Suppl. 10. — Р. 21–47.
9. Revised terminology and concepts for organization of seizures and epilepsies: Report of the ILAE Commission on Classification and Terminology, 2005–2009 / A.T. Berg, S.F. Berkovic, M.J. Brodie, J. Buchhalter // Epilepsia. — 2010. — Vol. 51, № 4. — P. 676–685.

/12/12_2.jpg)