Международный неврологический журнал 7 (69) 2014
Вернуться к номеру
Взаимоотношения новых биомаркеров высокого риска развития цереброваскулярной патологии и тяжести неврологического дефицита в остром периоде ишемического инсульта
Авторы: Филимонов Д.А. — Донецкий национальный медицинский университет им. М. Горького
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Исследования последних лет достоверно показали возрастающее значение в развитии ишемических инсультов новых факторов риска, таких как высокие уровни гомоцистеина, С-реактивного белка, наличие маркеров тромбофилии. Однако сведения о взаимоотношении данных биомаркеров в остром периоде ишемического инсульта, особенно у лиц молодого возраста, ограничены. Целью настоящего исследования было определение влияния биомаркеров высокого риска развития инсульта (активность антитромбина III, аденозиндифосфатиндуцированная агрегация тромбоцитов, фибриноген, гомоцистеин, С-реактивный белок) на тяжесть неврологического дефицита у пациентов в остром периоде ишемического инсульта. Установлено, что в исследуемой группе пациентов на тяжесть неврологического дефицита влияли уровни фибриногена (p = 0,031), С-реактивного белка (p = 0,045), низкая активность антитромбина III (p = 0,039). При этом в подгруппе пациентов до 50 лет обнаружено статистически значимое влияние уровней гомоцистеина (p = 0,013) и АДФ-агрегации тромбоцитов (p = 0,028) на тяжесть инсульта. Проведенное исследование показало, что влияние биомаркеров на тяжесть ишемического инсульта имеет возрастные особенности, при этом в молодом возрасте наибольшим значением обладает гипергомоцистеинемия.
Дослідження останніх років вірогідно показали зростаюче значення у розвитку ішемічних інсультів нових факторів ризику, таких як високі рівні гомоцистеїну, С-реактивного білка, наявність маркерів тромбофілії. Однак відомості про взаємовідносини даних біомаркерів у гострому періоді ішемічного інсульту, особливо в осіб молодого віку, обмежені. Метою цього дослідження було визначення впливу біомаркерів високого ризику розвитку інсульту (активність антитромбіну III, аденозиндифосфатіндукована агрегація тромбоцитів, фібриноген, гомоцистеїн, С-реактивний білок) на тяжкість неврологічного дефіциту у пацієнтів у гострому періоді ішемічного інсульту. Встановлено, що в досліджуваній групі пацієнтів на тяжкість неврологічного дефіциту впливали рівні фібриногену (p = 0,031), С-реактивного білка (p = 0,045), низька активність антитромбіну III (p = 0,039). При цьому в підгрупі пацієнтів до 50 років виявлено статистично значущий вплив рівнів гомоцистеїну (p = 0,013) і АДФ-агрегації тромбоцитів (p = 0,028) на тяжкість інсульту. Проведене дослідження показало, що вплив біомаркерів на тяжкість ішемічного інсульту має вікові особливості, при цьому в молодому віці найбільше значення має гіпергомоцистеїнемія.
Recent studies have shown significantly increasing importance of new risk factors such as high levels of homocysteine and C-reactive protein, the presence of thrombophilia markers in the development of ischemic stroke. However, information of their relationship in acute ischemic stroke, especially in young patients is limited. The purpose of this study was to determine the impact of stroke high-risk biomarkers (activity of antithrombin III, ADP-induced platelet aggregation, fibrinogen, homocysteine, C-reactive protein) on neurological deficit in patients with acute ischemic stroke. It was found that the severity of neurological deficit correlated with fibrinogen levels (p = 0.031), C-reactive protein (p = 0.045) and low activity of antithrombin III (p = 0.039). In the subgroup of patients under 50 years a statistically significant effect of homocysteine level (p = 0.013) and ADP-platelet aggregation (p = 0.028) on the stroke severity was revealed. The study showed that the impact of biomarkers on the ischemic stroke severity is age-dependent, while at young age hyperhomocysteinemia is of great importance.
факторы риска, тяжесть ишемического инсульта.
фактори ризику, тяжкість ішемічного інсульту.
risk factors, ischemic stroke severity.
Статья опубликована на с. 37-41
Одной из наиболее значимых проблем отечественной и мировой неврологии по-прежнему остается высокая заболеваемость и смертность в результате инсульта. По данным многочисленных эпидемиологических исследований последних лет, в мире инсульт занимает одно из ведущих мест в структуре смертности, а в ряде стран Центральной и Восточной Европы данные показатели ухудшаются. К сожалению, и в будущем прогнозируется дальнейший рост летальности от инсульта [16].
Но особо значимой медицинской и социальной проблемой является рост заболеваемости инсультом у лиц молодого возраста. По сообщениям ряда авторов, в США и странах Западной Европы заболеваемость инсультом у лиц молодого возраста значительно выше, чем считалось ранее. При этом примерно у трети пациентов окончательно установить причину развития инсульта не представляется возможным [6].
Сегодня не вызывает сомнения, что коррекция факторов риска является наиболее эффективной мерой борьбы с высокой заболеваемостью и смертностью от инсульта. Начиная с середины прошлого века был проведен ряд крупномасштабных популяционных проспективных исследований, которые позволили идентифицировать базисные факторы риска, имеющие наибольшее значение в развитии инсультов. Сегодня к таким факторам относят возраст, артериальную гипертензию, каротидный стеноз, дислипидемию, сахарный диабет, нарушения ритма сердца, гиподинамию, курение и др. [14]. Данные современных исследований неоднократно подтвердили значимость этих факторов, и сегодня с их влиянием возможно связать до 75 % всех случаев инсульта [12]. Коррекция этих факторов также способствовала уменьшению дальнейшего распространения цереброваскулярной патологии. По данным исследования Всемирной организации здравоохранения MONICA, в европейских странах снижение смертности от ишемической болезни сердца на 2/3 обусловлено именно коррекцией базисных факторов риска и лишь на 1/3 — совершенствованием терапевтических подходов [9]. Имеется мнение, что без коррекции базисных факторов заболеваемость цереброваскулярными болезнями в странах Европы была бы существенно выше. Это свидетельствует о том, что сегодня базисные факторы риска не потеряли свою актуальность и их своевременная коррекция продолжает быть эффективной, особенно у лиц старшего возраста.
Тем не менее проблема факторов риска цереброваскулярных заболеваний, особенно у лиц молодого возраста, остается окончательно не изученной. С широким внедрением понятия «гетерогенность ишемического инсульта» расширились представления и о роли факторов риска в развитии определенных подтипов инсульта [5]. Крупномасштабное исследование MONICA, проведенное в 21 стране мира, показало, что действием лишь общеизвестных базисных факторов риска невозможно полностью объяснить развитие инсультов, особенно в молодом возрасте [9]. Другой важной проблемой является возрастающая роль «немых» инсультов, выявление которых начиная с детского возраста значительно улучшилось благодаря совершенствованию нейровизуализационных методов диагностики, но этиологическая их трактовка по-прежнему крайне затруднена. А ведь именно «немые» инсульты является предиктором последующих нарушений мозгового кровообращения с формированием стойкого неврологического дефицита, кроме того, они имеют важное клиническое значение как маркер возможного наличия болезней мелких сосудов, метаболических нарушений (сахарный диабет, MELAS-синдром, CADASIL и др.), кардиоэмболии, асимптомного каротидного стеноза [15, 17]. Согласно проведенным исследованиям, их распространенность в 5 раз выше, чем клинически манифестирующих. Вместе с тем вопрос факторов риска «немых» инсультов остается крайне актуальным [17].
Сегодня уже не вызывает сомнения, что наличием лишь общеизвестных факторов риска нельзя объяснить весь спектр цереброваскулярной патологии, особенно у лиц молодого возраста и детей [1, 3]. С другой стороны, необходимость поиска новых факторов риска очевидна, так как коррекция лишь уже изученных, базисных факторов согласно проведенным исследованиям не имеет достаточной профилактической эффективности. В течение последних десятилетий предложено более 50 новых потенциальных факторов риска развития инсультов, однако значимость большинства из них к настоящему времени полностью не доказана. Сегодня все же можно выделить ряд факторов риска, обладающих наибольшим потенциалом и доказательной базой [7]. К таким факторам относят генетическую предрасположенность (полиморфизм гена АПФ, фактор V Лейден, полиморфизм гена MTHFR), аномалии церебральных сосудов и интрацеребральный атеросклероз, врожденные и приобретенные коагулопатии, инфекционные факторы, болезни мелких сосудов, нарушение метаболизма (гипергомоцистеинемия) и др.
Тем не менее широкий спектр факторов, способных привести к развитию инсульта, вызывает объективные затруднения у практикующего врача при их идентификации у конкретного пациента. Проблема осложняется и тем, что многие из заболеваний, потенциально ведущих к развитию инсульта, на стадии, когда еще возможна их терапевтическая коррекция, протекают асимптомно. Данный факт подтверждается все более широким использованием в мировой неврологии такого понятия, как «субклиническая болезнь» [4]. Цереброваскулярная субклиническая болезнь представляет собой наличие неспецифических положительных функциональных или лабораторных маркеров высокого риска развития инсульта или инфаркта миокарда при отсутствии каких-либо клинический проявлений цереброваскулярной болезни.
В течение последних десятилетий предложено более 75 различных биомаркеров высокого риска инсульта, обладающих различной доказательной базой. Ряд исследований показывает, что биомаркерами с высокой чувствительностью по отношению к риску развития инсульта являются С-реактивный белок (СРБ), фибриноген, агрегация тромбоцитов с аденозиндифосфатом (АДФ) [4, 8, 10]. По данным ряда авторов, в том числе согласно нашим исследованиям, гомоцистеин и активность антитромбина III также являются предикторами развития инсульта, особенно у лиц молодого возраста [2, 10]. Имеются сведения, что данные биомаркеры связаны с развитием эндотелиальной дисфункции и коагулопатии, однако окончательно не установлено, являются ли они звеном патогенеза цереброваскулярной патологии и, следовательно, нуждаются ли в терапевтической коррекции [13].
Другой важной проблемой является отсутствие достаточного количества сведений о взаимоотношении данных маркеров в остром периоде инсульта. Окончательно не известно, коррелирует ли их активность с тяжестью неврологического дефицита при ишемическом инсульте. Это и послужило основанием для проведения настоящего исследования.
Цель работы: определение влияния биомаркеров высокого риска развития инсульта (активность антитромбина III, аденозиндифосфатиндуцированная агрегация тромбоцитов, фибриноген, гомоцистеин, С-реактивный белок) на тяжесть неврологического дефицита у пациентов в остром периоде ишемического инсульта.
Материалы и методы
В отделении ангионеврологии Института неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины мы наблюдали 35 пациентов (в возрасте от 21 до 74 лет, 17 женщин и 18 мужчин) с верифицированным ишемическим инсультом в остром периоде. Контрольную группу составили 12 относительно здоровых добровольцев без цереброваскулярной патологии.
Всем пациентам проведен тщательный неврологический осмотр с применением шкалы NIHSS. Дополнительные методы обследования включали магнитно-резонансную томографию головного мозга с магнитно-резонансной ангиографией, триплексное сканирование магистральных артерий головы. Особое внимание уделялось ультразвуковому исследованию сердца (эхокардиография). При наличии показаний выполнялось холтеровское мониторирование электрокардиограммы.
Помимо общеклинических анализов, развернутой липидограммы проводили иммуноферментный анализ уровня гомоцистеина плазмы (иммунохимический анализатор Abbott Architect i2000 с хемилюминесцентной технологией Chemiflex). Также выполнялась развернутая коагулограмма, включавшая оценку аденозиндифосфатиндуцированной агрегации (АДФ-АГ) тромбоцитов (в качестве индуктора агрегации применяли 2,5 мкМ аденозиндифосфата), фибриногена, активности антитромбина III (АТ-III). Исследования гемостаза выполняли на автоматическом коагулометре Humaclot DUO, с использованием реагентов фирмы Instrumentation Laboratory (США). Мониторинг показателей гомоцистеина и системы гемостаза проводили в первые, седьмые и двадцать восьмые сутки.
Результаты обрабатывали статистически с применением программного пакета MedCalc. Для оценки влияния факторов риска на тяжесть ишемического инсульта применялся множественный регрессионный анализ. С учетом небольшого объема выборки для оценки различий между исследуемыми группами применялись непараметрические тесты с расчетом U-критерия Манна — Уитни.
Результаты
После проведенного клинико-неврологического обследования 35 больных установлено, что у 16 пациентов ишемический очаг локализовался в левом полушарии, у 14 пациентов — в правом и у 5 пациентов — в бассейне основной артерии. Ведущими клинико-неврологическими синдромами были выраженный или глубокий гемипарез, вестибуло-атактический синдром, речевые расстройства, бульбарный синдром. Средние показатели по шкале NIHSS составили 7,43 ± 1,03 балла (95% ДИ 5,2–9,6). Выявленные при обследовании больных факторы риска развития инсульта представлены в табл. 1.
/39/39.jpg)
При проведении комплексного клинико-неврологического обследования установлено, что у 19 пациентов развился тромботический подтип ишемического инсульта, у 7 пациентов — гемодинамический подтип, у 5 — кардиоэмболический подтип, у 4 пациентов этиологию инсульта установить не удалось.
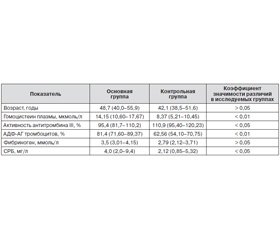
Анализ биомаркеров высокого риска развития инсульта показал, что уровень гомоцистеина, СРБ, фибриногена, АДФ-агрегации тромбоцитов и активность антитромбина III у больных в остром периоде ишемического инсульта статистически значимо отличались от соответствующих показателей в контрольной группе. Полученные данные представлены в табл. 2.
Для оценки влияния изучаемых биомаркеров на тяжесть неврологического дефицита применялся множественный регрессионный анализ. Установлено, что в основной группе факторами, влияющими на тяжесть неврологического дефицита, были возраст, уровень фибриногена и СРБ (табл. 3).
Уровень гомоцистеина и АДФ-агрегации тромбоцитов статистически значимо не влиял на тяжесть неврологического дефицита в основной группе, что соответствует данным ряда авторов [11]. Однако учитывая полученные ранее сведения, что нарушение обмена гомоцистеина ассоциируется с развитием инсульта преимущественно в молодом возрасте, был проведен повторный регрессионный анализ, в который были включены пациенты из основной группы возрастом не старше 50 лет.
Статистический анализ показал, что в подгруппе пациентов молодого возраста на тяжесть неврологического дефицита влияют уровни гомоцистеина, СРБ, антитромбина III, АДФ-агрегации тромбоцитов, в то время как возраст и уровень фибриногена не оказывали существенного влияния на тяжесть неврологического дефицита (табл. 4).
При проведении корреляционного анализа установлена взаимосвязь между тяжестью неврологического дефицита по шкале NIHSS и уровнем гомоцистеина (коэффициент Пирсона r = 0,727; p = 0,0428).
Полученные в ходе статистического анализа данные свидетельствуют о том, что биомаркеры высокого риска развития цереброваскулярной патологии в молодом возрасте влияют на тяжесть ишемического инсульта у молодых лиц, что необходимо учитывать при выборе тактики лечения и определении прогноза.
Все пациенты из основной группы получали терапию согласно общепринятым протоколам. Больным с выявленной гипергомоцистеинемией дополнительно назначались препараты, содержащие витамины группы В и фолиевую кислоту, также им была рекомендована специальная диета. Показатели активности системы гемостаза, такие как антитромбин III и АДФ-агрегация тромбоцитов, использовались при подборе индивидуальной схемы антиагрегантной терапии.
Выводы
Проведенное исследование показало, что такие маркеры высокого риска развития инсульта, как активность антитромбина III, АДФ-агрегация тромбоцитов, уровни СРБ, фибриногена и гомоцистеина, влияют на тяжесть неврологического дефицита в остром периоде ишемического инсульта, однако для гомоцистеина и АДФ-агрегации тромбоцитов эта взаимосвязь прослеживается только у пациентов молодого возраста. Полученные данные свидетельствуют о том, что предикторы риска развития инсульта и его тяжести имеют возрастные особенности. В молодом возрасте для оценки риска формирования цереброваскулярной патологии и ее тяжести целесообразно использовать такие относительно новые биомаркеры, как гомоцистеин, активность антитромбина III, показатели агрегационной способности тромбоцитов, С-реактивный белок и др. Подобный подход позволяет сформировать индивидуальную схему профилактики цереброваскулярной патологии начиная с молодого возраста, что в дальнейшем будет способствовать повышению ее эффективности.
1. Евтушенко С.К. Гетерогенный ишемический инсульт у детей / С.К. Евтушенко // Новости медицины и фармации. — 2010. — № 370. — С. 56–61.
2. Филимонов Д.А. Гипергомоцистеинемия как прокоагулянтный фактор риска у пациентов с атеротромботическим ишемическим инсультом и возможности лечебной коррекции / Д.А. Филимонов // Нейронауки: теоретичні та клінічні аспекти. — 2012. — Т. 2, № 8. — С. 204–208.
3. Brobeck B.R. Pediatric stroke: The child is not merely a small adult // Neuroimaging Clin. N. Am. — 2005. — Vol. 15. — Р. 589–607.
4. Dadu R.T. Cardiovascular biomarkers and subclinical brain disease in the atherosclerosis risk in communities study / R.T. Dadu, M. Fornage, S.S. Virani, V. Nambi, R.C. Hoogeveen, E. Boerwinkle, A. Alonso, R.F. Gottesman, T.H. Mosley, C.M. Ballantyne // Stroke. — 2013. — Vol. 44. — Р. 1803–1808.
5. Grau A.J. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank / A.J. Grau, C. Weimar, F. Buggle, A. Heinrich, M. Goertler, S. Neumaier, J. Glahn, T. Brandt, W. Hacke, H.C. Diener // Stroke. — 2001. — Vol. 32. — Р. 2559–2566.
6. Guercini F. Cryptogenic stroke: time to determine aetiology / F. Guercini, M. Acciarresi // J. Thromb. Haemost. — 2008. — Vol. 6. — Р. 549–554.
7. Hankey G.J. Potential new risk factors for ischemic stroke: what is their potential? / G.J. Hankey // Stroke. — 2006. — Vol. 37. — Р. 2181–2188.
8. Kernagis D.N. Evolving role of biomarkers in acute cerebrovascular disease / D.N. Kernagis, D.T. Laskowitz // Ann. Neurol. — 2012. — Vol. 71, № 3. — Р. 289–303.
9. Luepker R.V. WHO MONICA project: what have we learned and where to go from here? / R.V. Luepker // Public Health Rev. — 2011. — № 4. — Р. 33.
10. Meng R. Antithrombin III associated with fibrinogen predicts the risk of cerebral ischemic stroke / R. Meng, Z.Y. Li, X. Ji, Y. Ding, S. Meng, X. Wang // Clin. Neurol. Neurosurg. — 2011. — Vol. 113. — Р. 380–386.
11. Perini F. Elevated plasma homocysteine in acute stroke was not associated with severity and outcome: Stronger association with small artery disease / F. Perini, E. Galloni, I. Bolgan, G. Bader, R. Ruffini, E. Arzenton, S. Alba, C. Azzini, L. Bartolomei, G. Billo, F. Bortolon, P. Dudine, P.G. Garofalo, R. L’Erario, M. Morra, P. Parisen, G. Stenta, V. Toso // Neurol. Sci. — 2005. — Vol. 26. — Р. 310–318.
12. Romero J.R. Stroke prevention: modifying risk factors / J.R. Romero, J. Morris, A. Pikula // Ther. Adv. Cardiovasc. Dis. — 2008. — Vol. 2. — Р. 287–303.
13. Roquer J. Endothelial dysfunction, vascular disease and stroke: The ARTICO study, 2009. — Р. 25–37.
14. Rundek T. Risk Factor Management to Prevent First Stroke // Neurol. Clin. — 2008. — Vol. 26. — Р. 1007–1045.
15. Saini M. Silent stroke: Not listened to rather than silent / M. Saini, K. Ikram, S. Hilal, A. Qiu, N. Venketasubramanian, C. Chen // Stroke. — 2012. — Vol. 43. — Р. 3102–3104.
16. Scarborough P. Stroke statistics 2009 edition // British heart foundation [Электронный ресурс]. — URL: http://www.bhf.org.uk/publications/view-publication.aspx?ps=1001548.
17. Vermeer S.E. Silent brain infarcts: a systematic review // Lancet Neurol. — 2007. — Vol. 6. — Р. 611–619.

/40/40.jpg)