Международный неврологический журнал 8 (70) 2014
Вернуться к номеру
Поширеність судинних факторів ризику в осіб із початковими проявами ішемії мозку
Авторы: Тріщинська М.А., Головченко Ю.І. - Національна медична академія післядипломної освіти імені П.Л. Шупика, кафедра неврології № 1
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Судинно-мозкова недостатність на початкових, доклінічних стадіях розвитку є найменш вивченим аспектом цереброваскулярної патології.
Мета дослідження полягає у виявлені частоти та взаємозв’язків основних судинних факторів ризику й порушення судинорухової функції ендотелію в осіб без клінічно значимих судинних подій (інфаркт міокарда чи інсульт) в анамнезі.
Матеріал та методи дослідження. Під нашим спостереженням перебували 295 осіб віком від 30 до 65 років, у середньому 50,70 ± 7,76 року (Me = 51, Q1 = 46; Q3 = 57). Серед обстежених хворих було 80 (27,1 %) чоловіків та 215 (72,9 %) жінок. Усім хворим було проведене загальноклінічне, клініко-неврологічне та клініко-інструментальне (у тому числі нейровізуалізація) обстеження з метою встановлення форми та стадії судинно-мозкової патології. У пацієнтів визначалися основні фактори серцево-судинного ризику: артеріальна гіпертензія, паління, дисліпідемія, цукровий діабет або порушення толерантності до глюкози, надмірна вага. Судинорухову функцію ендотелію визначали за концентрацією стійкого метаболіту оксиду азоту — нітриту (мкмоль/л) та ендотеліну-1 (нг/мл).
Результати та їх обговорення. Серед обстежених пацієнтів найбільш поширеними факторами ризику серцево-судинних захворювань є артеріальна гіпертензія (65,8 %) та надмірна маса тіла (47,1 %). У результаті дослідження було виявлено, що існує зв’язок між клінічною вираженістю цереброваскулярної патології та факторами ризику (χ2(3) Пірсона; критерій V Крамера): артеріальною гіпертензією (112,612, р < 0,001; 0,618, р < 0,001), цукровим діабетом/порушенням толерантності до глюкози (14,683, р = 0,002; 0,223, р = 0,002;), надмірною вагою (32,881, р < 0,0001; 0,343, р < 0,0001). Зв’язок між діагнозом та фактом паління (6,855, р = 0,077; 0,152, р = 0,077) або дисліпідемією (5,904, р = 0,116; 0,202, р = 0,116) не мав статистичної значимості. З такими факторами ризику, як цукровий діабет та надмірна маса тіла, відзначався зв’язок середнього ступеня, а з артеріальною гіпертензією — дуже сильний зв’язок. Пацієнтів з артеріальною гіпертензією було вірогідно менше серед осіб із вегетосудинною дистонією (5,7 %/53), найбільше їх було серед хворих із дисциркуляторною енцефалопатією ІІ стадії (90,3 %/31). Аналогічна ситуація спостерігалася й за поширеністю надмірної маси тіла (22,6 %/53 та 80,6 %/31 відповідно). Був виявлений зв’язок між кількістю факторів ризику й віком пацієнтів (χ2(10) = 29,226, р = 0,001; V Крамера = 0,223, р = 0,001). Виявлено, що рівень нітриту вірогідно знижувався при прогресуванні захворювання, а рівень ендотеліну-1 — підвищувався. Був виявлений кореляційний зв’язок (за коефіцієнтом Спірмена) між концентрацією нітриту та кількістю факторів ризику (–0,262, р = 0,002); між концентрацію ендотеліну-1 та кількістю факторів ризику (0,288, р = 0,002).
Висновки. Встановлені зв’язки між факторами ризику й біохімічними маркерами ендотеліальної судинорухової функції та їх характер свідчать про важлість своєчасного виявлення та корекції судинних факторів ризику з метою профілактики судинних захворювань головного мозку.
Сосудисто-мозговая недостаточность на начальных, доклинических стадиях своего развития является наименее изученным аспектом цереброваскулярной патологии.
Цель исследования состоит в выявлении частоты встречаемости сосудисто-мозговой недостаточности и установлении связей между основными сосудистыми факторами риска и нарушением сосудодвигательной функции эндотелия у лиц без клинически значимых сосудистых событий в анамнезе.
Материал и методы исследования. Под нашим наблюдением находилось 295 человек в возрасте от 30 до 65 лет (Me = 51, Q1 = 46; Q3 = 57). Среди обследованных больных было 80 (27,1 %) мужчин и 215 (72,9 %) женщин. Всем пациентам проводилось общеклиническое, клинико-неврологическое и клинико-инструментальное обследование с целью установления формы и стадии сосудисто-мозговой патологии. У пациентов определялись основные факторы риска: артериальная гипертензия, курение, дислипидемия, сахарный диабет или нарушение толерантности к глюкозе, повышенная масса тела. Сосудодвигательную функцию определяли по концентрации стойкого метаболита оксида азота — нитрита (мкмоль/л) и эндотелина-1 (нг/мл).
Результаты и их обсуждение. Среди обследованных пациентов наиболее распространенными факторами риска сердечно-сосудистых заболеваний были АГ (65,8 %) и повышенная масса тела (47,1 %/295). В результате исследования было выявлено, что существует связь между клинической выраженностью цереброваскулярной патологии и факторами риска (χ2(3) Пирсона; критерий V Крамера): артериальной гипертензией (112,612, р < 0,001; 0,618, р < 0,001); сахарным диабетом/нарушением толерантности к глюкозе (14,683, р = 0,002; 0,223, р = 0,002); повышенной массой тела (32,881, р < 0,0001; 0,343,
р < 0,0001). Связь между диагнозом и фактом курения (6,855, р = 0,077; 0,152, р = 0,077) или дислипидемией (5,904, р = 0,116; 0,202, р = 0,116) не имела статистической значимости. С такими факторами риска, как сахарный диабет и повышенная масса тела, отмечалась связь средней степени, а с артериальной гипертензией — очень сильная связь. Пациентов с артериальной гипертензией было достоверно меньше среди лиц с вегетососудистой дистонией (5,7 %/53), больше всего их было среди больных с дисциркуляторной энцефалопатией ІІ стадии (90,3 %/31). Аналогичная ситуация наблюдалась относительно распространенности повышенной массы тела (22,6 %/53 и 80,6 %/31 соответственно). Была выявлена связь между количеством факторов риска и возрастом пациентов (χ2(10) = 29,226, р = 0,001; V Крамера = 0,223, р = 0,001). Выявлено, что уровень нитрита достоверно снижался по мере прогрессирования заболевания, а уровень эндотелина-1 — повышался. Была установлена корреляционная связь (согласно коэффициенту Спирмена) между концентрацией нитрита и количеством факторов риска (–0,262, р = 0,002); между концентрацией эндотелина-1 и количеством факторов риска (0,288, р = 0,002).
Выводы. Установленные связи между факторами риска и биохимическими маркерами сосудодвигательной функции эндотелия и их характер свидетельствуют о важности своевременного выявления и коррекции сосудистых факторов риска с целью профилактики сосудистых заболеваний головного мозга.
Cerebrovascular insufficiency on the early pre-clinical stages of development is the least studied aspects of cerebrovascular pathology.
The purpose of the study is to identify the incidence and establish correlation between the main cardiovascular risk factors and impaired vasomotor endothelial function in patients without clinically significant cardiovascular events (heart attack and stroke) in history.
Material and methods. Under our supervision there were 295 people aged from 30 to 65 years old, mean age was 50.70 ± 7.76 years old (Me = 51, Q1 = 46; Q3 = 57). Among the patients there were 80 (27.1 %) males and 215 (72.9 %) females. All patients were undergone general clinical, neurological and instrumental examination to determine the extent and stage of cerebrovascular pathology. There were identified the main risk factors in patients, namely hypertension (AH), smoking, dyslipidemia, diabetes mellitus (DM) and impaired glucose tolerance, increased body weight. Vasomotor function of endothelium was determined by the concentration of stable metabolite of nitric oxide — nitrite (mmol/l) and endothelin-1 (ng/ml).
The results. Among the patients the most common risk factors for cardiovascular diseases were hypertension (65.8 %) and increased body weight (47.1 %). The study found that there is a relationship between risk factors and clinical severity of cerebrovascular disease (χ2(3) Pearson; Cramer V criterion): AH (112.612, p < 0.001; 0.618, p < 0.001); DM/impaired glucose tolerance (14.683, p = 0.002; 0.223, p = 0.002); increased body weight (32.881, p < 0.0001; 0.343, p < 0.0001). The correlation between diagnosis and smoking (6.855, р = 0.077; 0.152, р = 0.077) or with dyslipidemia (5.904, р = 0.116; 0.202, р = 0.116) was not statistically significant. Risk factors such as DM and increased body weight had an average degree of correlation, and hypertension had a very strong relationship. Among patients with hypertension there were significantly less people with vascular dystonia (5.7 %/53); mainly hypertension occurred in patients with circulatory encephalopathy II (90.3 %/31). A similar situation was observed regarding to the prevalence of overweight (22.6 %/53 and 80.6 % /31, respectively). There was an association between the number of risk factors and the age of a patient (χ2(10) = 29.226, p = 0.001; V Cramer = 0.223, p = 0.001). The disease deterioration was associated with significantly decreased level of nitrite and the increased level of endothelin-1. There was established the correlation (according to Spearman coefficient) between nitrite concentration and the number of risk factors (–0,262, p = 0.002); between endothelin-1 concentration and the number of risk factors (0.288, p = 0.002).
Conclusions. Correlation between risk factors and biochemical markers of endothelial vasomotor function shows the importance of the timely identification and correction of vascular risk factors for the prevention of brain vascular diseases.
початкові стадії судинно-мозкової недостатності, ендотеліальна дисфункція, серцево-судинні фактори ризику.
начальные стадии сосудисто-мозговой недостаточности, эндотелиальная дисфункция, факторы риска.
the initial stages of cerebrovascular insufficiency, endothelial dysfunction, cardiovascular risk factors.
Статья опубликована на с. 31-39
Цереброваскулярна захворюваність є однією із найбільш актуальних проблем сучасної медицини, оскільки посідає одну з перших позицій у структурі смертності населення в усьому світі та є основною причиною івалідизації, особливо у похилому віці. Сама назва — цереброваскулярна патологія — вказує на переважне ураження судин головного мозку. Одним із найбільш багатофункціональних елементів судинної стінки є її внутрішній шар. Ендотелій судин — це внутрішній високоспецифічний шар судинної стінки, метаболічно активний як щодо елементів крові, так і щодо тканин, що знаходяться під ним. Ендотелій відіграє життєво важливу роль у підтриманні судинного гомеостазу: регуляції тонусу судин, проліферації гладеньких м’язів стінки судин, трансендотеліальній міграції лейкоцитів, тромбозі та тромбоцитарному балансі. У відповідь на ряд механічних та хімічних стимулів ендотеліальні клітини синтезують та виділяють велику кількість сполук, факторів росту та інших біологічно активних речовин, що обумовлюють згадані вище функції. Слід зазначити, що речовини, які виділяють ендотеліоцити, мають різнонаправлену дію, внаслідок чого очікуваний ефект (тонус судин, ступінь проліферації клітин судинної стінки тощо) є результатом взаємодії між цими чинниками. Порушення синтезу або доступності тих чи інших речовин у ендотеліальних клітинах призводять до так званої ендотеліальної дисфункції. Іншими словами, ендотеліальну дисфункцію можна визначити як «частковий або повний дисбаланс між речовинами, що діють різнонаправлено (тобто вазодилататорами та вазоконстрикторами, стимуляторами та інгібіторами росту, протромботичними та антитромботичними факторами)». Ендотеліальна дисфункція сьогодні розглядається як ключова рання ознака початку атеросклеротичного процесу [7]. Крім того, дисфункція ендотелію може бути важливим чинником розвитку мікросудинних ускладнень при цукровому діабеті (ЦД) [11].
При ендотеліальній дисфункції як прояв порушення однієї із функцій спостерігається зниження біодоступності вазодилататорів, переважно оксиду азоту (NO), водночас підвищується концентрація вазоконстрикторів, що виділяються ендотелієм (перш за все ендотеліну–1) [6]. Ендотеліальна дисфункція, крім порушення ендотелій–залежної вазодилатації, проявляється специфічним станом «ендотеліальної активації», що характеризується прозапальними, проліферативними та прокоагулянтними умовами, які супроводжують усі стадії атеросклерозу. Зважаючи на взаємозв’язок між ендотеліальною дисфункцією та атеросклерозом, стан ендотеліальної функції може відображати індивідуальну схильність до розвитку атеросклерозу, іншими словами, наявність ендотеліальної дисфункції може бути маркером несприятливого серцево–судинного прогнозу [1].
Оскільки ендотелій займає стратегічну позицію як механічний та біологічний бар’єр між кров’ю та судинною стінкою, скоріше за все, ендотеліальна дисфункція і є «втраченою ланкою» між факторами ризику та їх ушкоджувальною дією [5]. Більшість факторів ризику, якщо не всі, що пов’язані із атеросклерозом і серцево–судинною захворюваністю та смертністю, асоціюються з ендотеліальною дисфункцією. Багато з цих факторів ризику, включаючи гіперліпідемію, артеріальну гіпертензію (АГ), цукровий діабет та куріння, асоціюються з гіперпродукцією високоактивних вільних радикалів та оксидативним стресом [2]. Реакція NO та вільних радикалів призводить до зниження біодоступності окису азоту та викликає ушкодження клітин. Таким чином, активізація оксидативного стресу вважається основним механізмом патогенезу ендотеліальної дисфункції й може бути універсальним патогенетичним механізмом впливу факторів ризику на ендотелій [8, 10, 12]. Ризик розвитку ендотеліальної дисфункції підвищується зі збільшенням числа факторів ризику в конкретної особи, хоча може й залежати від самого фактора ризику [3]. Беручи до уваги вищесказане, стан ендотеліальної функції можна вважати інтегральним показником впливу серцево–судинних факторів ризику та суми всіх вазопротективних механізмів у кожного окремого індивідуума [4]. Більш того, зважаючи на провідну роль у атерогенезі, ендотеліальна дисфункція може розглядатися як «кінцевий фактор ризику», що свідчить про реальну загрозу клінічно значущого ушкодження судин [1], яке перш за все асоціюється з порушенням перфузії органа чи тканини та розвитком серцево–судинних подій.
Сучасні дослідження підтверджують роль ендотелію в патогенезі артеріальної гіпертензії, зважаючи на важливу його роль у підтриманні судинного гомеостазу. Визнається, що ендотеліальна дисфункція виникає при АГ, незважаючи на етіологію (есенціальна або вторинна гіпертензія). Процес системного склерозу судин унаслідок АГ включає васкулопатію з ендотеліальною дисфункцією [9].
Оксид азоту регулює тонус гладеньких м’язів судин і таким чином бере участь у формуванні периферичного судинного опору — однієї зі складових системного артеріального тиску (АТ) (наряду із серцевим викидом). Зниження біодоступності NO вважається ключовим процесом, що обумовлює виникнення ендотеліальної дисфункції при АГ. У результаті дисбалансу протидіючих механізмів, спрямованих на підтримання судинного гомеостазу, виникає вазоконстрикція й порушення функції судин [13].
Зважаючи на наведені вище дані та той факт, що ендотеліальна дисфункція розглядається як початкова стадія патологічного процесу в судинах, нами було проведене дослідження, метою якого стало виявлення частоти зустрічаємості та встановлення взаємозв’язків основних судинних факторів ризику та ендотеліальної дисфункції в осіб без клінічно значимих судинних подій (інфаркт міокарда чи інсульт) в анамнезі.
Матеріал та методи дослідження
Під нашим спостереженням перебували 295 осіб віком від 30 до 65 років, у середньому 50,70 ± 7,76 року (Me = 51, Q1 = 46; Q3 = 57). Серед обстежених хворих було 80 (27,1 %) чоловіків та 215 (72,9 %) жінок. Усім хворим було проведене клініко–неврологічне та клініко–інструментальне (у тому числі нейровізуалізація) обстеження з метою встановлення стадії та форми судинно–мозкової патології. Клінічна форма хронічного ішемічного цереброваскулярного захворювання діагностувалася на основі критеріїв класифікації Інституту неврології АМН СССР (Шмидт Е.В., Максудов Г.А., 1971).
Діагноз АГ та ступінь встановлювалися відповідно до визначення Комітету експертів ВООЗ та рекомендацій Європейського товариства гіпертензії та Європейського товариства кардіології (ESH/ESC 2007, 2013 року) на основі анамнестичних даних та з урахуванням рівня АТ, який був отриманий при офісному вимірюванні та самовимірюванні в домашніх умовах. Для встановлення стадії АГ застосовувалася класифікація за ураженням органів–мішеній. Ця класифікація розроблена експертами ВООЗ (1963–1993) та прийнята в Україні в 1992 році згідно з наказом МОЗ України № 206 від 30.12.92 р., вона рекомендується до застосування згідно з наказом № 247 від 01.08.98 р. Діагноз формулювався із зазначенням стадії захворювання та характеру ураження. У разі встановлення діагнозу АГ ІІ стадії вказувалася причина, на підставі якої виставлялася стадія (гіпертрофія лівого шлуночка, ознаки ураження нирок — креатинін на верхній межі норми (115–133 ммоль/л у чоловіків, 107–124 ммоль/л у жінок) або наявність мікроальбумінурії (30–300 мг/добу); потовщення комплексу інтима–медіа (КІМ) ≥ 0,9 мм або наявність атеросклеротичної бляшки, генералізоване звуження артерій сітківки).
Усім хворим проводилося загальноклінічне обстеження. У дослідження не включали пацієнтів із тяжкою соматичною патологією, клінічно значимими судинними подіями та черепно–мозковою травмою в анамнезі. Клініко–лабораторне дослідження включало загальний аналіз крові та сечі, біохімічний аналіз крові, аналіз крові на глюкозу, ліпідограму. Клініко–інструментальні методи обстеження окрім магнітно–резонансної томографії головного мозку включали електрокардіографію, вимірювання артеріального тиску та частоти серцевих скорочень. Проводилося дуплексне сканування екстра– та інтракраніальних судин головного мозку, за допомогою якого виявлялися стенози та деформації судин голови та шиї, їх гемодинамічна значимість, товщина та однорідність комплексу інтима–медіа, наявність атеросклеротичних змін.
У пацієнтів визначалися основні фактори серцево–судинного ризику: артеріальна гіпертензія, паління, дисліпідемія (загальний холестерин > 5,0 ммоль/л, або холестерин ліпопротеїдів низької щільності > 3,0 ммоль/л, або холестерин ліпопротеїдів високої щільності < 1,0 ммоль/л у чоловіків та < 1,2 ммоль/л у жінок, або тригліцериди > 1,7 ммоль/л), глюкоза крові натще понад 11,0 ммоль/л або порушення толерантності до глюкози, надмірна вага (індекс маси тіла понад 25,0 кг/м2).
Судинорухову функцію ендотелію визначали за концентрацією стійкого метаболіту оксиду азоту — нітриту (мкмоль/л) та ендотеліну–1 (нг/мл). Концентрація ендотеліну визначалася методом імуноферментного аналізу за допомогою реактиву DRG Endotelin–1 ELISA (CША). Рівень нітриту (NO2–) у сироватці крові визначали флуориметричним методом за допомогою реактиву Sigma–Aldrich (США). За порушення ендотеліальноі функції приймали стан, при якому спостерігалося відхилення зазначених показників від таких у здорових осіб відповідного віку.
Статистична обробка отриманих даних проводилася на персональному комп’ютері з використанням англомовного пакету SPSS (SPSS Inc., USA). Зважаючи на те, що розподіл отриманих даних відрізняється від нормального (визначено за допомогою критеріїв Колмогорова — Смірнова і Шапіро — Уїлка), використовувалися методи непараметричного аналізу. Дані наведено у вигляді Ме (25 %; 75 %), тобто медіани та інтерквартильного розмаху. Статистично значимою різниця вважалася при р < 0,05.
Результати та їх обговорення
За сукупністю скарг, даних анамнезу, за результатами клініко–неврологічного та клініко–інструментального огляду у 133/295 (45,1 %) хворих був виявлений симптомокомплекс, що відповідав критеріям діагностики початкових проявів недостатності мозкового кровообігу (ППНМК), у 78/295 (26,4 %) пацієнтів було діагностовано дисциркуляторну енцефалопатію І стадії (ДЕП І) та у 31/295 (10,5 %) хворого — дисциркуляторну енцефалопатію ІІ стадії (ДЕП ІІ). Дані клініко–неврологічного та клініко–інструментального обстеження, що свідчили про відсутність відхилень у неврологічному статусі та лабільність функції вегетативної нервової системи, дозволили встановити у 53 (18 %) осіб діагноз вегетосудинної дистонії (ВСД).
У 194/295 (65,4 %) обстежених пацієнтів спостерігалася артеріальна гіпертензія. У 118/194 (60,8 %) хворих визначалася АГ І ступеня, у 76/194 (39,2 %) пацієнтів — АГ ІІ ступеня. Відповідно до зазначеної класифікації у 79/194 (40,7 %) пацієнтів була І стадія АГ та у 115/194 (59,3 %) — ІІ стадія АГ. У табл. 1 наведені дані про розподіл причин, на ґрунті яких була встановлена ІІ стадія АГ.
З табл. 1 видно, що у хворих з АГ частіше за все уражалися серце та головний мозок, хоча дрібновогнищеве ураження головного мозку (зокрема, білої речовини) не входить до редакції класифікації АГ за ураженням органів–мішеней, наведеної в оновленій та адаптованій клінічній настанові (наказ МОЗ від 24.05.2012 р. № 384).
У 65/295 (22,0 %) пацієнтів АГ виявлено не було, у той час як у 36/295 (12,2 %) спостерігалася артеріальна гіпотензія (АТ 100/60 мм рт.ст. і нижче). Розподіл хворих за ступенем та стадією АГ відповідно до діагнозу наведено в табл. 2. При порівнянні пацієнтів з АГ різного ступеня було виявлено, що серед обстежених вірогідно більше було пацієнтів із АГ І ступеня (40 %/295). Серед пацієнтів із ППНМК та ДЕП І вірогідно частіше спостерігалася АГ І ступеня (50,4 %/113 та 52,6 %/78), у той час як хворі на АГ ІІ ступеня частіше мали діагноз ДЕП ІІ (67,7 %/31). Перша стадія АГ вірогідно частіше спостерігалася серед пацієнтів з ППНМК, у той час як серед пацієнтів із ДЕП І (79,7 %/78) та ДЕП ІІ (89,3 %/31) частіше зустрічається АГ саме ІІ стадії.
Серед пацієнтів із ППНМК відхилення АТ не спостерігалися у 25/133 (18,8 %) хворих, із ДЕП І — у 7/78 (9,0 %), у хворих із діагнозом ДЕП ІІ АТ був у межах цільових цифр у 3/31 (9,7 %), із ВСД — у 30/53 (56,6 %).
Досить важко встановити точний час початку АГ, тому ми орієнтувалися на дані анамнезу про перше підвищення (коливання) АТ. В обстежених пацієнтів (із 194 хворих, яким встановлений діагноз АГ) отримати інформацію про тривалість захворювання вдалося в 162 (83,5 %) пацієнтів. Медіана тривалості АГ становила 5 років (Q1 = 2; Q3 = 8). У 105/162 (64,8 %) пацієнтів тривалість АГ була до 5 років, у 40/162 (24,7 %) хворих — від 6 до 10 років, у 17/162 (10,5 %) — понад 10 років. У табл. 3 наведені дані про розподіл стажу АГ залежно від діагнозу.
Серед обстежених пацієнтів із діагнозом ВСД було всього 3 особи з АГ (в одного пацієнта анамнез захворювання не перевищував 5 років, в одного хворого — понад 5 років, і в однієї особи тривалість АГ була невідома). Особи з тривалістю АГ до 5 років частіше мали ППНМК (58/104), тривалість АГ більше 10 років частіше спостерігалася у хворих на ДЕП ІІ (8/17). Серед хворих на ППНМК та ДЕП І, тобто в пацієнтів із клінічно менш вираженою патологію головного мозку, спостерігалася найменша тривалість АГ (менше 5 років) — в 79,5 %/73 та 59,7 %/62 відповідно, тоді як серед осіб із ДЕП ІІ тривалість АГ розподілялася у рівних частинах (табл. 3).
В анамнезі рідних першої лінії (переважно батьків) із серцево–судинними захворюваннями мали 144/295 (49 %) пацієнтів. Тютюнопаління визначалося в 62/295 (21 %) осіб. Медіана індексу маси тіла в пацієнтів становила 25,1 (Q1 = 22,2; Q3 = 28,2), що свідчить про те, що приблизно 50 % обстежених мали схильність до надлишкової маси тіла.
Серед хворих з АГ лише 10/194 (5,2 %) осіб приймали відповідну антигіпертензивну терапію, у результаті якої був досягнутий цільовий рівень АТ до того, як проводилося дослідження. У 169/194 (87,1 %) обстежених осіб АГ була виявлена вперше або на тлі періодичних коливань АТ відповідне лікування проводилося епізодично. У 15/194 (7,7 %) осіб антигіпертензивна терапія мала формальний характер і не призводила до адекватного контролю АТ. Кризовий перебіг АГ спостерігався у 81/194 (41,8 %) хворого.
В обстежених пацієнтів спостерігалися загальновідомі фактори ризику серцево–судинних захворювань: дисліпідемія, АГ, паління, порушення толерантності до глюкози/цукровий діабет та надмірна маса тіла. Поширеність факторів ризику подана в табл. 4.
Як видно з табл. 4, найбільш поширеними факторами ризику серцево–судинних захворювань серед обстежених пацієнтів є артеріальна гіпертензія (65,8 %/295) та надмірна маса тіла (47,1 %/295).
Слід зазначити, що існує зв’язок між діагнозом та факторами ризику (χ2(3) Пірсона; критерій V Крамера): АГ (112,612, р < 0,001; 0,618, р < 0,001), ЦД/порушенням толерантності до глюкози (14,683, р = 0,002; 0,223, р = 0,002), надмірною вагою (32,881, р < 0,0001; 0,343, р < 0,0001). Зв’язок між діагнозом та фактом паління (6,855, р = 0,077; 0,152, р = 0,077) або дисліпідемією (5,904, р = 0,116; 0,202, р = 0,116) не мав статистичної значимості. Такі фактори ризику, як ЦД та надмірна маса тіла, мали зв’язок середнього ступеня (сила зв’язку за значенням критерію V Крамера = 0,2–0,4), а АГ має дуже сильний зв’язок (за значенням критерію V Крамера > 0,6). Серед пацієнтів з АГ було вірогідно менше осіб із ВСД (5,7 %/53) та найбільше — з ДЕП ІІ (90,3 %/31). Аналогічна ситуація спостерігалася за поширеністю надмірної маси тіла (22,6 %/53 та 80,6 %/31 відповідно). Щодо випадків дисліпідемії розрізнялися лише пацієнти з ДЕП І та ДЕП ІІ.
Хотілось би відмітити, що застосування Z–критерію показало: пацієнти з ППНМК та особи з ВСД відрізняються за поширеністю таких факторів ризику, як АГ та надмірна маса тіла. При порівнянні пацієнтів із ДЕП І та осіб із ВСД було виявлено статистично значиму відмінність за поширеністю АГ, ЦД/порушення толерантності до глюкози та надмірної маси тіла. Статистично значимі відмінності між пацієнтами з ДЕП ІІ та особами з ВСД були виявлені за поширеністю всіх зазначених факторів ризику, окрім дисліпідемії. Пацієнти з ДЕП І та ДЕП ІІ відрізнялися за поширеністю усіх факторів ризику.
Серед обстежених пацієнтів було 35/295 (11,9 %) осіб без додаткових факторів ризику (щодо віку), 98/295 (33,2 %) хворих з 1 фактором ризику, 103/295 (34,9 %) пацієнти з 2 факторами ризику, 49/295 (16,6 %) — із 3 факторами ризику, 9 (3,1 %) осіб мали 4 фактори ризику, і лише в одного чоловіка були всі досліджувані 5 факторів ризику (0,3 %). Іншими словами, третина пацієнтів мали один і третина — два фактори ризику незалежно від віку.
При порівнянні пацієнтів із різними діагнозами за кількістю факторів ризику була виявлена тенденція до збільшення кількості одночасно виявлених факторів ризику в міру прогресування цереброваскулярної хвороби (табл. 6). В осіб із ВСД вірогідно частіше не виявлялися зазначені фактори ризику (41,5 %/53). У пацієнтів із ППНМК кількість факторів ризику переважно відрізнялася від такої серед хворих із ВСД. Хворі з ДЕП І та ДЕП ІІ вірогідно відрізнялися від осіб із ВСД за кількістю факторів ризику. Пацієнти з двома та трьома факторами ризику вірогідно частіше мали ДЕП ІІ. Було виявлено, що кількість факторів ризику та тип діагнозу вірогідно пов’язані (χ2(15) = 81,535, р < 0,001; V Крамера = 0,304, р < 0,001).
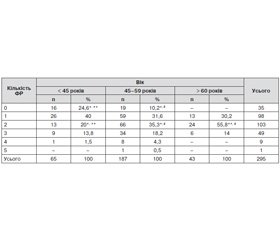
Розподіл факторів ризику за віком показав, що серед пацієнтів віком до 45 років вірогідно частіше не спостерігалися найбільш поширені фактори ризику та було вірогідно менше пацієнтів із 2 факторами ризику. Пацієнти віком старше 60 років вірогідно частіше мали одночасно 2 фактори ризику порівняно з молодшими пацієнтами (табл. 7).
Був виявлений зв’язок між кількістю факторів ризику й віком пацієнтів (χ2(10) = 29,226, р = 0,001; V Крамера = 0,223, р = 0,001).
У табл. 8 наведені дані щодо розподілу концентрації нітриту та ендотеліну–1 серед пацієнтів із певним діагнозом. Слід зазначити, що в осіб із ВСД, які перебували під спостереженням, відхилень у зазначених показниках виявлено не було, іншими словами, не спостерігалися лабораторні ознаки ендотеліальної дисфункції (порушення судинорухової функції ендотелію). Відхилення досліджуваних показників (зменшення або збільшення концентрації нітриту (мкмоль/л) і/або збільшення концентрації ендотеліну–1 (нг/мл)) свідчили про порушення судинорухової функції ендотелію.
Як видно із табл. 8, пацієнти із різним ступенем цереброваскулярної патології та ВСД вірогідно різнилися за рівнем ендотеліну–1, тоді як рівень нітриту не відрізнявся в осіб із ВСД та ППНМК. Виявлено, що рівень нітриту вірогідно знижувався в міру прогресування захворювання, а рівень ендотеліну–1 — підвищувався.
При порівнянні груп пацієнтів із різними діагнозами за допомогою непараметричного критерію Краскела — Уолліса була виявлена вірогідна різниця між пацієнтами за концентрацією нітриту (χ2(3) = 45,27; р < 0,001) та концентрацію ендотеліну–1 (χ2(3) = 35, 75; р < 0,001). Дослідження зв’язків (за V Крамера) виявило кореляцію між відхиленням концентрації нітриту та вираженістю цереброваскулярної патології (типом діагнозу) 0,452 (р < 0,001), що свідчить про відносно сильний прямий зв’язок. Зв’язок між відхиленням концентрації ендотеліну–1 та типом діагнозу був на рівні 0,468 (р < 0,001), що свідчить також про відносно сильний прямий зв’язок між зазначеними показниками.
Слід зазначити, що зв’язок між показниками нітриту та ендотеліну–1 у вибірці в цілому за показником рангової кореляції Спірмена становив –0,345 (р < 0,0001), що свідчить про помірну зворотну кореляцію. У пацієнтів із цереброваскулярною патологією (ППНМК, ДЕП І і ДЕП ІІ) спостерігається помірна зворотна рангова кореляція за Спірменом (r = –0,386, р = 0,001). При вивченні зв’язку зазначених показників (концентрації ендотеліну–1 та нітриту) в окремих групах показана відсутність зв’язку, а саме в групі 1 (ППНМК) r = –0,192 (p = 0,2), у групі 2 (ДЕП І) r = 0,245 (р = 0,26), в групі 3 (ДЕП ІІ) r = –0,077 (р = 0,856) та в групі 4 (пацієнти з ВСД) r = 0,237 (р = 0,184). Така відсутність кореляційного зв’язку в групах може свідчити про те, що виникнення цереброваскулярної патології і є результуючою порушення взаємозв’язку між двома протилежно направленими чинниками.
При дослідженні зв’язків між факторами ризику та відхиленням рівня ендотеліну–1 та/або нітриту від норми (лабораторні маркери ендотеліальної дисфункції) було виявлено, що існує зв’язок між наявністю АГ та відхиленням ендотеліну–1 (V Крамера = 0,334; p < 0,001). Відношення ризику становило 2,09 (ДІ = 1,33–0,3,29), іншими словами, відхилення рівня ендотеліну–1 від фізіологічного показника пов’язане з підвищенням ризику АГ у 2,1 раза. Зв’язок між відхиленням концентрації нітриту та АГ становив 0,462 (p < 0,001). Був виявлений зв’язок між наявністю цукрового діабету та відхиленням від фізіологічного рівня лише ендотеліну–1 (V Крамера = 0,23, р = 0,014); відношення ризику становить 2,06 (ДІ = 1,7–2,49)). Також існує зв’язок між надмірною масою тіла та відхиленням від норми рівня ендотеліну–1 (V Крамера = 0,21, p = 0,023) та нітриту (V Крамера = = 0,226, p = 0,029). Відношення ризику надмірної маси тіла при відхиленні концентрації ендотеліну–1 становило 1,51 (ДІ = 1,06–2,15). Із дисліпідемією зв’язки виявлені не були.
Був виявлений кореляційний зв’язок (кореляція Спірмена) між концентрацією нітриту та кількістю факторів ризику — –0,262 (р = 0,002); між концентрацію ендотеліну–1 та кількістю факторів ризику — 0,288 (р = 0,002).
Висновки
Було виявлено, що найбільш значущими факторами ризику для переходу доклінічних стадій у цереброваскулярну хворобу є артеріальна гіпертензія та надмірна маса тіла.
Пацієнти з клінічно значимими проявами цереброваскулярної хвороби вірогідно частіше мали сполучення двох або трьох судинних факторів ризику, тоді як відсутність факторів ризику частіше зустрічалася в осіб із вегетосудинною дистонією.
Був виявлений зв’язок між кількістю факторів ризику і віком пацієнтів, що свідчить, крім того, що вік сам по собі є цереброваскулярним фактором ризику, із віком підвищується ризик мати додаткові фактори ризику.
Виявлено, що рівень нітриту вірогідно знижувався в міру прогресування захворювання, а рівень ендотеліну–1 підвищувався, іншими словами, цереброваскулярні захворювання супроводжуються порушенням судинорухової функції ендотелію.
Встановлені зв’язки між факторами ризику й біохімічними маркерами ендотеліальної судинорухової функції та їх характер свідчать про важливість своєчасного виявлення та корекції судинних факторів ризику з метою профілактики судинних захворювань головного мозку.
1. Bonetti P.O., Lerman L.O., Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk // Atheroscler. Thromb Vasc. Biol. — 2003 Feb. — 23(2). — 168–75.
2. Cai H., Harrison D.G. Endothelial dysfunction in cardiovascular disease: the role of oxidative stress // Circ. Res. — 2000 Nov. — 87(10). — 840–4.
3. Celermajer D.S., Sorensen K.E., Bull C. et al. Endothelium–dependent dilation in the systemic arteries of asymptomatic subjects relates to coronary risk factors and thei interaction // J. Am. Coll. Cardiol. — 1994 Nov. — 24(6). — 1468–74.
4. Deedwania P.C. Endothelium: a new target for cardiovascular therapeutics // J. Am. Coll. Cardiol. — 2000 Jan. — 35(1). — 67–70.
5. Halcox J.P., Schenke W.H., Zalos G. et al. Prognostic value of coronary vascular endothelial dysfunction // Circulation. — 2002 Aug. — 106(6). — 653–8.
6. Lerman A., Burnett J.C. Jr. Intact and altered endothelium in regulation of vasomotion // Circulation. — 1992 Dec. — 86 (6 Suppl.). — III12–19.
7. Mano T., Masuyama T., Yamamoto K. et al. Endothelial dysfunction in the early stage of atherosclerosis precedes appearance of intimial lesions assessable with intravascular ultrasound // Am. Heart J. — 1996 Feb. — 131(2). — 231–8.
8. Quyyumi A.A., Dakak N., Andrews N.P. et al. Contribution of nitric oxide to metabolic coronary vasodilation in the human heart // Circulation. — 1995 Aug. — 92(3). — 320–6.
9. Szucs G., Tímár O., Szekanecz Z. et al. Endothelial dysfunction precedes atherosclerosis in systemic sclerosis — relevance for prevention of vascular complications // Rheumatology (Oxphord). — 2007 May. — 46(5). — 759–62.
10. Tomasian D., Keaney J.F., Vita J.A. Antioxidants and the bioactivity of endothelium–derived nitric oxide // Cardiovasc. Res. — 2000 Aug. — 47(3). — 426–35.
11. Tooke J.E. Microvascular function in human diabetes. A physiological perspective // Diabetes. — 1995 Jul. — 44(7). — 721–6.
12. Vogel R.A., Corretti M.C. Estrogens, progestins and heart disease: can endothelial function divine the benefit? // Circulation. — 1998 Apr. — 97(13). — 1223–6.
13. Watson T., Goon P.K., Lip G.Y. Endothelial progenitor cells, endothelial dysfunction, inflammation, and oxidative stress in hypertension // Antioxid Redox Signal. — 2008 Jun. — 10(6). — 1079–88.

/34/34.jpg)
/35/35.jpg)
/36/36.jpg)
/37/37.jpg)