Международный неврологический журнал 1 (71) 2015
Вернуться к номеру
Особливості відновлення втрачених рухових функцій після гострого ізольованого інфаркту мозочка та його наслідки на тлі комплексної терапії
Авторы: Трепет Г.С. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
У наукових джерелах і дотепер недостатньо вивченими залишаються особливості відновлення рухових функцій і наслідки мозочкового інфаркту в різні періоди після його розвитку. У вітчизняній літературі результати таких досліджень не висвітлені, нечисленні також публікації іноземних авторів. Мета дослідження — вивчити особливості та закономірності відновлення втрачених рухових функцій з урахуванням ураженого артеріального басейна васкуляризації мозочка, наявних клінічних і МР-томографічних ознак перехресного мозочково-півкульного діашизу та без них у хворих із гострим ізольованим інфарктом мозочка та оцінити його функціональні наслідки на тлі комплексної терапії. У дослідження були залучені 44 пацієнти з гострим ізольованим інфарктом мозочка, 22 з яких перенесли інфаркт у басейні верхньої артерії мозочка (ВАМ), 17 — у басейні задньої нижньої артерії мозочка (ЗНАМ) і 5 — у басейні васкуляризації передньої нижньої артерії мозочка (ПНАМ). Комплексна терапія включала одночасне використання Цераксону та Актовегіну в поєднанні з антиагрегантними і дегідратаційними засобами. Відновлення рухових функцій і наслідки ізольованого інфаркту мозочка оцінювали на 14, 21
і 90-й день проспективного спостереження. Результати дослідження показали, що на тлі проведеної комплексної терапії обсяг і темпи відновлення рухових функцій та наслідки мозочкового інфаркту визначались ураженим артеріальним басейном васкуляризації мозочка і наявними ознаками феномену перехресного мозочково-півкульного діашизу: на 90-ту добу проспективного спостереження повне функціональне відновлення після інфаркту в басейні ВАМ без ознак діашизу досягнуто в 91,7 % пацієнтів, із клінічними проявами діашизу — у 70 % випадків; при інфарктах у басейні ЗНАМ — відповідно у 72,7 і 50 % спостережень; після інфаркту у басейні васкуляризації ПНАМ — 100-відсоткове відновлення функцій. Результати 3-місячного проспективного спостереження у групах дослідження незалежно від ураженого судинного басейну засвідчили, що повне функціональне відновлення після інфаркту без проявів діашизу виникало значно частіше (82,6 %) порівняно з групою хворих із наявними клінічними ознаками перехресного мозочково-півкульного діашизу (62,5 %). Отримані результати сприятимуть поліпшенню ведення та реабілітації хворих із гострим мозочковим інфарктом. Водночас важливим залишається подальше дослідження питань, що розглядаються у статті.
В научных источниках до сих пор недостаточно изученными остаются особенности восстановления двигательных функций и последствия мозжечкового инфаркта в разные сроки после его развития. В отечественной литературе результаты таких исследований не освещены, немногочисленны также публикации иностранных авторов. Цель исследования — изучить особенности и закономерности восстановления утраченных двигательных функций с учетом пораженного артериального бассейна васкуляризации мозжечка, имеющихся клинических и МР-томографических признаков перекрестного мозжечково-полушарного диашиза и без них у больных с острым изолированным инфарктом мозжечка и оценить его функциональные последствия на фоне комплексной терапии. В исследование были включены 44 пациента с острым изолированным инфарктом мозжечка, 22 из которых перенесли инфаркт в бассейне верхней артерии мозжечка (ВАМ), 17 — в бассейне задней нижней артерии мозжечка (ЗНАМ) и 5 — в бассейне васкуляризации передней нижней артерии мозжечка (ПНАМ). Комплексная терапия включала одновременное использование Цераксона и Актовегина в сочетании с антиагрегантными и дегидратационными средствами. Восстановление двигательных функций и последствия изолированного инфаркта мозжечка оценивали на 14, 21 и 90-й день проспективного наблюдения. Результаты исследования показали, что на фоне проведенной комплексной терапии объем и темпы восстановления двигательных функций и последствия мозжечкового инфаркта определялись пораженным артериальным бассейном васкуляризации мозжечка и имеющимися проявлениями феномена перекрестного мозжечково-полушарного диашиза: на 90-е сутки проспективного наблюдения полное функциональное восстановление после инфаркта в бассейне ВАМ без признаков диашиза достигнуто у 91,7 % пациентов, с клиническими проявлениями диашиза — в 70 % случаев; при инфарктах в бассейне ЗНАМ — соответственно у 72,7 и 50 % наблюдений; после инфаркта в бассейне васкуляризации ПНАМ — 100-процентное восстановление функций. Результаты 3-месячного проспективного наблюдения в группах исследования независимо от пораженного сосудистого бассейна показали, что полное функциональное восстановление после инфаркта без проявлений диашиза возникало значительно чаще (82,6 %) по сравнению с группой больных с имеющимися клиническими признаками перекрестного мозжечково-полушарного диашиза (62,5 %). Полученные результаты будут способствовать улучшению ведения и реабилитации больных с острым мозжечковым инфарктом. В то же время важным остается дальнейшее исследование вопросов, рассматриваемых в статье.
Features of motor recovery and effects of cerebellar infarction in different periods after its onset are still underinvestigated in scientific sources. In the domestic literature the results of such researches are not covered, they are few in number in publications by foreign authors too. The Objective of the Study — to analyse the features and patterns of recovery of lost motor functions, taking into account the affected arterial vascularization of the cerebellum, present clinical and magnetic resonance imaging evidence of crossed cerebellar hemispheric diaschisis and without it in patients with acute isolated cerebellar infarction and to evaluate its functional effects on the background of comprehensive therapy. The study involved 44 patients with acute isolated cerebellar infarction, among them 22 patients had an infarction in the territory of the superior cerebellar artery (SCA), 17 — in the posterior inferior cerebellar artery (PICA) and 5 — in the territory of anterior inferior cerebellar artery (AICA) vascularization. Combined therapy included the simultaneous use of Ceraxon and Actovegin in combination with antiplatelet and rehydratation agents. Motor recovery and the effects of isolated cerebellar infarction were assessed on the 14th, 21st and 90th days of prospective study. The results of the study showed that on the background of comprehensive therapy, volume and rates of motor recovery and effects of cerebellar infarction were determined by the affected arterial territory of cerebellar vascularization and the existing manifestations of crossed cerebellar hemispheric diaschisis: on 90th day of the prospective study, full functional recovery after an infarction in SCA with no signs of diaschisis was achieved in 91.7 % of patients, with clinical manifestations of diaschisis — in 70 % of cases; with infarctions in PICA — respectively in 72.7 and 50 % of cases; after an infarction on the territory of AICA vascularisation we observed 100% functional recovery. The results of the 3-month prospective follow-up in study groups, regardless of the affected vascular beds, have shown that the full functional recovery after an infarction with no evidence for diaschisis occurred significantly more often (82.6 %) compared with the group of patients with clinical signs of crossed cerebellar hemispheric diaschisis (62.5 %). The findings will help to improve the management and rehabilitation of patients with acute cerebellar infarction. At the same time, further study of the issues addressed in the article is still important.
інфаркт мозочка, руховий дефіцит, лікування, відновлення функцій, наслідки.
инфаркт мозжечка, двигательный дефицит, лечение, восстановление функций, последствия.
cerebellar infarction, motor deficit, treatment, functional recovery, effects.
Статья опубликована на с. 71-80
Вступ
Симптоми рухової дисфункції (дизметрія, інтенційний тремор, адіадохокінез, дизартрія, ністагм, втрата координації рухів, порушення рівноваги тіла як вияв мозочкової атаксії) вперше були класично описані ще на початку ХХ ст. у публікаціях відомих неврологів J. Babinski (1902, 1906) і G. Holmes (1917). Детальніше прояви мозочкового рухового синдрому після перенесеного гострого інфаркту мозочка досліджувалися в кінці ХХ і на початку ХХІ ст. після впровадження в клінічну практику методів нейровізуалізації (Amarenco P. et al., 1990; Bastian A.J. et al., 1996; Schmahmann J.D., 2004; Grodd W. et al., 2005; Timmann D., 2009). Це дозволило доповнити класичні описання типових симптомів і визначити соматотопічне представництво в корі мозочка окуломоторного (Dietrichs E., 2009; Baier G. et al., 2009) і мовно–рухового контролю (Ogawa K. et al., 2004; Sander T. et al., 2009), мовленнєвої функції (Karaci R. et al., 2008; Ye B.S. et al., 2010), рухів рукою (Bastian A.J., 2002; Konczak J. et al., 2010), рухів рукою, ногою та язиком (Nitschke M.F. et al., 1998; Deluca C. et al., 2007). Результати дослідження останніх років дозволили ідентифікувати ділянки мозочка, що відповідають за руховий контроль і модулюють когнітивні функції та емоційні процеси в нормі та патології (Schmahmann J.D., 2009).
Незважаючи на значну кількість публікацій стосовно описання специфічних симптомів при ізольованих інфарктах мозочка, дотепер недостатньо вивченими залишаються особливості відновлення рухових функцій і наслідки у пацієнтів у різні періоди після розвитку мозочкового інфаркту. Цій проблемі присвячені лише поодинокі проспективні дослідження. У найбільшому з них (Tohgi H. et al., 1993), що ґрунтується на клінічному і нейровізуалізаційному аналізі 293 пацієнтів із мозочковим інфарктом, на 90–ту добу спостереження функціонально незалежними автори класифікували 69 % хворих. Цей факт свідчить, що окремі церебелярні інфаркти мають хороший функціональний прогноз порівняно з інфарктами в інших судинних басейнах (Tohgi H. et al., 1993; Kelly P.J. et al., 2001).
В іншому дослідженні J. Konczak та співавторів (2010), що базується на клініко–нейровізуалізаційному обстеженні 16 пацієнтів із мозочковим інфарктом з урахуванням карти «пошкодження — симптом» і використанням Міжнародної кооперативної рейтингової шкали атаксії ICARS (International Cooperative Ataxia Rating Scale) (Trouillas P. et al., 1997), оцінювалось відновлення рухової функції верхньої кінцівки у трьох післяінсультних інтервалах: у гострій стадії, через 2 тижні та через 3 міс. після розвитку інсульту. Згідно з даними авторів, відновлення рухів верхньої кінцівки суттєво поліпшувалося у 86 % пацієнтів протягом перших 2 тижн.; у періоді між 2 тижн. і 3 міс. поліпшення було менш значущим. Рівень покращення рухової функції верхньої кінцівки при інфаркті в басейні верхньої артерії мозочка (ВАМ) був вищим порівняно з інфарктами в басейні задньої нижньої артерії мозочка (ЗНАМ).
Актуальним залишається вивчення особливостей і закономірностей відновлення втрачених неврологічних функцій у пацієнтів після ізольованого інфаркту мозочка з феноменом перехресного мозочково–півкульного діашизу. Лише поодинокі дослідження (Grips E. et al., 2005) торкаються питання впливу діашизу на функціональні результати хворих з ізольованим інфарктом мозочка. Автори передусім дійшли висновку, що функціональні наслідки мозочкових інфарктів визначалися не обсягом та локалізацією інфарктного вогнища, а віковими змінами супратенторіальної білої речовини головного мозку. Саме ці віддалені ефекти були одними з факторів прогнозування тривалості рухових симптомів, функціональних наслідків інсульту. Щоправда автори досліджували еволюцію неврологічного дефіциту після мозочкового інфаркту лише в перші 2 тижні з використанням шкали NIHSS (National Institutes of Health Stroke Scale), модифікованої шкали Ренкіна (мШР), індексу Бартел (ІБ) і не оцінювали мозочкового рухового дефіциту за пунктами Міжнародної кооперативної рейтингової шкали атаксії ICARS.
Отже, з огляду на наведені дані поглибленого вивчення потребують особливості та закономірності відновлення втрачених рухових функцій у пацієнтів після гострого ізольованого мозочкового інфаркту з урахуванням характерних симптомів ураження різних артеріальних басейнів васкуляризації мозочка, наявності в них ознак дисфункції асоціативних ділянок кори півкуль головного мозку за даними магнітно–резонансних (МР) томографічних зображень на тлі лікування в гострий і ранній відновний періоди. Адже відновлення рухових функцій залишається актуальною метою лікування та реабілітації хворих. У вітчизняній літературі результати таких досліджень не висвітлені, нечисленні також і публікації іноземних авторів.
Мета дослідження — вивчити особливості та закономірності відновлення втрачених рухових функцій з урахуванням ураженого артеріального басейну васкуляризації мозочка, наявних клінічних і МР–томографічних ознак перехресного мозочково–півкульного діашизу та без них у хворих із гострим ізольованим інфарктом мозочка та оцінити його функціональні наслідки на тлі комплексної терапії.
Об’єкт і методи дослідження
Проведено клініко–радіологічне обстеження 44 хворих із гострим ізольованим інфарктом мозочка (чоловіків було 26, жінок — 18) віком від 28 до 84 років (середній вік — 61,1 ± 13,0 року), серед яких 22 пацієнти перенесли інфаркти в басейні васкуляризації ВАМ, 17 — у басейні ЗНАМ і 5 — у басейні кровопостачання передньої нижньої артерії мозочка (ПНАМ). Оскільки відновлення втрачених рухових функцій у пацієнтів у басейні васкуляризації ВАМ і ЗНАМ вивчали також з урахуванням клінічних і МР–томографічних ознак перехресного мозочково–півкульного діашизу, окремо аналізували динаміку рухового дефіциту в пацієнтів двох груп. До 1–ї групи увійшли 23 пацієнти віком від 41 до 83 років (середній вік — 62,9 ± 10,8 року) без клінічних і МР–томографічних проявів перехресного мозочково–півкульного діашизу (у басейні ВАМ — 12 осіб, ЗНАМ — 11 і ПНАМ — 5); 2–гу групу становили 16 хворих віком від 32 до 84 років (середній вік — 65,3 ± 14,7 року) з проявами перехресного мозочково–півкульного діашизу (інфаркт у басейні ВАМ — 10 осіб, ЗНАМ — 6). Між групами хворих не виявлено статистично значимої різниці за основними демографічними параметрами, васкулярними факторами ризику інсульту.
Основною причиною мозочкового інфаркту була артеріальна гіпертензія в поєднанні з атеросклерозом судин (65,9 %) або цукровим діабетом (13,6 %), миготлива аритмія (36,4 %), інфаркт міокарда в анамнезі (11,4 %). Хворі надходили до клініки в перші 6–12 годин після розвитку інсульту. Критерії включення пацієнтів у дослідження: діагноз гострого часткового або територіально ізольованого інфаркту мозочка з доброякісним перебігом, верифікований даними нейровізуалізації. Критерії виключення: наявність супутніх вогнищ інфаркту в різних відділах стовбура мозку, злоякісні та геморагічні інфаркти мозочка.
Діагноз ізольованого мозочкового інфаркту встановлювали за даними неврологічної клініки та магнітно–резонансної томографії (МРТ). Локалізацію вогнища інфаркту та його розмір верифікували на апараті Flexart (Toshiba) з напругою поля 1,5 Тл, дослідження виконували при надходженні протягом перших 3–5 діб у стандартних режимах Т1, Т2, в режимі FLAIR та у дифузійно–зваженому режимі. Об’єм вогнища інфаркту мозочка визначали за даними МРТ шляхом прямого вимірювання з урахуванням коефіцієнта збільшення томограми. Вибирали той зріз, на якому визначався найбільший розмір, і визначали об’єм за формулою еліпсоїда: V = 0,52ABC, де V — об’єм вогнища ураження; A, B, C — його діаметри, 0,52 — коефіцієнт для підрахунку об’єму неправильного еліпсоїда (Лебедев В.В. и соавт., 2005). В окремих випадках проводили МР–ангіографію судин головного мозку.
Локалізація мозочкового інфаркту була різною. У 37 (84,1 %) хворих виявляли унілатеральне ураження півкуль мозочка: у 22 (50 %) інфарктне вогнище локалізувалось у правій півкулі, у 15 (34,1 %) — у лівій, у 4 (9,1 %) — ураження правої півкулі та черв’яка; у 3 (6,8 %) діагностували білатеральне ушкодження півкуль мозочка. У 34 (77,3 %) пацієнтів верифікували часткові, у 10 (22,7 %) — територіальні інфаркти мозочка.
Тяжкість мозочкового рухового синдрому визначали з використанням пунктів напівкількісної Міжнародної кооперативної рейтингової шкали атаксії ICARS як маркера рухової дисфункції (Trouillas P. et al., 1997), неврологічні порушення оцінювали за шкалою NIHSS (Lyden P. et al., 1994), ступінь інвалідизації — за мШР (Rankin J., 1957), функціональну спроможність пацієнта — за індексом Бартел (Mohoney F., Barthel D., 1965). Обстеження проводили при надходженні пацієнта в клініку, а рухове відновлення оцінювали у 3 післяінсультних інтервалах: на 14–ту, 21–шу і 90–ту добу після розвитку інсульту. Оскільки на ступінь рухового відновлення великий вплив можуть справляти супутні неврологічні захворювання, для визначення їх впливу на динаміку відновлення функцій ми використовували індекс коморбідності Чарлсона (Charlson M.E. et al., 1987). Цей перевірений метод оцінював у балах від 0 до 6 кількість існуючих у пацієнта захворювань (серцево–судинних, цереброваскулярних, легеневих, ендокринних, ниркових, злоякісних).
Стан магістральних артерій голови в екстракраніальному відділі та інтракраніальних артерій досліджували за допомогою транскраніальної допплерографії та триплексного допплерівського сканування Ultima PA («Радмір») за стандартними методиками. Всім хворим проводили моніторинг артеріального тиску (АТ), кардіологічне обстеження з використанням 12–канальної електрокардіографії, ехокардіографії (ЕхоКГ). Проводили стандартні лабораторні тести: визначали рівні глюкози крові, гематокриту, фібриногену, показники коагуляційних властивостей крові.
Статистичну обробку отриманих даних та елементи статистичного аналізу проводили за допомогою непараметричних тестів на базі цифрових програм статистичного аналізу Місrosoft Office Excel 2007, програм SРSS Statistics 17.0 (Statistical Package for the Social Sciences) та Stata10. Порівняння динаміки мозочкового рухового й загального неврологічного дефіциту проведене за допомогою критерію Вілкоксона. З метою перевірки гіпотези про різницю вибірок (груп хворих) використовували х–квадрат на малу кількість спостережень. Статистично вірогідною різницю вважали при р < 0,05.
Результати та їх обговорення
Аналіз фонових мозочкових рухових порушень як основного неврологічного дефіциту після перенесеного ізольованого інфаркту мозочка показав, що вираженість його в пацієнтів 1–ї групи була різною й залежала від ураженого артеріального басейну васкуляризації мозочка. Клінічні прояви рухових порушень при інфаркті у басейні ВАМ визначались вибірковим ураженням медіальної (7 пацієнтів) або латеральної (5 хворих) гілки і найчастіше проявлялись у дизартрії, атаксії в кінцівках, порушенні рівноваги тіла. Середній показник мозочкового рухового дефіциту за шкалою ICARS становив 48,2 ± 3,0 бала, що відповідало атактичним порушенням середнього ступеня тяжкості.
Інфаркт у басейні ЗНАМ виявляли в 11 осіб, частіше (9 хворих) його діагностували у басейні васкуляризації медіальної гілки і лише у 2 — у басейні латеральної гілки ЗНАМ. Атактичні порушення здебільшого проявлялись у системному запамороченні, ністагмі, хиткості при ході та стоянні, тулубовій атаксії, латеропульсії, вестибулярних порушеннях. Середній показник рухових розладів за шкалою ICARS становив 64,4 ± 4,1 бала, що також відповідало середньому ступеню тяжкості, але був вірогідно вищим порівняно з інфарктом у басейні ВАМ (р < 0,01).
Мозочковий інфаркт у басейні васкуляризації ПНАМ (5 осіб) здебільшого проявлявся в системному запамороченні, спонтанному горизонтально–ротаторному ністагмі, вестибулярних порушеннях. Середній показник рухових порушень за рейтинговою шкалою ICARS становив 24,2 ± 5,7 бала, що відповідало легкому ступеню тяжкості.
Отже, об’єм мозочкового рухового дефіциту у хворих після інфаркту мозочка у басейні васкуляризації ЗНАМ був найвищим порівняно з інфарктом у басейні ВАМ (р < 0,01) і особливо ПНАМ (р < 0,001). За об’ємом інфарктів великої різниці між групами ВАМ (8,8 ± 2,6 см3) і ЗНАМ (14,3 ± 3,0 см3; p > 0,2) не виявлено, проте спостерігалась тенденція до менших об’ємів інфаркту в групі хворих у басейні ПНАМ (3,5 ± 1,4 см3; р < 0,1).
Аналіз фонового неврологічного дефіциту за шкалою NIHSS у пацієнтів 1–ї групи показав, що він був однаковим у хворих з інфарктом у басейні ВАМ і ЗНАМ і в середньому становив відповідно 5,00 ± 0,36 бала, 5,00 ± 0,65 бала, а в басейні ПНАМ — 2,80 ± 0,86 бала, тобто відповідав інсульту легкого ступеня тяжкості. Водночас показник інвалідизації за мШР у хворих з інфарктом у басейні ВАМ свідчив про помірне порушення життєдіяльності (3,3 бала; діапазон 3–4 бали), у басейні ЗНАМ — про помірно тяжке порушення (4,0 бали; діапазон 3–5 балів), у басейні ПНАМ — помірне порушення життєдіяльності (2,8 бала; діапазон 2–4 бали). За індексом Бартел виявлено виражену залежність повсякденної активності у хворих з інфарктом у всіх артеріальних басейнах (55,0–74,0 бала). Об’єм вогнища інфаркту в середньому становив 11,4 ± 1,7 см3.
Отже, використання параметрів шкали атаксії ICARS, мШР та індексу Бартел було більш чутливим для визначення тяжкості мозочкового рухового дефіциту та оцінки функціональних порушень у хворих з ізольованим інфарктом мозочка без проявів дистантного діашизу, ніж урахування неврологічного дефіциту за шкалою NIHSS.
У хворих 2–ї групи з ізольованим інфарктом мозочка і феноменом перехресного мозочково–півкульного діашизу виявлено несуттєвий (p > 0,5) приріст рівня мозочкових рухових порушень за шкалою атаксії ICARS у басейні ВАМ до 55,8 ± 3,2 бала, у басейні ЗНАМ — 71,0 ± 2,9 бала. Водночас спостерігалося вірогідне збільшення неврологічного дефіциту за шкалою NIHSS при інфаркті в басейні ВАМ — 7,50 ± 0,52 бала і в басейні ЗНАМ — 9,20 ± 0,64 бала (р < 0,01) порівняно з аналогічними показниками пацієнтів 1–ї групи. Показник інвалідизації за мШР відповідав помірно тяжкій інвалідизації у пацієнтів з інфарктом у басейні ВАМ і ЗНАМ (4,2 і 4,5 бала; діапазон 3–5 балів) — залежність від сторонньої допомоги за індексом Бартел (48,5 ± ± 3,6 бала і 42,5 ± 4,8 бала). Об’єм інфаркту у басейні васкуляризації ВАМ становив 15,7 ± 6,3 см3, у басейні ЗНАМ — 7,6 ± 4,3 см3 (p > 0,5).
Таким чином, вихідний рівень загального рухового дефіциту у хворих 2–ї групи після перенесеного інфаркту мозочка з феноменом перехресного мозочково–півкульного діашизу був більш вираженим, ніж у пацієнтів 1–ї групи, і визначався синергічним впливом симптомів ураженої території мозочка і супратенторіальних ділянок кори лобових (n = 7) і тім’яних (n = 9) часток конт–ралатеральної півкулі головного мозку, з якими мозочок взаємозв’язаний системою провідникових шляхів; об’єм інфаркту в ділянці контралатеральної півкулi головного мозку становив 15,2 ± 4,2 см3.
З огляду на наведені дані інтенсивна терапія гострого ізольованого мозочкового інфаркту незалежно від ураженого артеріального басейну, клінічних ознак перехресного мозочково–півкульного діашизу та без них передбачала реалізацію рекомендацій авторського комітету Європейської інсультної організації (European Stroke Organization (ESO) Executive Committee and the ESO Writing Committee. Guidelines for Management of Ischemic Stroke and Transient Ischemic Attack, 2008). Обсяг застосованої терапії ґрунтувався також на визначенні підтипу мозочкового інфаркту: атеротромботичний (n = 15), кардіоемболічний (n = 19), лакунарний (n = 5), остаточно невизначений (n = 5).
Для своєчасного відновлення функціонування нейронів не тільки в ділянці первинного вогнища інфаркту мозочка, але й у ділянках діашизу лобової або тім’яної частки контралатеральної півкулі головного мозку здійснювали такі заходи: оптимальне зниження підвищеного артеріального тиску; поліпшення серцевої діяльності; відновлення мозкової перфузії та активацію нейронального метаболізму; корекцію реологічних властивостей крові, її в’язкості; запобігання розвитку набряку головного мозку; усунення симптомів вестибулоатактичного синдрому.
Зниження АТ проводили в перші години й першу добу, якщо систолічний тиск > 220 мм рт.ст., або діастолічний 120 мм рт.ст., або середній > 130 мм рт.ст. (під час повторних вимірів). Цільовий рівень АТ для пацієнтів з артеріальною гіпертензією підтримували на рівні 160–180/90 мм рт.ст. Через 2–3 доби розпочинали планову гіпотензивну терапію: берліприл — 5 мг або берліприл плюс — 10/25 мг, каптопрес — 25 мг, бі–престаріум — 5,5 мг, індапамід — 2,5 мг, амлодипін — 10 мг, конкор — 2,5 мг. У разі кардіоемболічного підтипу мозочкового інфаркту гіпотензивну терапію поєднували з антиаритмічними засобами — кордарон внутрішньовенно краплинно або метопролол 100 мг перорально під контролем частоти серцевих скорочень, аспаркам — 10 мл внутрішньовенно краплинно. Обґрунтованим вважали застосування статинів (розукард 10–20 мг 1 раз на добу).
Для поліпшення мозкової перфузії в первинно ішемізованій ділянці мозочка і в ділянці контралатеральної півкулі головного мозку з метою початкової терапії некардіоемболічних інфарктів мозочка використовували антитромбоцитарні засоби — аспірин по 160–325 мг/добу впродовж 5 діб із подальшим зменшенням дози до 75–100 мг/добу і тривалим прийомом. Пацієнтам із кардіоемболічним інфарктом із високим ризиком реемболії проводили ранню терапевтичну антикоагуляцію з використанням гепарину в малих дозах — 5 тис. ОД 4 рази на добу підшкірно в навколопупкову ділянку протягом 5–7 діб із подальшим переходом на тривалий прийом пероральних антикоагулянтів (варфарин) із цільовим рівнем міжнародного нормалізованого відношення 2,5 (2,0–3,0).
Лікування лакунарного й остаточно невизначеного підтипів мозочкового інфаркту у пацієнтів без порушення ритму передбачало застосування пентоксифіліну від 100 до 300 мг внутрішньовенно краплинно протягом 5–7 діб (або магнію сульфату по 10 мл). Препарат позитивно впливав на центральний, регіонарний та мікроциркуляторний рівні системи кровообігу, нормалізував функцію механізмів авторегуляції мозкового кровотоку, зменшував венозний застій.
Найуспішнішим способом відновлення кровотоку і нейронального метаболізму в ішемізованих ділянках мозку і дотепер єдино затвердженим методом згідно з американським дослідженням NINDS (The National Institute of Neurological Disorders and Stroke rt–PA Stroke Study Group, 1997) є тромболізис із використанням рекомбінантного тканинного активатора плазміногену. Так, відповідно до критеріїв NINDS, пацієнтам із гострим мозочковим інфарктом рекомендовано проводити внутрішньовенний тромболізис. Проте в літературі мало вірогідних даних щодо лікування ізольованого мозочкового інфаркту з використанням тромболізису (Schellinger P.D. et al., 2007; Kohrman M. et al., 2009). Тому пацієнтів із такою локалізацією вогнища інфаркту здебільшого виключають із програми проведення внутрішньовенного тромболізису (Kohrman M. et al., 2009).
Саме тому з метою активації нейронального метаболізму в уражених і віддалених ішемізованих ділянках головного мозку, стимуляції функціонування мережі нейронів, провідникових аферентних кірково–мосто–мозочкового і церебелярних еферентацій мозочково–зубчастого, зубчасто–таламо–кіркового шляхів до перехрестя Вернекінга у верхній ніжці мозочка патогенетично обґрунтованим вважали застосування при всіх підтипах мозочкового інфаркту з проявами дистантного діашизу та без такого препарату з протекторними і ней–ротрофічними властивостями Цераксон (цитиколін) по 1000 мг у 200 мл фізіологічного розчину хлориду натрію внутрішньовенно краплинно протягом 7–10 діб, а також лікарського засобу з антиоксидатною дією Актовегін по 400–800 мг (10–20 мл) у 200 мл фізіологічного розчину хлориду натрію впродовж 7–10 діб.
Протекторна дія Цераксону ґрунтується на доведених механізмах впливу препарату: запобігає руйнуванню клітинних мембран, відновлює їх структурну цілісність, підсилює механізми нейропластичності за рахунок стимуляції синтезу фосфатидилхоліну; інгібує продукцію вільних радикалів, активує систему внутрішньоклітинного антиоксидантного захисту, підвищує рівень відновного глутатіону (Secades J.J., Larenzo J.L., Actibhatla R.M., 2010). Безумовно, наведені фармакологічні ефекти Цераксону сприяють поліпшенню функціонування провідникових еферентних шляхів мозочка з асоціативними кірковими полями півкуль головного мозку. Тому використання цитиколіну в комплексному лікуванні ішемічного інсульту вважають перспективним напрямком відновної терапії (Фишер М., 2014). Мішені терапевтичного впливу Актовегіну при мозочковому інфаркті: послаблення та/або нейтралізація окисного стресу, активація ендогенної антиоксидантної системи, інгібування ознак локального запалення (Elmlinger M.W. et al., 2011). Комплексне використання Цераксону та Актовегіну здійснює непряму синергічну дію, забезпечує підвищення енергетичного метаболізму в ділянці первинного вогнища ураження мозочка і в ділянці віддаленого діашизу (Віничук С.М. та співавт., 2013).
Серед ускладнень мозочкового інфаркту досить частим (у 17–54 %) є набряк головного мозку, пік якого здебільшого припадає на 3–тю добу (Bolddauf J. et al., 2006). Він може бути фатальним ускладненням, особливо в пацієнтів з інфарктом у басейні ЗНАМ, частота якого, за даними деяких авторів, становить 8–39 % (Juttler E., 2010). Це пояснюється досить малим і вузьким простором задньої черепної ямки для компенсації проявів мас–ефекту, унаслідок чого можливий швидкий розвиток компресії стовбура головного мозку. Тому медикаментозне лікування передбачало короткочасне проведення осмотерапії — манітолу гексанітрат 0,5–1,5 г на 1 кг маси тіла на добу (200 мл 15–20% розчину на 2–3 прийоми внутрішньовенно краплинно впродовж 5 діб). Ефективним було застосування L–лізину есцинату. Його призначали по 5–10 мл/добу внутрішньовенно впродовж 5–10 діб.
Гострі ізольовані інфаркти мозочка часто супроводжувалися (у 80 %) системним запамороченням. У 3 випадках після інфаркту в басейні ПНАМ запаморочення поєднувалося з нетривалим зниженням слуху, що було наслідком ураження внутрішньої слухової (лабіринтної) артерії — гілки ПНАМ. Як відомо, кохлеарна, вестибулярна та кохлеовестибулярна гілки внутрішньої слухової артерії васкуляризують структури внутрішнього вуха: завиток кортієвого органа, присінок півколових каналів, отолітовий апарат, що відповідають за аналіз положення тіла у просторі (Ворлоу Ч.П. и соавт., 1998; Lee H. et al., 2001). Тому до комплексу лікарських засобів із проявами кохлеовестибулярного і вестибулоатактичного синдромів включали препарати, що пригнічують активність Н3–рецепторів нейронів центральної вестибулярної системи, з якою взаємопов’язаний вестибулярний відділ мозочка. Із засобів із такою дією застосовували бетагістину гідрохлорид (бетагістин) у дозі 1 таблетка 24 мг двічі на добу або вестибо 24 мг двічі на добу впродовж 1–2 міс.
На тлі проведеної комплексної терапії спостерігалась позитивна динаміка відновлення рухових функцій у пацієнтів обох клінічних груп. Щоправда, темпи відновлення втрачених після інсульту функцій були не–однаковими. Зокрема, у хворих 1–ї групи спостерігалося статистично значуще, відповідно до критерію Вілкоксона, зменшення середнього бала рухового дефіциту за шкалою атаксії ICARS при інфарктах у різних артеріальних басейнах: ВАМ на 14–ту добу — 32,1 ± 3,3 бала (p < 0,01), на 21–шу добу — 7,8 ± 1,7 бала (p < 0,001), на 90–ту добу — 2,00 ± 0,45 бала (p < 0,001); ЗНАМ на 14–ту добу — 44,4 ± 4,3 бала (p < 0,01), на 21–шу добу — 25,3 ± 4,2 бала (p < 0,001), на 90–ту добу — 6,0 ± 2,7 бала (p < 0,001); ПНАМ на 14–ту добу — 9,6 (3–20) бала (p < 0,05), на 21–шу добу — 5,0 (1–5) бала (p < 0,01), на 90–ту добу — 0,8 (0–2) бала (p < 0,001). Впродовж 2 тижнів спостерігалось також значуще зменшення середнього бала неврологічного дефіциту за шкалою NIHSS до 2,0 бала при інфаркті в басейні ВАМ, ЗНАМ, ПНАМ (p < 0,001) і на такому рівні утримувався протягом усього періоду спостереження.
Повільнішими були темпи регресу рухових порушень у пацієнтів 2–ї групи з ізольованим інфарктом мозочка і феноменом перехресного мозочково–півкульного діашизу в басейні васкуляризації ВАМ і ЗНАМ, хоча статистично вірогідну різницю показників ICARS і NIHSS порівняно з фоновими виявлено уже на 14–ту добу лікування. У різні періоди спостерігалося відновлення рухових функцій за шкалою ICARS: у басейні ВАМ — на 14–ту добу — 38,2 ± 2,6 бала (p < 0,05); на 21–шу добу — 20,0 ± 2,8 бала (p < 0,01); на 90–ту добу — 10,3 ± 2,3 бала (p < 0,001); у басейні ЗНАМ — на 14–ту добу — 47,3 ± 8,9 бала (p < 0,05); на 21–шу добу — 25,7 ± 6,4 бала (p < 0,01); на 90–ту добу — 15,7 ± 4,3 бала (p < 0,001). Відновлення неврологічних функцій за шкалою NIHSS було ідентичним при інфарктах в басейні ВАМ і ЗНАМ і на 90–ту добу спостереження відповідали рівню 3,0 ± 0,3 бала (p < 0,001).
Таким чином, у пацієнтів після гострого ізольованого мозочкового інфаркту в басейні ВАМ і ЗНАМ із феноменом перехресного мозочково–півкульного діашизу і через 3 міс. проспективного спостереження утримувались легкого ступеня рухові порушення за шкалою ICARS. Темпи відновлення рухових функцій значною мірою визначались ураженим судинним басейном васкуляризації мозочка.
Для оцінки наслідків мозочкових інфарктів у басейні васкуляризації ВАМ і ЗНАМ із феноменом перехресного мозочково–півкульного діашизу та без такого в гострий і віддалений періоди пацієнти були розподілені за параметрами шкал інвалідності — мШР та індексу Бартел на 3 підгрупи: повне функціональне відновлення (одужання) без залишків рухової недостатності — мШР = 0–2 бали, ІБ ≥ 95 балів; помірне відновлення втрачених функцій — мШР ≤ 2 бала, ІБ ≥ 80 балів; втрата працездатності, інвалідизація значного ступеня — мШР > 2 бала, ІБ < 80 балів (Grips E. et al., 2005).
Найсприятливішим було завершення мозочкового інфаркту в пацієнтів з інфарктом у басейні васкуляризації ВАМ і ПНАМ без проявів дистантного діашизу: у басейні ВАМ на 14–ту добу повне функціональне відновлення зареєстровано у 58,3 % пацієнтів, помірне відновлення — у 33,3 %; на 21–шу і 90–ту добу — відповідно у 91,7 і 8,3 % випадків; при інфарктах у басейні ПНАМ на 14–ту добу повне функціональне відновлення настало у 80 % пацієнтів, помірне — у 20,0 % випадків, а на 21–шу добу в усіх хворих спостерігалось повне відновлення функцій. Менш сприятливими були наслідки після перенесеного інфаркту у басейні васкуляризації ЗНАМ: на 14–ту добу повне одужання настало у 36,4 % пацієнтів, помірне — у 45,4 % випадків; на 21–шу добу — відповідно у 54,5 і 27,3 % пацієнтів; на 90–ту добу проспективного спостереження у значної більшості обстежених (72,7 %) настало повне функціональне відновлення і у 2 (18,2 %) випадках — помірне відновлення функцій.
Іншим був розподіл наслідків після ізольованого інфаркту мозочка в артеріальних басейнах ВАМ і ЗНАМ з урахуванням наявного перехресного мозочково–півкульного діашизу при інфарктах у басейні васкуляризації ВАМ: на 14–ту добу повне функціональне відновлення відбулося в 40 % обстежених, ще у такої ж кількості (40 %) — помірне; на 21–шу добу — відповідно у 50 і 30 % випадків; добрі результати досягнуті лише на 90–ту добу — відповідно у 70 і 20 % випадків. У басейні ЗНАМ на 14–ту добу лише у 16,7 % випадків спостерігалось повне функціональне відновлення, у 50 % — помірне відновлення, ще у третини (33,3 %) обстежених зберігалась утрата працездатності; на 21–шу добу — повне й помірне відновлення функцій наставало з однаковою частотою (33,3 %); на 90–ту добу — у 50 % обстежених зареєстровано повне відновлення неврологічних функцій, у 33,3 % — помірне відновлення.
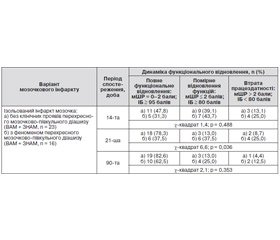
Окремого уточнення потребувало питання стосовно короткострокових і довгострокових наслідків ізольованого інфаркту мозочка та рівня самообслуговування у групах пацієнтів без клінічних проявів перехресного мозочково–півкульного діашизу (1–ша група) і хворих із клінічними і МР–томографічними ознаками перехресного мозочково–півкульного діашизу (2–га група) без урахування ураженого артеріального басейну (табл. 1). Хворих після інфаркту в басейні васкуляризації ПНАМ у групи аналізу не включали через відсутність вірогідної нейровізуалізації.
Як видно з наведених даних, на 14–ту добу лікування повне функціональне відновлення у пацієнтів 1–ї та 2–ї досліджуваних груп спостерігалось відповідно у 47,8 і 31,3 % і було статистично вірогідним щодо початкового рівня (p < 0,05), але відмінності між групами хворих були статистично незначущими (х–квадрат 1,4; р = 0,0488). Щодо помірного відновлення функцій, то воно з однаковою частотою виявлялoся у пацієнтів 1–ї та 2–ї груп (відповідно у 39,1 і 43,7 %). Практично з однаковою частотою зберігалася втрата працездатності в хворих.
Позитивні результати у пацієнтів досліджуваних груп досягнуті на 21–шу добу спостереження: повне функціональне відновлення спостерігалося відповідно у 78,3 і 37,5 %. Відмінності між групами за даними показниками були статистично значущими (хквадрат 6,6; р = 0,036). Втрата працездатності у пацієнтів із проявами діашизу зберігалась на попередньому рівні (25 %).
На 90–й день проспективного спостереження повне функціональне відновлення після мозочкового інфаркту без проявів дистантного діашизу виявлено у 82,6 % хворих, з проявами перехресного мозочково–півкульного діашизу — у 62,5 % обстежених, тобто статистична різниця між показниками вирівнювалася (хквадрат 2,1; р = 0,353); втрата працездатності утримувалась відповідно в одного (4,4 %) і двох (12,5 %) пацієнтів. На відновлення функцій у цих пацієнтів впливав їх віковий фактор (понад 80 років) і дисфункція кірково–мосто–мозочкових провідникових шляхів, зумовлена дисфункцією асоціативних кіркових ділянок лобових і тім’яних часток (діашиз) півкуль головного мозку. Індекс коморбідності Чарлсона в досліджуваних групах (кількість супутніх захворювань) був низьким — відповідно 1,90 ± 0,14 (діапазон 1–3) і 1,70 ± 0,11 (діапазон 1–3) (p > 0,5), тому не впливав на наслідки мозочкового інфаркту у хворих досліджуваних груп. Такі особливості та закономірності відновлення втрачених рухових функцій після ізольованого інфаркту мозочка та його функціональні наслідки на тлі комплексної терапії.
Висновки
Фоновий об’єм рухового дефіциту після гострого ізольованого інфаркту мозочка визначався симптомами мозочкового атактичного синдрому залежно від ураженого артеріального басейну васкуляризації мозочка: середній показник рухових порушень за Міжнародною кооперативною рейтинговою шкалою атаксії ICARS становив при інфарктах у басейні ВАМ 48,2 ± 3,0 бала, у басейні ЗНАМ — 64,4 ± 4,1 бала, що відповідало середньому ступеню тяжкості; у басейні ПНАМ (24,2 ± 5,7 бала) — легкому ступеню тяжкості.
Вихідний рівень рухового дефіциту у хворих з ізольованим інфарктом мозочка і феноменом перехресного мозочково–півкульного діашизу поглиблювався внаслідок сумарного впливу типових мозочкових рухових симптомів ураження певних територій васкуляризації мозочка за шкалою ICARS (61,5 ± 2,84 бала), а також приросту неврологічного дефіциту за шкалою NIHSS (7,80 ± 0,35 бала; p < 0,001) за рахунок синхронного виникнення симптомів гострого ішемічного ушкодження дистантних кіркових ділянок лобової або тім’яної часток контралатеральної півкулі головного мозку, з якими мозочок взаємопов’язаний системою еферентних провідникових шляхів.
Ґрунтуючись на результатах численних досліджень і світового клінічного досвіду, можна припустити, що комплексна терапія гострого ізольованого інфаркту мозочка з одночасним використанням препарату ней–ропротекторної дії Цераксон (цитиколін) й активатора ендогенної антиоксидантної системи Актовегіну в поєднанні з антиагрегантними і дегідратаційними засобами патогенетично обґрунтована, оскільки зумовлювала комбінований прямий синергічний терапевтичний ефект у ділянці первинного вогнища ураження мозочка і дистантних ділянках ішемічних порушень (діашизу). Ці висновки також були додатково підтверджені результатами довготривалого 3–місячного проспективного спостереження стосовно регресу втрачених рухових порушень: на 14–ту добу спостереження статистично значуще відновлення рухових функцій (р < 0,05) порівняно з фоновим рівнем; протягом наступного тижня (на 21–шу добу) рухові функції суттєво покращувалися у хворих без проявів дистантного діашизу на 78,3 % і з феноменом перехресного мозочково–півкульного діашизу — на 37,5 %; на 90–ту добу ефективність була статистично значимо більшою — відповідно у 82,6 і 62,5 % (р < 0,01) хворих.
Відновлення рухових функцій і наслідки мозочкового інфаркту визначались також ураженим артеріальним басейном мозочка: на 90–ту добу проспективного спостереження повне функціональне відновлення після інфаркту в басейні ВАМ з клінічними проявами перехресного мозочково–півкульного діашизу досягнуто у 70 % хворих, без проявів діашизу — у 91,7 % випадків; при інфаркті у басейні васкуляризації ЗНАМ — відповідно у 50 і 72,7 % обстежених. Хоча відмінності між групами за даними показниками були статистично незначущими (р > 0,05), спостерігалася тенденція до більш значного відновлення втрачених рухових функцій у хворих після інфаркту в басейні ВАМ порівняно з пацієнтами з інфарктом в басейні ЗНАМ; після інфаркту в басейні васкуляризації ПНАМ повне відновлення функцій настало у всіх пацієнтів.
1. Віничук С.М., Мяловицька О.А., Трепет Г.С. та ін. Мозочковий руховий синдром при гострих ізольованих інфарктах мозочка: клінічні прояви, діагностика та лікування // Міжнародн. неврол. журнал. — 2013. — № 5. — С. 45–53.
2. Ворлоу Ч.П., Деннис М.С., Гейнжван и др. Инсульт. Практическое руководство для ведения больных. — СПб.: Политехника. — 1998. — 629 с.
3. Лебедев В.В., Крылов В.В. Тиссен Т.П., Халчевский В.М. Компьютерная томография в неотложной нейрохирургии. — М.: Медицина, 2005. — 360 с.
4. Фишер Марк (Fisher Marc). Есть ли перспектива у нейропротекции? // Міжнародн. неврол. журнал. — 2014. — № 6. — С. 103–106.
5. Adibhatla R.M., Hataher J.F. Lipid oxidation and peroxidation iCNS health and disease: from molecular mechanisms to therapeutic opportunities // Antiox. Redox Signal. — 2010. — 12. — 125–169.
6. Amarenco P., Hauw J.–J. Cerebellar infarction in the territory of the superior cerebellar artery: a clinicopathologic study of 33 cases // Neurology. — 1990. — 40. — 1383–1390.
7. Babinski J. Asynergie et inertie cérébelleuse // Rev. Neurol. — 1906. — 14. — 685–686.
8. Babinski J. Sur le rôle du cervelet dans les actes volitionnels nécéssitant une succession rapide de mouvements (diadococinésie) // Rev. Neurol. — 1902. — 10. — 1013–1015.
9. Baier B., Stoeter P., Dieterich M. Anatomical correllates of ocular motor deficits in cerebellar lesions // Brain. — 2009. — 132. — 2114–2124.
10. Bastian A.J. Cerebellar limb ataxia: Abnormal control of self–generated and external forces // An. N. J. Acad. Sci. — 2002. — 978. — 16–27.
11. Bolddauf J., Oertel J., Gaab M.R. et al. Endoscopic third ventriculostomy for occlusive hydrocephalus caused by cerebellar infarction // Neurosurgery. — 2006. — Vol. 59. — P. 539–544.
12. Charlson F.E., Pompei P., Ales K.I. et al. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation // J. Chronic. Dis. — 1987. — 40. — 373–383.
13. Deluca C., Tinnazzi M., Bovi P. et al. Limb ataxia and proximal intracranial territory brain infarcts: clinical and topographical correlations // J. Neurosurg Psychiatry. — 2007. — 78. — 832–835.
14. Dietrichs E. Clinical manifestation of focal cerebellar disease as related to the organization of neuron pathways // Acta Neurol. Scand. Suppl. — 2008. — 188. — 6–11.
15. Elmlinger M.W., Kriebel M., Ziegler D. Neuroprotective and anti–oxidative effects of the hemodialysate actovegin on primary rat neurons in vitro // Neuromolecuar. — 2011. — 13(4). — 266–274.
16. Grips E., Sedlaczek O., Bazner H. et al. Supratentorial age–related white matter changes predict outcome in cerebellar stroke // Stroke. — 2005. — 36. — 1988–1993.
17. Grodd W., Hulsmann E., Ackerman H. Functional MRI localizing in the cerebellum // Neurosurg. Clin. N. Am. — 2005. — 16. — 77–99.
18. Guidelines for Management of Ischemic Stroke and Transient Ischemic Attack (European Stroke Organization (ESO) Executive Committee and the ESO Writing Committee // Cerebrovasc. Dis. — 2008. — 25. — 457–507.
19. Holmes G. The symptoms of acute cerebellar injuries due to gunshot injuries. // Brain. — 1917. — Vol. 40. — P. 463–535.
20. Juttler E. Expansive cerebellar stroke–how to detect and treat? // 14th Congress of the European Federation of Neurological Societies Geneva, Switzerland, September 28–30, Teaching Course 3, 2010. — P. 1–22.
21. Karaci R., Ozturk S., Ozbakir S. et al. Evaluation of language functions in acute cerebellar vascular diseases // J. Stroke Cerebrovasc. Dis. — 2008. — 17. — 251–256.
22. Kelly P.J., Stein J., Shafgat S. et al. Functional recovery after rehabilitation for cerebellar stroke // Stroke. — 2001. — 32. — 530–534.
23. Kohrman M., Sauer R., Hagen B. et al. MRI mismatch–based intravenous thrombolysis for isolated cerebellar infarction // Stroke. — 2009. — 40. — 1897–1899.
24. Konczak J., Pierscihanek D., Hirsiger S. et al. Recovery of upper limb function after cerebellar stroke // Stroke. — 2010. — 41. — 2191–2200.
25. Lee H., Yi H.A., Cho Y.W. et al. Nodulus infarction mimi–cking acute peripheral vestibulopathy // Neurology. — 2003. — 60. — 1700–1702.
26. Lyden P., Trott T., Tilley B. et al. Improved reliability of the NIN Stroke Scale using video training. NINDS tPA Stroke Study Group // Stroke. — 1994. — 25. — 2220–2226.
27. Mohoney F., Barthel D. Functional evolution: the Barthel Index // MD State Med. J. — 1965. — 14. — 61–65.
28. Nitsche M.F., Kleinschmidt A., Wessel K. et al. Somatotopic motor representation in the human anterior cerebellum. A high–resolution functional MRI study // Brain. — 1996. — 119. — 1023–1029.
29. Ogawa K., Suzuki J., Kamel S. et al. A case of cerebellar infarction with pure dysarthria // Rinsho Shinkligaku. — 2004. — 44. — 11–113.
30. Rankin J. Cerebral vascular accidents in patients over the age of 60: prognosis // Scott. Med. J. — 1997. — 2. — 200–215.
31. Sander T., Sprenger A., Neumann G. et al. Vergence deficits in patients with cerebellar lesions // Brain. — 2009. — 132. — 103–115.
32. Schellinger P.O., Thomalla G., Fiehler J. et al. MRI–based and CT–based thrombolytic therapy in acute stroke within and beyond established time windows: An analysis of 1210 patients // Stroke. — 2007. — 36. — 2640–2645.
33. Schmahmann J.D. Disorders of the cerebellum. Ataxia, dysmetria of thought, and the cerebellar cognitive affective syndrome // Journal of Neuropsychiatry and Clinical Neurosciences. — 2004. — 16. — 367–378.
34. Schmahmann J.D., MacMore J. Jange M. Cerebellar stroke without motor deficit: Clinical evidence for motor and non–motor domains within the human cerebellum // Neuroscience. — 2009. — 162. — 852–861.
35. Secades J.J., Lorenzo J.L. Citicoline: pharmacological and clinical review // Methods Find Exp. Clin. Pharmacol. — 2006. — 28, Suppl. B. — 1–56.
36. The NINDS rt–Pa stroke study group. Intracerebral hemorrhage after intravenous rt–PA therapy for ischemic stroke // Stroke. — 1997. — 28. — 2109–2118.
37. Timmann D., Konczak J., Donchin W. et al. Current advances in lesion–symptom mapping of the human cerebellum // Neuroscience. — 2009. — 162. — 836–851.
38. Tohgi H., Takahashi S., Chiba K. et al. Cerebellar infarction. Clinical and neuromaging analysis in 293 patients. The Tohoku cerebellar infarction study group // Stroke. — 1993. — 24. — 1697–1701.
39. Trouillas P., Takayanagi T., Hallet M. et al. International Cooperative Ataxia Rating Scale for pharmacological assessment of the cerebellar syndrome // J. Neurol. Science. — 1997. — 145. — 205–211.
40. Ye B.S., Kim J.D., Nam H.S. et al. Clinical manifestations of cerebellar infarcts according to specific lobular involvement // Cerebellum. — 2010. — 9. — 571–579.

/77/77.jpg)