Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Синегнойная палочка: современные реальности антибактериальной терапии
Авторы: Харченко Л.А. — Украинский медицинский центр интенсивной терапии сепсиса; кафедра анестезиологии и интенсивной терапии НМАПО им. П.Л. Шупика
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
В статье проведен анализ антибиотикорезистентности синегнойной палочки. Изложены собственные наблюдения резистентности синегнойной палочки к антисинегнойным антибиотикам, проведенные в Украинском медицинском центре интенсивной терапии сепсиса.
Все исследованные штаммы были мультирезистентны, а больные, среди которых проводилось исследование, ранее длительное время находились в различных лечебных учреждениях.
На сегодняшний день только коломицин является препаратом, к которому синегнойная палочка имеет высокую антибиотикочувствительность.
У статті проведено аналіз антибіотикорезистентності синьогнійної палички. Викладено власні спостереження резистентності синьогнійної палички до антисиньогнійних антибіотиків, проведені в Українському медичному центрі інтенсивної терапії сепсису.
Усі досліджені штами були мультирезистентні, а хворі, серед яких проводилося дослідження, раніше тривалий час перебували в різних лікувальних установах.
На сьогодні тільки коломіцин є препаратом, до якого синьогнійна паличка має високу антибіотикочутливість.
The article presents an analysis of antibiotic resistance to Pseudomonas aeruginosa. Our own observations on Pseudomonas aeruginosa resistance to antipseudomonal antibiotics, carried out in Ukrainian medical center of intensive care for sepsis, are provided.
All investigated strains were multiresistant, and patients, which were surveyed, previously were for a long time in various hospitals.
To date, only colomycin is a drug, to which Pseudomonas aeruginosa has a high antibiotic sensitivity.
Статья опубликована на с. 164-168
Антибиотики — чрезвычайно важные лекарственные средства для борьбы с бактериальными инфекциями. Введение в медицинскую практику слова «антибиотик» совпало с открытием первого аминогликозида стрептомицина в 1944 году и принадлежит лауреату Нобелевской премии профессору С.Д. Ваксману. После внедрения антибактериальных препаратов в практическую медицину они стали рассматриваться как медикаменты, способные излечивать все проблемные инфекционные заболевания.
В раннюю эру их применения зачастую смертельные туберкулез и сепсис, пневмония, менингиты и др. лечились с применением бензилпенициллина и стрептомицина. Применяя эти антибиотики, хирургия значительно расширила свои возможности в борьбе с гнойно-воспалительными заболеваниями.
Но микроорганизмы эволюционировали, быстро вырабатывая новые механизмы устойчивости к постоянно появляющимся в клинической практике антибактериальным средствам. И уже через 6 лет после начала применения бензилпенициллина, в 1943 г., в британских лечебных учреждениях стали регистрировать более 50 % пенициллинрезистентных стафилококков.
На сегодняшний день для лечения большинства внебольничных бактериальных инфекций еще есть высокоактивные антибиотики, но ситуация с внутрибольничными полирезистентными микробами гораздо плачевнее.
Общество инфекционных болезней Америки определило 6 ключевых, проблемных в плане чрезмерного распространения в стационарах и широкой устойчивости к антибиотикам нозокомиальных патогенов: Pseudomonas aeruginosa, Acinetobacter baumannii, метициллинрезистентный Staphylococcus aureus (MRSA), ванкомицинрезистентный Enterococcus faecium и продуцирующие бета-лактамазы расширенного спектра энтеробактерии (преимущественно Escherichia coli и Klebsiella spp.).
Мировое сообщество предполагало широкое распространение грамположительной микробиологической флоры, и особенно метициллинрезистентной. Были выведены на фармацевтический рынок: ванкомицин и тейкопланин, даптомицин, линезолид, тигециклин и цефалоспорин V поколения (зинфоро).
Что касается инфекций, вызванных грам-отрицательной микробиологической флорой, то спектр препаратов для их лечения значительно ограничен. Лидером по непобедимости является синегнойная палочка. Хочется напомнить, что же представляет собой синегнойная палочка.
Синегнойная палочка — грамотрицательная бактерия, крайне нетребовательная к условиям существования. Она обладает множеством факторов патогенности, устойчива к целому ряду широко применяемых антибиотиков (например, к пенициллинам без антисинегнойной активности, макролидам, тетрациклинам, хлорамфениколу, ко-тримоксазолу и т.д.) и вызывает инфекции преимущественно у тяжелобольных и иммунокомпрометированных пациентов. Данный микроорганизм характеризуется повсеместным распространением в окружающей среде, особенно в местах скопления влаги, выделяясь из почвы, воды и растений. В условиях стационара синегнойная палочка способна колонизировать влажные участки тела пациентов (промежность, подмышечные впадины, ушные раковины, слизистые оболочки полости носа, ротоглотки, желудочно-кишечный тракт). В среднем частота колонизации госпитализированных пациентов варьирует от 2,6 до 24,0 %, значительно возрастая на фоне проводимой пациентам антибактериальной терапии. Однако наиболее значима колонизация синегнойной палочкой поверхностей объектов окружающей среды стационаров и применяемого лечебно-диагностического оборудования, а также кожи, слизистых и униформы медицинского персонала. Так, согласно данным Agodi et al., экзогенный источник является причиной по меньшей мере 59,5 % колонизаций и инфекций, вызванных синегнойной палочкой, у пациентов ОРИТ.
Благодаря своему широкому распространению в окружающей среде стационаров и постоянному воздействию антибиотиков и дезинфектантов («селективный прессинг») сегодня нозокомиальные изоляты синегнойной палочки демонстрируют практически все известные механизмы устойчивости к антиинфекционным препаратам. Это создает значительные трудности при выборе адекватной эмпирической терапии полирезистентной синегнойной инфекции, приводя к росту летальности, увеличению длительности госпитализации, множественным инвазивным лечебно-диагностическим вмешательствам и экономическим потерям.
Изоляты синегнойной палочки являются мультирезистентными, если они демонстрируют устойчивость по меньшей мере к одному антибактериальному препарату в 3 и более категориях антибиотиков; чрезмерно резистентными, если имеется устойчивость по крайне мере к 1 препарату во всех категориях, за исключением одной-двух; и панрезистентными, если изолят демонстрирует устойчивость ко всем антибиотикам во всех категориях антимикробных препаратов. В данной публикации мы рассмотрим возможности антибактериальной терапии мульти- и чрезмерно резистентных инфекций, вызванных синегнойной палочкой.
Как правило, антибактериальная терапия начинается эмпирически. Выбор антибактериального препарата для терапии нозокомиальной синегнойной инфекции должен основываться на данных микробиологического паспорта, а также на наличии у пациента факторов риска инфицирования мультирезистентными возбудителями.
Факторы риска инфицирования множественно устойчивыми изолятами синегнойной палочки значительно варьируют в зависимости от изучаемой когорты пациентов и особенностей функционирования системы инфекционного контроля в стационарах. По данным проведенных исследований, наиболее часто встречались следующие факторы риска: предшествующее применение у данного пациента антибактериальных препаратов в ближайшие 2 недели — 6 месяцев, наличие колонизации/инфекции синегнойной палочкой в ближайшие 6–12 месяцев, длительность госпитализации, нахождение в ОРИТ, искусственная вентиляция легких, использование мочевых катетеров и др., вторичные иммунодефициты любого генеза и т.д.
Следует отметить, что в случае превалирования в отдельно взятом стационаре мультирезистентных форм синегнойной палочки эмпирический выбор антибактериального препарата крайне затруднен, так как данный возбудитель способен демонстрировать самые непредсказуемые фенотипы устойчивости. В этом случае особую значимость приобретает локальный микробиологический мониторинг распространения резистентных изолятов возбудителя.
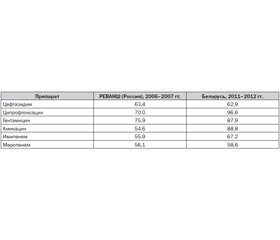
По данным микробиологического мониторинга 2006–2007 гг. в России, а также более позднего, 2011–2012 гг., проведенного в Белоруссии, можно сделать вывод, что резистентность синегнойной палочки к вышеприведенным антибиотикам довольно высока — более 50 % и с годами увеличилась в среднем на 21 % (табл. 1). Авторы, проводившие исследование в Белоруссии в 2011–2012 гг., отмечают отсутствие резистентности к полимиксинам.
В Украинском центре интенсивной терапии сепсиса (УМЦИТС) на протяжении более 20 лет проводится микробиологический мониторинг изолятов, выделенных в центре из различных сред: крови, мочи, ран и др., что дает важную информацию для рациональной антибиотикотерапии как эмпирически, так и с учетом высеянной микробиологической флоры.
На основе микробиологических и клинических данных регулярно изменялся перечень антибиотиков, чувствительность к которым определялась приоритетно.
Определение микробиологической чувствительности в центре в основном происходит диск-диффузионным методом, что позволяет менять приоритеты определения микробиологической чувствительности актуальных антибиотиков.
Антибиотикочувствительность Ps.аur. в УМЦИТС, 2013 г., п127:
Имипенем — 71,5 %
Меропенем — 54,3 %
Дорипенем— 49,7 %
Цефтазидим — 73,1 %
Цефоперазон — 69,2 %
Цефепим — 78,0 %
Ципрофлоксацин — 88,9 %
Левофлоксацин — 68,8 %
Амикацин — 54,3 %
Полимиксин Е (коломицин) — 7,3 %
Необходимо отметить, что чувствительность изолятов определялась у так называемых проблемных больных, т.е. тех, которые уже длительное время находились в тех или иных лечебных учреждениях и не получали клинического эффекта от антибиотикотерапии.
Получив ответ баклаборатории о микробиологической чувствительности изолятов, необходимо сделать вывод о монотерапии или комбинированной антибиотикотерапии, однако единственным приоритетным противовоспалительным препаратом является коломицин.
Преимущество комбинированной терапии заключается в возможном синергизме при использовании нескольких антибиотиков с разным механизмом действия, предотвращении развития резистентности в процессе антибиотикотерапии. Очень часто мы проводим адекватную эмпирическую терапию, если известна антибиотикочувствительность патогена.
С учетом возрастающего значения мультирезистентности нозокомиальных возбудителей в наших стационарах абсолютно оправданна тактика деэскалационной терапии. Деэскалация представляет собой стратегию антимикробной терапии, при которой вначале назначается препарат (препараты) с максимально широким спектром антибактериальной активности для данной клинической ситуации, а в дальнейшем, после получения результатов микробиологического исследования, происходит смена терапии на антибиотики более узкого спектра действия [30]. Помимо того что деэскалационная стратегия антибактериальной терапии является экономически выгодной, она ограничивает селективный прессинг и вероятность суперинфицирования другими мультирезистентными микроорганизмами.
В случае синегнойной инфекции крайне важным моментом является соблюдение длительности антибиотикотерапии, так как неадекватная продолжительность лечения может привести к развитию резистентности in vivo, неэффективности или клиническому рецидиву инфекции.
Рекомендуемая длительность антибактериальной терапии синегнойной инфекции в зависимости от локализации процесса:
1. Инфекции кровотока — от 7–10 дней в случае катетер-ассоциированной бактериемии и удаления контаминированного источника, до 14 дней и более у пациентов с нейтропенией (до устранения агранулоцитоза).
2. Инфекционный эндокардит — от 6 недель (в зависимости от тяжести поражения).
3. Инфекции нижних дыхательных путей — 14–21 день.
4. Инфекции кожи и мягких тканей — 10–14 дней. Инфекции костей и суставов — до 6 недель.
5. Инфекции ЦНС — от 3 недель и более (в зависимости от тяжести поражения и нозологической формы).
6. Инфекции мочевой системы: цистит — 5 дней; пиелонефрит, уросепсис — 14–21 день, паранефральный абсцесс — 28 дней.
При антибактериальной терапии полирезистентных нозокомиальных инфекций крайне важно учитывать и целенаправленно использовать данные о фармакокинетике и фармакодинамике антибактериальных препаратов. В случае промежуточной устойчивости микроорганизма к антибиотикам максимальные дозировки препарата либо модификация режима его введения позволяют с большой вероятностью достигнуть эрадикации возбудителя и выздоровления пациента. Особенно это значимо для пациентов в критическом состоянии, у которых в результате целого ряда патофизиологических сдвигов (отеки, гипоальбуминемия, низкий гематокрит, повышенная проницаемость сосудистого русла, нарушения функции печени и почек) и проводимой интенсивной терапии (большие объемы инфузионной терапии, полипрагмазия, искусственная вентиляция легких) фармакокинетика препарата и так может значительно отличаться от описываемой в инструкции к лекарственному средству.
Далее мы рассмотрим отдельные группы потенциально активных антипсевдомонадных препаратов с позиций последних исследований особенностей их фармакокинетики и фармакодинамики.
Среди бета-лактамных антибиотиков относительно перспективными препаратами для лечения мультирезистентной синегнойной инфекции остаются цефалоспорины III поколения с антисинегнойной активностью — цефтазидим, цефоперазон и цефоперазон/сульбактам, так как часть изолятов P.aeuginosa, выделенных в Центре лечения сепсиса, демонстрировали устойчивость к карбапенемам и были чувствительными только к коломицину и полимиксинам.
Антипсевдомонадная активность цефоперазона считается сопоставимой с цефтазидимом, хотя данных литературы относительно его клинической эффективности в отношении синегнойных инфекций накоплено меньше. Определенным преимуществом в терапии синегнойной инфекции может обладать цефоперазон/сульбактам, особенно в случае превалирования у циркулирующих изолятов продукции бета-лактамаз, которые ингибируются сульбактамом. Согласно данным исследований in vitro, цефоперазон/сульбактам в комбинации с другими антибиотиками демонстрирует синергизм и может быть эффективным даже в отношении резистентных штаммов синегнойной палочки.
В настоящее время в стационарах СНГ наблюдается крайне высокий уровень устойчивости синегнойной палочки к фторхинолонам, поэтому в монотерапии данная группа препаратов может использоваться только после подтверждения чувствительности к ним изолятов P.aeruginosa in vitro.
Применение аминогликозидов в виде монотерапии возможно лишь для лечения неосложненной синегнойной инфекции мочевыводящих путей при подтвержденной чувствительности к данной группе препаратов in vitro (в связи с высокой частотой приобретенной устойчивости). Учитывая разный субстратный профиль аминогликозид-модифицирующих ферментов, продуцируемых возбудителем, рекомендуется определять чувствительность P.aeruginosa к каждому из аминогликозидов одновременно. Рекомендуемые режимы дозирования амикацина: 1 г 1 р/сут.
В связи с повсеместным распространением в стационарах различных стран чрезвычайно устойчивых изолятов грамотрицательных бактерий, демонстрирующих нечувствительность ко всем бета-лактамам, фторхинолонам и аминогликозидам, чрезвычайный интерес для клиницистов вновь представляет коломицин (колистин). В настоящее время к данному антибиотику сохраняется практически 93% чувствительность у целого ряда проблемных патогенов, включая чрезвычайно устойчивые изоляты синегнойной палочки. По данным Украинского медицинского центра интенсивной терапии, сегодня лечение мультирезистентной синегнойной инфекции представляет огромную проблему уже не только для врачей отделений реанимации и интенсивной терапии, но и для врачей хирургических, урологических, травматологических и даже терапевтических отделений. Только использование всего комплекса подходов к рациональной антибактериальной терапии тяжелобольных пациентов с множественно устойчивыми инфекциями, вызванными P.aeruginosa, может помочь не допустить дальнейшего роста антибиотикоустойчивости патогена и сохранить активными оставшиеся антипсевдомонадные препараты.
1. Dalfino L. et al. High-dose, extended-interval colistin admi-nistration in critically ill patients: is this the right dosing strategy? A preliminary study / L. Dalfino et al. // Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. — 2012. — Vol. 54, № 12. — P. 1720–1726.
2. Couet W. et al. Colistin pharmacokinetics: the fog is lifting / W. Couet et al. // Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases. — 2012. — Vol. 18, № 1. — P. 30–39.
3. Calfee D.P. Crisis in hospital-acquired, healthcare-associated infections / D.P. Calfee // Annual review of medicine. — 2012. — Vol. 63. — P. 359–371.
4. Plachouras D. et al. Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with infections caused by gram-negative bacteria / D. Plachouras et al. // Antimicrobial agents and chemotherapy. — 2009. — Vol. 53, № 8. — P. 3430–3436.
5. Bergen P.J. et al. Synergistic killing of multidrug-resistant Pseudomonas aeruginosa at multiple inocula by colistin combined with doripenem in an in vitro pharmacokinetic/pharmacodynamic model / P.J. Bergen et al. // Antimicrobial agents and chemotherapy. — 2011. — Vol. 55, № 12. — P. 5685–5695.
6. Mena K.D. & Gerba C.P. Risk assessment of Pseudomonas aeruginosa in water / K.D. Mena, C.P. Gerba // Reviews of Environmental Contamination and Toxicology. — 2009. — Vol. 201. — P. 71–115.
7. Park Y.S. et al. Acquisition of extensive drug-resistant Pseudomonas aeruginosa among hospitalized patients: risk factors and resistance mechanisms to carbapenems / Y.S. Park et al. // The Journal of hospital infection. — 2011. — Vol. 79, № 1. — P. 54–58
8. Blanc D.S. Francioli P. & Zanetti G. Molecular Epidemiology of Pseudomonas aeruginosa in the Intensive Care Units — A Review / D.S. Blanc, P. Francioli, G. Zanetti // The Open Microbiology Journal. — 2007. — Vol. 1. — P. 8–11.
9. Boyer A. et al. Pseudomonas aeruginosa acquisition on an intensive care unit: relationship between antibiotic selective pressure and patients’ environment / A. Boyer et al. // Critical Care (London, England). — 2011. — Vol. 15, № 1. — P. R55.
10. Agodi A. et al. Pseudomonas aeruginosa carriage, colonization, and infection in ICU patients / A. Agodi et al. // Intensive Care Medicine. — 2007. — Vol. 33, № 7. — P. 1155–1161.
11. Poole K. Pseudomonas aeruginosa: resistance to the max / K. Poole // Frontiers in Microbiology. — 2011. — Vol. 2. — P. 65.
12. Aloush V. et al. Multidrug-resistant Pseudomonas aeruginosa: risk factors and clinical impact / V. Aloush et al. // Antimicrobial Agents and Chemotherapy. — 2006. — Vol. 50, № 1. — P. 43–48.
13. Giske C.G. et al. Clinical and economic impact of common multidrug-resistant gram-negative bacilli / C.G. Giske et al. // Antimicrobial agents and chemotherapy. — 2008. — Vol. 52, № 3. — P. 813–821.
14. Paterson D.L. Impact of antibiotic resistance in gram-negative bacilli on empirical and definitive antibiotic therapy / D.L. Paterson // Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. — 2008. — Vol. 47, suppl 1. — P. S14–20.
15. Magiorakos A.-P. et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance / A.-P. Magiorakos et al. // Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases. — 2012. — Vol. 18, № 3. — P. 268–281.
16. Peña, C. et al. Carbapenem-resistant Pseudomonas aeruginosa: factors influencing multidrug-resistant acquisition in non-critically ill patients / C. Peña et al. // European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. — 2009. — Vol. 28, № 5. — P. 519–522.
17. Rossolini G.M. & Mantengoli E. Treatment and control of severe infections caused by multiresistant Pseudomonas aeruginosa / G.M. Rossolini, E. Mantengoli // Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. — 2005. — Vol. 11, suppl. 4. — P. 17–32.
18. Kumar A. et al. A survival benefit of combination antibiotic therapy for serious infections associated with sepsis and septic shock is contingent only on the risk of death: a meta-analytic/meta-regression study / A. Kumar et al. // Critical care medicine. — 2010. — Vol. 38, № 8. — P. 1651–1664.
19. Traugott K.A. et al. Monotherapy or combination therapy? The Pseudomonas aeruginosa conundrum / K.A. Traugott et al. // Pharmacotherapy. — 2011. — Vol. 31, № 6. — P. 598–608.
20. Pankuch G.A. et al. Activity of meropenem with and without ciprofloxacin and colistin against Pseudomonas aeruginosa and Acinetobacter baumannii / G.A. Pankuch et al. // Antimicrobial agents and chemotherapy. — 2008. — Vol. 52, № 1. — P. 333–336.
21. Bergen P.J. et al. Clinically relevant plasma concentrations of colistin in combination with imipenem enhance pharmacodynamic activity against multidrug-resistant Pseudomonas aeruginosa at multiple inocula / P.J. Bergen et al. // Antimicrobial agents and chemotherapy. — 2011. — Vol. 55, № 11. — P. 5134–5142.
22. Gunderson, B.W. et al. Synergistic activity of colistin and ceftazidime against multiantibiotic-resistant Pseudomonas aeruginosa in an in vitro pharmacodynamic model / B.W. Gunderson et al. // Antimicrobial agents and chemotherapy. — 2003. — Vol. 47, № 3. — P. 905–909.
23. Llanes C. et al. Clinical strains of Pseudomonas aeruginosa overproducing MexAB-OprM and MexXY efflux pumps simultaneously / C. Llanes et al. // Antimicrobial Agents and Chemotherapy. — 2004. — Vol. 48, № 5. — P. 1797–1802.
24. Nicasio A.M. et al. Population pharmacokinetics of high-dose, prolonged-infusion cefepime in adult critically ill patients with ventilator-associated pneumonia / A.M. Nicasio et al. // Antimicrobial Agents and Chemotherapy. — 2009. — Vol. 53, № 4. — P. 1476–1481.
25. Talbot G.H. et al. Bad bugs need drugs: an update on the development pipeline from the Antimicrobial Availability Task Force of the Infectious Diseases Society of America / G.H. Talbot et al. // Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. — 2006. — Vol. 42, № 5. — P. 657–668.

/165/165.jpg)