Журнал «Актуальная инфектология» 1 (6) 2015
Вернуться к номеру
Сравнительная оценка динамики показателей клеточного иммунитета под влиянием различных видов терапии хронического приобретенного токсоплазмоза
Авторы: Боброва О.В., Ануар Аль Хатиб – Харьковская медицинская академия последипломного образования
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Статья посвящена сравнительной оценке динамики показателей клеточного иммунитета организма больных под влиянием различных видов терапии хронического приобретенного токсоплазмоза (ХПТ). Эффективность комплексного лечения с использованием антипротозойного комбинированного препарата пириметамин + сульфадоксин изучена через 1 и 5–6 месяцев от начала лечения. Через 1 месяц от начала лечения пириметамином + сульфадоксином отмечено достоверное повышение содержания CD4+ (p < 0,01), CD16+ (p < 0,05) и снижение уровня специфических IgG к токсоплазме (p < 0,05). Через 6 месяцев от начала лечения выявлено повышение содержания CD3+ (p < 0,05), CD4+ (p < 0,001), CD8+ (p < 0,001), CD16+ (p < 0,001), фагоцитарного индекса (p < 0,05), снижение уровня циркулирующих иммунных комплексов (ЦИК) с 3,5 % ПЭГ (p < 0,01) и с 7 % ПЭГ (p < 0,001), лимфоцитотоксических аутоантител (p < 0,01) и специфических IgG к токсоплазме (p < 0,001). Эти данные могут свидетельствовать о значительной инерционности гомеостатической перестройки системы иммунитета под влиянием антипротозойной терапии. При изучении эффективности комбинированной терапии (пириметамин + сульфадоксин и специфический иммуноглобулин против T.gondii человека) среди иммунологических показателей через 1 месяц от начала лечения установлено достоверное увеличение в сравнении с исходными данными содержания CD16+ (p < 0,001), IgА (p < 0,001) и снижение уровня специфических IgG к токсоплазме (p < 0,001). Через 6 месяцев наблюдения выявлено в сравнении с исходными данными увеличение содержания CD3+ (p < 0,01), CD4+ (p < 0,001), CD8+ (p < 0,01), а также снижение уровней ЦИК с 3,5 % ПЭГ (p < 0,001) и с 7 % ПЭГ (p < 0,05), лимфоцитотоксических аутоантител (p < 0,001), IgА (p < 0,05), IgМ (p < 0,05), IgE (p < 0,01) и IgG к токсоплазме (p < 0,001). Комбинированная терапия ХПТ в стадии обострения заболевания оказывает существенное влияние на нормализацию всех звеньев иммунологического гомеостаза организма больных. При этом максимум такого действия проявляется через 6 месяцев от начала лечения. При изучении эффективности терапии специфическим иммуноглобулином против T.gondii человека при анализе динамики показателей иммунитета через 1 месяц от начала иммуноглобулинотерапии выявлено лишь достоверное увеличение содержания CD8+ (p < 0,05) и снижение соотношения CD4+/CD8+ (p < 0,05). Через 6 месяцев от начала лечения установлено в сравнении с исходными значениями достоверное повышение содержания CD4+ (p < 0,001), CD8+ (p < 0,001), CD4+/CD8+ (p < 0,001), CD16+ (p < 0,05), фагоцитарного индекса (p < 0,001) и снижение уровня ЦИК с 3,5 % ПЭГ (p < 0,05), лимфоцитотоксических аутоантител (p < 0,001), IgG к токсоплазме (p < 0,001) и IgE (p < 0,05).
Анализ комплексной оценки степени динамики показателей иммунитета с помощью средних значений
t-критерия в зависимости от вида терапии показал, что через 1 месяц от начала лечения только комбинированная терапия выявила достоверную (t = 3,19; p < 0,01) динамику по их нормализации. Применение монотерапии пириметамином + сульфадоксином (t = 1,25; p > 0,05) и иммуноглобулинотерапии (t = 1,75; p > 0,05) вызвало лишь тенденцию к нормализации показателей. Через 6 месяцев от начала лечения выраженная динамика отмечалась у больных, получавших комбинированную терапию (t = 5,5; p < 0,001), умеренная — при иммуноглобулинотерапии (t = 3,68; p < 0,01) и незначительная — в группе больных, пролеченных пириметамином + сульфадоксином (t = 2,91; p < 0,01).
Наивысший иммунологический эффект при лечении больных ХПТ в стадии обострения принадлежал комбинированной терапии. Терапия специфическим иммуноглобулином против T.gondii человека заняла промежуточное место, а терапия пириметамином + сульфадоксином выявила наименьшую эффективность.
Стаття присвячена порівняльній оцінці динаміки показників клітинного імунітету організму хворих під впливом різних видів терапії хронічного набутого токсоплазмозу (ХНТ). Ефективність комплексного лікування з використанням комбінованого антипротозойного препарату піриметамін + сульфадоксин вивчена через 1 і 5–6 місяців від початку лікування. Через 1 місяць від початку лікування піриметаміном + сульфадоксином відзначено вірогідне підвищення вмісту CD4+ (p < 0,01), CD16+
(p < 0,05) і зниження рівня специфічних IgG до токсоплазми (p < 0,05). Через 6 місяців від початку лікування виявлено підвищення вмісту CD3+ (p < 0,05), CD4+ (p < 0,001), CD8+ (p < 0,001), CD16+ (p < 0,001), фагоцитарного індексу (p < 0,05), зниження рівня ЦІК із 3,5 % ПЕГ (p < 0,01) і з 7 % ПЕГ (p < 0,001), лімфоцитотоксичних автоантитіл (p < 0,01) і специфічних IgG до токсоплазми (p < 0,001). Ці дані можуть свідчити про значну інерційність гомеостатичної перебудови системи імунітету під впливом антипротозойної терапії. При вивченні ефективності комбінованої терапії (піриметамін + сульфадоксин та специфічний імуноглобулін проти T.gondii людини) серед імунологічних показників через 1 місяць від початку лікування встановлено вірогідне збільшення порівняно з вихідними даними вмісту CD16+ (p < 0,001), IgА (p < 0,001) і зниження рівня специфічних IgG до токсоплазми (p < 0,001). Через 6 місяців спостереження виявлено порівняно з вихідними даними збільшення вмісту CD3+ (p < 0,01), CD4+ (p < 0,001), CD8+ (p < 0,01), а також зниження рівнів ЦІК із 3,5 % ПЕГ
(p < 0,001) і з 7 % ПЕГ (p < 0,05), лімфоцитотоксичних автоантитіл (p < 0,001), IgА (p < 0,05), IgМ (p < 0,05), IgЕ
(p < 0,01) і IgG до токсоплазми (p < 0,001). Комбінована терапія ХНТ у стадії загострення захворювання суттєво впливає на нормалізацію всіх ланок імунологічного гомеостазу організму хворих. До того ж максимум такої дії проявляється через 6 місяців від початку лікування. При вивченні ефективності терапії специфічним імуноглобуліном проти T.gondii людини при аналізі динаміки показників імунітету через 1 місяць від початку імуноглобулінотерапії виявлено лише вірогідне збільшення вмісту CD8+ (p < 0,05) і зниження співвідношення CD4+/CD8+ (p < 0,05). Через 6 місяців від початку лікування встановлено порівняно з вихідними значеннями вірогідне підвищення вмісту CD4+
(p < 0,001), CD8+ (p < 0,001), CD4+/CD8+ (p < 0,001), CD16+ (p < 0,05), фагоцитарного індексу (p < 0,001) і зниження рівня ЦІК із 3,5 % ПЕГ (p < 0,05), лімфоцитотоксичних автоантитіл (p < 0,001), IgG до токсоплазми (p < 0,001) і IgЕ (p < 0,05).
Аналіз комплексної оцінки ступеня динаміки показників імунітету за допомогою середніх значень t-критерію залежно від виду терапії показав, що через 1 місяць від початку лікування тільки комбінована терапія виявила вірогідну (t = 3,19; p < 0,01) динаміку за їх нормалізацію. Застосування монотерапії піриметаміном + сульфадоксином (t = 1,25; p > 0,05) і імуноглобулінотерапії (t = 1,75; p > 0,05) викликало лише тенденцію до нормалізації показників. Через 6 місяців від початку лікування виражену динаміку відзначено у хворих, які одержували комбіновану терапію (t = 5,5; p < 0,001), помірну — при терапії імуноглобуліном (t = 3,68; p < 0,01) і незначну — у групі хворих, які були проліковані піриметаміном + сульфадоксином (t = 2,91; p < 0,01).
Найвищий імунологічний ефект при лікуванні хворих на ХНТ у стадії загострення належав комбінованій терапії. Терапія специфічним імуноглобуліном проти T.gondii людини зайняла проміжне місце, а терапія піриметаміном + сульфадоксином виявила найменшу ефективність.
The article presents a comparative evaluation of the dynamics of parameters of cell-mediated immunity in patients under the influence of different therapies for chronic acquired toxoplasmosis (CAT). Efficiency of complex treatment using antiprotozoal combined drug pyrimethamine + sulfadoxine has been studied in 1 and 5–6 months after starting treatment. After 1 month of initiation of treatment with pyrimethamine + sulfadoxine, a significant increase of CD4+ (p < 0.01), CD16+ (p < 0.05) and a decrease in the level of Toxoplasma-specific IgG antibodies (p < 0.05) were detected. After 6 months of initiation of treatment, we have revealed elevated levels of CD3+ (p < 0.05), CD4+ (p < 0.001), CD8+ (p < 0.001), CD16+ (p < 0.001), phagocytic index (p < 0.05), decreased level of circulating immune complexes (CIC) with 3.5% polyethylene glycol (PEG) (p < 0.01) and 7% PEG (p < 0.001), lymphocytotoxic autoantibodies (p < 0.01) and Toxoplasma-specific IgG antibodies (p < 0.001). These data may indicate a significant lag in homeostatic adjustment of the immune system under the influence of antiprotozoal therapy. When studying the effectiveness of combination therapy (pyrimethamine + sulfadoxine and specific immunoglobulin against T.gondii), among the immunological parameters after 1 month of starting treatment we have found a significant increase in content of CD16+ compared with baseline (p < 0.001), IgA (p < 0.001) and reduction in the level of Toxoplasma-specific IgG antibodies (p < 0.001). After 6 months of observation, we have detected an increase of CD3+ (p < 0.01), CD4+ (p < 0.001), CD8+ (p < 0.01) content in comparison with baseline, as well as lower levels of CIC with 3.5% PEG (p < 0.001) and 7% PEG (p < 0.05), lymphocytotoxic autoantibodies (p < 0.001), IgA (p < 0.05), IgM (p < 0.05), IgE (p < 0.01) and IgG antibodies to Toxoplasma (p < 0.001). Combination therapy for CAT in the acute stage of the disease has a significant impact on the normalization of all parts of immunological homeostasis. Such action was maximal in 6 months of starting treatment. When studying the effectiveness of the therapy with specific immunoglobulin against human T.gondii, when analyzing the dynamics of indicators of immunity in 1 month from the initiation of immunoglobulin therapy, we have revealed only a significant increase in CD8+ (p < 0.05) and a decrease in the ratio of CD4+/CD8+ (p < 0.05). After 6 months of starting treatment, we have established a significant increase of CD4+ (p < 0.001), CD8+ (p < 0.001), CD4+/CD8+ (p < 0.001), CD16+ (p < 0.05) levels, phagocytic index (p < 0.001) and a decrease of CIC content with 3.5% PEG (p < 0.05), lymphocytotoxic autoantibodies (p < 0.001), IgG to Toxoplasma (p < 0.001) and IgE (p < 0.05) in comparison with baseline.
Comprehensive assessment of the dynamics of immunity parameters using average values of t-test, depending on the type of therapy, showed that after 1 month from the initiation of treatment only combination therapy revealed significant (t = 3.19; p < 0.01) changes in their normalization. Application of pyrimethamine + sulfadoxine monotherapy (t = 1.25; p > 0.05) and immunoglobulin therapy (t = 1.75; p > 0.05) caused only a trend toward normalization of parameters. After 6 months of starting treatment, a pronounced dynamics was observed in patients received combination therapy (t = 5.5; p < 0.001), average — at immunoglobulin therapy (t = 3.68; p < 0.01) and a small one — in the group of patients treated with pyrimethamine + sulfadoxine (t = 2.91; p < 0.01).
Combination therapy had a highest immunological effect when treating patients in the acute stage of CAT. Treatment with T.gondii-specific immunoglobulin took an intermediate position, and therapy using pyrimethamine + sulfadoxine revealed the lowest efficiency.
больные хроническим приобретенным токсоплазмозом, диагностика, лечение, показатели клеточного иммунитета.
хворі на хронічний набутий токсоплазмоз, діагностика, лікування, показники клітинного імунітету.
patients with chronic acquired toxoplasmosis, diagnosis, treatment, parameters of cell-mediated immunity.
Статья опубликована на с. 45-52
Актуальность проблемы токсоплазмоза связана с его широкой распространенностью (при обследовании населения в различных странах мира с помощью серологических методов установлено, что инфицированность токсоплазмами населения земного шара колеблется в широких пределах — от 20 до 90 % и составляет от 500 млн до 1,5 млрд и более человек); полиморфизмом клинических проявлений и отсутствием патогномоничных симптомов, затрудняющими дифференциальную диагностику заболевания; поражением различных органов и систем; тесной связью между формами инфекционного процесса и состоянием иммунной системы инфицированного человека (по данным CDC, токсоплазмоз является основной причиной поражений нервной системы у больных ВИЧ-инфекцией); ролью этой инфекции в перинатальной патологии; ограниченностью методов подтверждения связи между наличием в организме человека токсоплазм и имеющимися клиническими проявлениями; невозможностью добиться санации организма с помощью известных сегодня методов терапии; отсутствием специфических методов профилактики [1, 3, 7].
В Украине по-прежнему остается сложной эпидемическая ситуация относительно токсоплазмоза, что проявляется большим количеством инвазированных людей, а также хронизацией течения данной инвазии [3, 4].
До настоящего времени в Украине, несмотря на имеющуюся систему обязательной регистрации больных токсоплазмозом, нет информации о соотношении инфицированных и заболевших различных возрастных групп [1, 7], а рекомендуемые в литературе критерии диагностики и методики терапии токсоплазмоза не всегда достаточно полно учитывают современные данные и опыт работы отечественных и зарубежных инфекционистов [1, 3].
Отсутствие универсальных схем лечения, неэффективность санации организма больных с помощью существующих сегодня методов лечения (антибиотики, химиопрепараты) диктуют необходимость обоснования индивидуального подхода к применению различных схем комплексной терапии данной инвазии.
Цель работы — сравнительная оценка степени динамики показателей клеточного иммунитета организма больных хроническим приобретенным токсоплазмозом (ХПТ) в стадии обострения до и после комплексной терапии — через 1 и 5–6 месяцев от начала лечения.
Для достижения поставленной цели нами проведено исследование иммунологических реакций 143 больных ХПТ в стадии обострения в возрасте от 18 до 75 лет (92 женщины и 51 мужчина), находившихся на стационарном лечении в Областной клинической инфекционной больнице г. Харькова.
Для сравнения и контроля было обследовано 40 (20 женщин и 20 мужчин) практически здоровых людей соответствующего возраста с отрицательными серологическими реакциями на токсоплазмоз. Наличие ХПТ у обследованных больных, а также отсутствие синдромосходных заболеваний (грипп, ОРВИ, гепатиты, ВИЧ-инфекция и другие) были строго верифицированы, и отсутствие ХПТ в контрольной группе подтверждено серологически.
У больных токсоплазмозом до лечения отмечались тенденция к снижению относительного содержания общего числа Т-лимфоцитов — CD3+ (p > 0,05), а также снижение их регуляторных субпопуляций — CD4-хелперов (p < 0,001) и CD8-супрессорных клеток (p < 0,001). Однако их соотношение (иммунорегуляторный индекс — CD4/CD8) выявило лишь тенденцию к увеличению (1,65 ± 0,04 против 1,54 ± 0,01; p > 0,05).
Для решения данного вопроса о степени отклонения вышеуказанных показателей от нормы были использованы среднеарифметические значения t-критерия [2, 5].
Выраженные отклонения от нормы выявлены в отношении снижения относительного числа CD4+ (t = 4,1; p < 0,001) и CD8+ (t = 5,3; p < 0,001).
Отмечалась тенденция к снижению относительного числа общего количества CD3+ (t = 1,43; p > 0,05), увеличению иммунорегуляторного индекса — соотношения CD4/CD8 (t = 1,31; p > 0,05), а также к снижению абсолютного числа CD3+ (t = 0,83; p > 0,05).
Это связано с тем, что токсоплазмы являются мощными индукторами антигенспецифических популяций Т-лимфоцитов — CD4+ и CD8+ [7, 9, 10].
При индивидуальном учете показателей Т-системы иммунитета была отмечена разнонаправленность их отклонений от норм.
Доминирующим видом отклонений было снижение содержания CD4+-хелперов и CD8+-супрессоров. При этом доля больных со снижением CD4+ (82,5 %) в 10,7 раза превосходила таковую с увеличением CD4+ (7,7 %; p < 0,001), а со снижением содержания CD8+ (86,7 %) — в 41,3 раза превышала долю больных с увеличением содержания CD8+ (2,1 %; p < 0,001). Cтепень снижения содержания CD8+ превосходила таковую в сравнении с CD4+, что отразилось на показателе иммунорегуляторного индекса, увеличение которого наблюдалось (20,9 %) в 3 раза чаще, чем его снижение (7 %; p < 0,001).
Что касается содержания общего числа Т-активных лимфоцитов (CD3+), то доля больных с отклонениями его значений была очень незначительной и составила 5,6 % в сторону увеличения и 3,5 % в сторону снижения (p > 0,05).
При сравнении ранговых структур частоты больных ХПТ с разнонаправленными отклонениями показателей Т-системы иммунитета от нормы выявлено, что наибольшие ранговые позиции в структурах отмечены в отношении содержания CD8+ (рис. 1). Так, если доля больных со снижением содержания CD8+ занимает первый ранг, то доля больных с повышенным содержанием CD8+ занимает последнее ранговое место.
/47/47.jpg)
Соответственно, ведущую роль в патогенезе реактивации хронического приобретенного токсоплазмоза занимает дефицит CD8+.
Комплексная оценка степени отклонения от нормы показателей Т-системы иммунитета больных ХПТ среднеарифметических значений t-критерия свидетельствовала, что в целом наблюдалось достоверное нарушение Т (t = 2,59; p < 0,05), а также В-систем иммунитета (t = 2,45; p < 0,05).
Следовательно, в стадии обострения хронического приобретенного токсоплазмоза отмечается дефицит цитотоксических клеток (CD8+), что, по-видимому, и приводит к размножению токсоплазм.
Вышеизложенное косвенно подтверждается данными литературы о связи любого инфекта, характеризующегося полиморфизмом клинических проявлений и протекающего в соответствии с особенностями состояния иммунной системы, когда уровень преморбидной иммунокомпрометации оказывает влияние на выраженность реактивности данной системы гомеостаза на внедрение чужеродного [13, 36, 39], с вовлечением в патологический процесс различных органов и систем.
На основании полученных данных при комплексной сравнительной оценке степени отклонения от нормативов показателей иммунной системы организма у больных ХПТ в стадии обострения до лечения выявлено, что наибольшая степень отклонения от нормативов принадлежит Т-системе иммунитета, что согласуется с литературными данными [1, 7, 9].
У больных ХПТ в стадии обострения отмечалась депрессия Т-системы иммунитета, в частности иммунорегуляторных Т-лимфоцитов — CD4+-хелперов и CD8+-супрессорных клеток в виде снижения их содержания в сыворотке крови.
Учитывая выявленные отклонения от нормы показателей параметров иммунологического гомеостаза больных ХПТ до лечения, исследовали характер динамики и возможность нормализации вышеуказанных показателей под влиянием комплексной терапии, проведя сравнительную оценку применяемых методов лечения.
Исследований динамики изучаемого комплекса параметров под влиянием лечения мы в литературных источниках не встречали, результаты же исследования отдельных параметров гомеостаза неоднородны.
В зависимости от вида лечения больные ХПТ были разделены на 3 группы.
В 1-ю группу вошли 45 больных, которым была назначена антипротозойная терапия специфическим антипротозойным комбинированным препаратом пириметамин +сульфадоксин.
Во 2-ю группу вошли 48 человек, получавших комбинированную антипротозойную терапию в сочетании со специфическим противотоксоплазмозным иммуноглобулином.
3-ю группу составили 50 больных, которым была назначена специфическая иммунотерапия иммуноглобулином против Toxoplasma gondii человека.
При ХПТ эффект от проведенной терапии оценивали не ранее чем через месяц после проведения комплексного курса лечения, а затем через 6 месяцев от начала лечения.
У пациентов 1-й группы через 1 месяц от начала лечения с использованием пириметамина + сульфадоксина достоверная динамика отмечена лишь в отношении CD4+-хелперов, содержание которых существенно повысилось (p < 0,01) по сравнению с исходными данными и составляло до лечения 31,3 ± 1,06 (p < 0,001) (значения контрольной группы — 39,20 ± 0,32), а через 1 месяц — 34,90 ± 0,75 (p < 0,001).
Тенденция к увеличению содержания выявлена в отношении общего числа Т-лимфоцитов — CD3+ (p > 0,05) (до лечения их содержание составляло 55,40 ± 1,04 (p > 0,05) (значение контрольной группы — 54,10 ± 1,89), а через 1 месяц — 58,50 ± 1,34 (p > 0,05)); CD8+-супрессорных клеток (до лечения — 21,00 ± 0,75 (p < 0,001) (значение контрольной группы — 25,60 ± 0,27), а через 1 месяц — 21,5 ± 0,6 (p < 0,001)), а также иммунорегуляторного индекса CD4+/CD8+ (p > 0,05) (до лечения — 1,54 ± 0,07 (p > 0,05) (значение контрольной группы — 1,54 ± 0,08), а через 1 месяц — 1,69 ± 0,08 (p > 0,05)).
Следует отметить, что содержание CD3+, CD4+ и CD8+ после проведенного курса лечения с высокой достоверностью отличалось от нормативов (p < 0,001).
Через 6 месяцев от начала терапии выявлено достоверное увеличение содержания CD3+ (p < 0,05) — 61,90 ± 0,96 (p < 0,001), CD4+ — 37,40 ± 0,45 (p < 0,001) и CD8+ — 24,50 ± 0,43 (p < 0,001).
Что касается иммунорегуляторного индекса (CD4+/CD8+), то его значения через 6 месяцев от начала терапии оставались на исходном уровне (p > 0,05), достоверно не отличаясь от норматива (p > 0,05) — 1,55 ± 0,03.
При определении степени динамики показателей через 1 месяц от начала лечения с помощью нормированного показателя — t-критерия установлено, что первое ранговое число заняло увеличение содержания CD4+ (t = 2,85; p < 0,01), затем, в порядке иерархии, тенденция к увеличению CD3+ (t = 1,46; p > 0,05), иммунорегуляторного индекса — CD4+/CD8+ (t = 1,30; p > 0,05), а также CD8+ (t = 0,56; p > 0,05).
При ранжировании степени динамики показателей Т-системы иммунитета через 6 месяцев от начала лечения установлено, что выраженная динамика имела место при увеличении содержания CD4+ (t = 5,33; p < 0,001) и CD8+ (t = 4,22; p < 0,001).
Третий ранг занимает незначительное повышение количества CD8+ (t = 2,51; p < 0,05), а последний — отсутствие динамики со стороны иммунорегуляторного индекса — соотношения CD4+/CD8+ (t = 0,07; p > 0,05).
Причины выявленных фактов разнообразного влияния антипротозойной монотерапии на основные параметры иммунной системы могут быть связаны с тем, что препарат пириметамин + сульфадоксин оказывает токсическое действие на клетки-предшественники иммуноцитов и угнетает функциональное состояние пула зрелых CD4+ и CD8+.
При сопоставлении степени динамики показателей в целом через 1 и 6 месяцев от начала терапии с помощью метода многолучевых фигур [5, 7] выявлено (рис. 2), что площадь фигуры, образованной степенью динамики признаков через 6 месяцев, значительно больше фигуры, отражающей динамику показателей через 1 месяц от начала лечения.
Математическим выражением разности указанных площадей может служить среднеарифметическая величина t-критерия (рис. 3).
Как видно из рис. 3, в целом через 1 месяц от начала лечения отмечалась лишь тенденция (t = 1,54; p > 0,05) к нормализации Т-системы иммунитета, а через 6 месяцев наблюдалась высокодостоверная (t = 3,03; p < 0,01) ее динамика.
Полученные данные свидетельствуют о том, что нормализация Т-системы иммунитета обладает в значительной степени инерционностью, в связи с чем максимум терапевтического эффекта приходится на 6-месячный срок от начала лечения.
Эффективность комбинированного лечения (2-я группа больных ХПТ), включающего антипротозойный препарат пириметамин + сульфадоксин и заместительную терапию иммуноглобулином против T.gondii, была изучена у 48 больных ХПТ в стадии обострения.
Через 1 месяц от начала лечения достоверной динамики показателей клеточного звена иммунитета отмечено не было (p > 0,05).
Через 6 месяцев от начала терапии по сравнению с исходными данными выявлена достоверная динамика по всем параметрам Т-системы иммунитета в виде: увеличения содержания CD3+, составлявшего до лечения 54,1 ± 1,2 (p > 0,05) (значение контрольной группы — 54,10 ± 1,89), через 6 месяцев после начала лечения — 62,50 ± 0,94 (p < 0,01); CD4+ (p < 0,001) — до лечения 33,30 ± 1,12 (p < 0,001) (значение контрольной группы — 54,10 ± 1,89), через 6 месяцев — 38,80 ± 0,28 (p < 0,001); CD8+ — до лечения 22,00 ± 0,72 (p < 0,001) (значение контрольной группы — 25,60 ± 0,27), через 6 месяцев — 25,20 ± 0,22 (p < 0,001); снижения иммунорегуляторного индекса — соотношения CD4+/CD8+, составлявшего до лечения 1,630 ± 0,008 (p > 0,05) (значение контрольной группы — 1,54 ± 0,08), через 6 месяцев — 1,540 ± 0,015 (p < 0,01).
При этом полная нормализация достигнута в отношении всех показателей, кроме CD3+, содержание которых превышало норму (p < 0,01).
При комплексном сопоставлении степени динамики показателей Т-системы через 1 и 6 месяцев от начала лечения установлено, что площадь фигуры, отражающей динамику показателей через 6 месяцев, значительно больше фигуры, определяющей их динамику через 1 месяц, в связи с чем последняя полностью находится внутри первой (рис. 4).
Математическим выражением таких различий может служить среднеарифметическая величина t-критерия (рис. 5).
Как видно из рис. 5, через 1 месяц от начала лечения достоверного эффекта от проведения терапии не было получено (t = 0,33; p > 0,05), а через 6 месяцев установлена высокодостоверная (t = 3,23; p < 0,001) динамика в отношении нормализации показателей Т-системы иммунитета.
Таким образом, комбинированная терапия оказывает существенное влияние на нормализацию Т-системы иммунитета больных ХПТ.
При этом максимум такого действия проявляется через 6 месяцев от начала лечения.
Эффективность лечения больных с применением специфического иммуноглобулина против T.gondii (3-я группа больных ХПТ) была изучена у 50 больных ХПТ в стадии обострения.
Через 1 месяц от начала заместительной терапии иммуноглобулином против T.gondii достоверная динамика отмечена в отношении повышения содержания CD8+ по сравнению с исходными данными — до лечения 21,30 ± 0,63 (p < 0,001) (значение контрольной группы — 25,60 ± 0,27), а через 1 месяц — 23,10 ± 0,45 (p < 0,05), и снижения значения иммунорегуляторного индекса CD4+/CD8+, которое составляло до лечения 1,76 ± 0,07 (p < 0,05) (значение контрольной группы — 1,54 ± 0,08), а через 1 месяц — 1,54 ± 0,05 (p < 0,05).
Через 6 месяцев от начала лечения по сравнению с исходными данными выявлено повышение содержания CD8+ — 25,00 ± 0,21 (p < 0,001) и снижение значений иммунорегуляторного индекса CD4+/CD8+ — 1,56 ± 0,014 (p < 0,01). Что касается содержания CD3+ и CD4+, то оно выявило лишь тенденцию к повышению (p > 0,05).
При этом полная нормализация отмечена в отношении содержания показателя CD8+, а также значений иммунорегуляторного индекса CD4+/CD8+ (p < 0,001 и p < 0,01 соответственно).
При ранжировании степени динамики показателей через 6 месяцев от начала лечения установлено, что выраженные изменения обнаружены в отношении увеличения содержания CD8+ (t = 5,5; p < 0,001).
Второй ранг заняло снижение иммунорегуляторного индекса — соотношения CD4+/CD8+ (t = 2,6; p < 0,01), а третий — увеличение содержания CD4+ (t = 1,73; p < 0,05).
При сопоставлении степени динамики показателей Т-системы иммунитета в целом через 1 и 6 месяцев от начала лечения с помощью метода многолучевых фигур установлено (рис. 6), что площадь фигуры, которая характеризует динамику данных показателей через 6 месяцев от начала лечения, значительно больше площади фигуры, отражающей динамику показателей через 1 месяц от начала лечения. При этом последняя находится внутри первой.
Математическим выражением разности рассматриваемых площадей фигур может служить среднеарифметическая величина t-критерия (рис. 7).
Из рис. 7 можно сделать вывод, что в целом через 1 месяц от начала терапии выявлена лишь тенденция (t = 1,54; p > 0,05) к нормализации Т-системы иммунитета, а через 6 месяцев — высокодостоверная (t = 2,80; p < 0,01) ее динамика.
Эти данные указывают на торпидность процессов восстановления Т-системы иммунитета вообще и под влиянием заместительной терапии иммуноглобулином против Toxoplasma gondii в частности.
Таким образом, терапия специфическим иммуноглобулином против T.gondii оказывает существенное влияние на нормализацию клеточного иммунитета организма больных ХПТ. При этом максимум такого эффекта приходится на срок 6 месяцев от начала лечения.
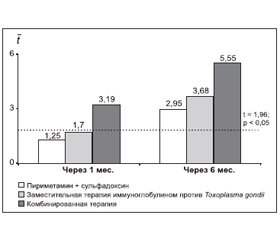
Анализ комплексной оценки степени динамики значений показателей иммунитета в сравниваемых группах больных показал, что через 1 месяц от начала лечения только комбинированная терапия выявила достоверную (t = 3,19; p < 0,01) динамику по нормализации показателей иммунологического гомеостаза больных ХПТ.
Применение монотерапии пириметамином + сульфадоксином (t = 1,25; p > 0,05) и терапии иммуноглобулином против T.gondii (t = 1,76; p > 0,05) вызвало лишь тенденцию к нормализации иммунологических показателей.
Через 6 месяцев от начала лечения во всех сравниваемых группах установлена достоверная динамика иммунологических показателей, однако ее степень была различной.
/50/50.jpg)
Выраженная динамика была отмечена для группы больных, получавших комбинированную терапию (t = 5,85; p < 0,001), умеренная — при заместительной терапии иммуноглобулином против Toxoplasma gondii (t = 3,68; p < 0,001) и незначительная — в группе больных, пролеченных пириметамином + сульфадоксином (t = 2,91; p < 0,01) (рис. 8).
Выводы
1. Проведение иммунологического мониторинга позволяет прийти к выводу, что недостаточная эффективность этиотропной монотерапии при обострениях ХПТ обусловлена тем, что применение «токсоплазмицидных» препаратов не обеспечивает восстановления специфической толерантности к антигенам Toxoplasma gondii (Th2-тип иммунного ответа не достигает баланса с Th1-типом, при этом сохраняется или возобновляется цитотоксическая активность).
2. Под влиянием комплексного лечения, включающего пириметамин + сульфадоксин, заместительную терапию специфическим иммуноглобулином против T.gondii или их комбинацию, у больных ХПТ отмечается достоверное повышение содержания субпопуляций иммунорегулирующих лимфоцитов — CD4+-хелперных и CD8+-супрессорных клеток. Максимум вышеуказанных проявлений наступает через 6 месяцев от начала лечения.
3. Наивысший иммунологический эффект установлен в отношении комбинированной терапии, терапия специфическим иммуноглобулином против Toxoplasma gondii заняла промежуточное место, а антипротозойная терапия выявила наименьшую эффективность.
1. Бодня Е.И. Защитно-приспособительные реакции как критерии оценки и прогноза при хроническом приобретенном токсоплазмозе / Е.И. Бодня, Ю.В. Танчук // Проблеми медичної науки та освіти. — 2005. — № 1. — С. 37–41.
2. Бабич П.Н. Статистические методы в медико-биологических исследованиях с использованием EXCEL / П.Н. Бабич, А.В. Чубенко, С.Н. Лапач. — К.: Морион, 2000. — 320 с.
3. Возианова Ж.И. Инфекционные и паразитарные болезни / Ж.И. Возианова. — К.: Здоров’я, 2002. — Т. 3. — С. 285–315.
4. Дубинська Г.М. Токсоплазмоз. Клініка, діагностика та лікування: метод. рекомендації / Г.М. Дубинська; Міністерство охорони здоров’я України, Український центр наукової медичної інформації та патентно-ліцензійної роботи. — П.: [б.в.], 2002. — 24 с. — 300 пр.
5. Зосимов А.Н. Системный анализ в медицине / А.Н. Зосимов, В.П. Голик. — Х.: Торнадо, 2000. — 78 с.
6. Казанцев А.П. Токсоплазмоз / А.П. Казанцев. — Л.: Медицина, 1985. — 168 с.
7. Пипа Л.В. Токсоплазмозна інфекція у дітей: особливості перебігу, діагностики, лікування: Автореф… д-ра мед. наук: 14.01.13: захищена 21.04.05 / Л.В. Пипа. — К., 2005. — 41 с.
8. Спосіб лікування хронічного набутого токсоплазмозу / Л.І. Бодня, О.В. Боброва, С.С. Коцина. Пат. u 2009 01 209 UA, МПК (2009) А61 К 31/00. № 43188; Заявл. 16.02.09; Опубл. 10.08.09; Бюл. № 15. — 6 с.
9. Dlugonska H. Immunity in Toxoplasma gondii infections / H. Dlugonska // Post. Hig. Med. Dosw. — 2000. — Vol. 54, № 1. — P. 53–65.
10. Remington J.S. Toxoplasmosis. Infections diseases of the fetus and newborn infant. — 5th ed. / J.S. Remington, R. McLeod, P. Thulliez, G. Desmonts. — W.B. Saunders, Philadelphia, Pa. — 2001. — P. 205–346.

/48/48.jpg)
/49/49.jpg)