Журнал «Актуальная инфектология» 1 (6) 2015
Вернуться к номеру
Болезнь Рейтера как проявление кишечных инфекций
Авторы: Домашенко О.Н., Черкасова Т.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Представлена роль энтеропатогенных бактериальных факторов, в частности иерсиниозной инфекции, в развитии болезни Рейтера, частота встречаемости в клинической практике инфекциониста и особенности клинического течения данного заболевания.
Представлена роль ентеропатогенних бактеріальних факторів, зокрема ієрсиніозної інфекції, у розвитку хвороби Рейтера, частота зустрічальності в клінічній практиці інфекціоніста та особливості клінічного перебігу даного захворювання.
There are considered the role of enteropathogenic bacterial factors, in particular yersiniosis infection, in the development of Reiter’s disease, incidence rate in the clinical practice of an infectiologist, and features of clinical course of this disease.
болезнь Рейтера, энтерогенные факторы, иерсиниоз.
хвороба Рейтера, ентеропатогенні фактори, ієрсиніоз.
Reiter’s disease, enterogenous factors, yersiniosis.
Статья опубликована на с. 94-96
Введение
Болезнь Рейтера (болезнь Рейтера — Фиссенже — Леруа) до недавнего времени рассматривалась как системное заболевание иммунной природы, обусловленное хламидийной инфекцией. Однако существует вероятность возникновения ее под влиянием грамотрицательных возбудителей кишечных инфекций. Наибольшее значение среди грамотрицательных возбудителей кишечных заболеваний имеют иерсинии — возбудители иерсиниоза и псевдотуберкулеза, которые в 63 % случав обусловливают развитие реактивных артритов [1]. Иерсинии являются наиболее частой причиной развития иммунопатологических состояний (серонегативных спондилоартропатий, узловатой эритемы, аутоиммунного тиреоидита, болезни Крона, идиопатической крапивницы и др.), что связывают с хромосомными и плазмидными факторами возбудителя, способностью внедряться непосредственно в цитоплазму эукариотических клеток-мишеней. Это приводит к резкому нарушению функций макрофагов и других фагоцитирующих и нефагоцитирующих клеток [3, 6]. В результате подавляются основные механизмы элиминации возбудителя из организма, нарушается продукция цитокинов, нарастают апоптотические явления в органах естественной и адаптивной защиты, иммуносупрессивные и прочие иммуномодулирующие эффекты. Течение и исходы иерсиниоза и псевдотуберкулеза во многом определяются иммунологическим дисбалансом на уровне фагоцитирующих клеток. Незавершенность фагоцитоза определяется способностью иерсиний продуцировать антигенные субстанции, угнетающие фагоцитоз, а также связыванием и нейтрализацией опсонирующих факторов сыворотки крови [2]. При этом следует отметить, что болезнь Рейтера возникает в основном у людей с генетической предрасположенностью (ассоциацией с HLA-B27) и проявляется поражением опорно-двигательного аппарата, урогенитальной системы, глаз, кожи и внутренних органов [4, 5]. Суставной синдром при иерсиниозной инфекции — это иммунный ответ на антигенные детерминанты, общие для возбудителя и HLA-B27. Болезнь Рейтера чаще проявляется триадой клинических признаков (уретроокулосиновиальный синдром), которые встречаются в 70–75 % случаев; в других наблюдениях регистрируется 1–2 признака (неполная форма болезни Рейтера). У 12–18 % заболевших иерсиниозом суставной процесс проявляется в фазе вторичноочаговых и аллергических проявлений [8, 9]. Формирование синдрома Рейтера при иерсиниозе обусловлено иммунным ответом на антигенные детерминанты, общие для возбудителя и HLA-B27.
Целью данного исследования было изучение клинических проявлений и диагностики болезни Рейтера, ассоциированной с бактериальной кишечной инфекцией, в частности изучение роли иерсиний в возникновении данного заболевания.
Материалы и методы
Под наблюдением находились 33 больных синдромом Рейтера в возрасте 16–34 лет (19 женщин, 14 мужчин). Болезнь Рейтера имела место у 15 больных иерсиниозом, 9 — псевдотуберкулезом, у 3 она имела протейную этиологию, у 2 — сальмонеллезную, у 1 — эшерихиозную, у 1 — клебсиеллезную, у 2 — клостридиальную этиологию. Диагноз был установлен на основании клинико-эпидемиологических данных, бактериологического исследования и серологической идентификации. Этиология болезни Рейтера во всех случаях была расшифрована по общепринятым методам (бактериологическим, серологическим, ИФА и в 6 случаях иерсиниоза — методом иммуноблота). У больных эшерихиозом и клебсиеллезом, кроме положительной копрокультуры, возбудители выделены из мочи.
Результаты исследования
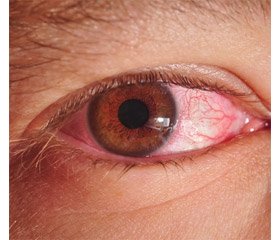
Болезнь Рейтера у 28 больных развилась через 3–8 недель после начала основного заболевания. У 80,6 % больных симптомы гастроэнтерита или энтероколита были манифестными, у остальных — слабовыраженными. 83,9 % пациентов первично обращались за медицинской помощью, получали антибактериальную терапию, нитрофурановые препараты, пробиотики. Поражение опорно-двигательного аппарата — главный синдром болезни Рейтера. У 1 пациентки выявлен моноартрит коленного сустава. У 3 пациентов наблюдались рецидивирующие артралгии, что позволило расценивать течение заболевания как легкое. У больных иерсиниозом и псевдотуберкулезом чаще наблюдалось несимметричное поражение коленных, голеностопных, пястно-фаланговых суставов. Реже были вовлечены в процесс плечевые, локтевые, тазобедренные суставы. Среди обследованных 3 больных предъявляли жалобы на боль в межпозвоночных сочленениях. У 32,3 % больных наблюдалась утренняя скованность суставов. Кожа над пораженными суставами была, как правило, негиперемированная, горячая на ощупь, отмечалась отечность. У 61,3 % больных наблюдались тендосиновиты. У 22,6 % (больные иерсиниозом, псевдотуберкулезом, протейной инфекцией) наблюдался сакроилеит. Длительность артритов составляла от 1 месяца до 5 лет, прежде всего у больных иерсиниозом. Хроническая форма, которую диагностировали через 6 месяцев от начала заболевания, характеризовалась длительным рецидивирующим течением, несмотря на лечение, которое включало нестероидные противовоспалительные препараты. Клинические симптомы уретрита (цистита) наблюдались у 7 (22,6 %) больных, у 19 (61,3 %) выявлены изменения в анализах мочи (общем анализе и по Нечипоренко), у остальных (16,1 %) поражения урогенитальной системы отсутствовали. У 87,1 % обследованных пациентов с болезнью Рейтера начиная с острого периода наблюдались конъюнктивит, кератоконъюнктивит, которые развивались симметрично, с умеренным воспалением, слабой гиперемией и отеком, со слизистым или слизисто-гнойным отделяемым. Частота кератоконъюнктивита возрастала через 1,5–2,0 месяца от начала заболевания. У 2 больных был выявлен иридоциклит, у 2 — увеит ( в одном случае — с язвенным поражением). Иридоциклит и кератоконъюнктивит возникали через 6–7 недель после начала заболевания на фоне суставного синдрома. У одного пациента с болезнью Рейтера псевдотуберкулезной этиологии через 14 месяцев возник рецидив иридоциклита без вовлечения в процесс суставов и мочеполовой системы. У всех больных болезнью Рейтера была резко повышена СОЭ (48–65 мм/ч), отсутствовал ревмофактор, а также маркеры аутоиммунных заболеваний, урогенитальных инфекций. У 74,2 % больных в моче выявлена протеинурия, у половины пациентов — лейкоцитурия, у 1/3 — эритроцитурия. В лечении болезни Рейтера энтерогенной этиологии важное значение имеет длительное (иногда несколько месяцев), беспрерывное назначение антибиотиков (фторхинолоны, тетрациклины, цефалоспорины IV поколения, имепенемы), противовоспалительных нестероидных препаратов, сульфосалазина (салофалька). В отдельных случаях в связи с тяжестью процесса в терапии болезни Рейтера использовались глюкокортикостероидные препараты, лечение которыми нередко провоцировало рецидивы суставного синдрома.
Выводы
1. Таким образом, в этиологии болезни Рейтера необходимо учитывать роль бактериальной кишечной флоры, и в частности иерсиний, как наиболее сложного иммуногенного фактора.
2. Аутоиммунный компонент иерсиниозной инфекции в виде явления поликлональной активации служит триггером исхода инфекционного процесса в моноспецифическое аутоиммунное заболевание.
3. Распознаванию синдрома Рейтера, обусловленного грамотрицательной бактериальной флорой, способствуют правильно собранный анамнез заболевания, специфические лабораторные обследования и надежное исключение других этиологических факторов.
1. Bottone E.J. Yersinia enterocolitica: the charisma continues / E.J. Bottone // Clinical Microbiology Reviews. — 1997. — Vol. 10, № 2. — P. 257–276.
2. Современное состояние лабораторной диагностики иерсиниозов в Москве / Н.Н.Филатов, Н.Я. Салова, В.П. Голованова [и др.] // Инфекции, обусловленные иерсиниями (иерсиниоз, псевдотуберкулез), и другие актуальные инфекции. — СПб., 2000. — С. 59–60.
3. Шестакова И.В. Хронический иерсиниоз как терапевтическая проблема / И.В. Шестакова, Н.Д. Ющук // Тер. архив. — 2010. — Т. 82, № 3. — С. 71–77.
4. Chronic yersiniosis due to defects in the TLR 5 and NOD 2 recognition pathways / M.G. Netea, F. van der Leij, J.P.H. Drenth [et al.] // Infection and Immunity. — 2010. — Vol. 78, № 9. — P. 3716–3725.
5. Учайкин В.Ф. Иерсиниозы у детей / Учайкин В.Ф., Гордеец А.В., Бениова С.Н. — М.: ГЭОТАР-Медиа, 2005. — 144 с.
6. Viboud G.I. Yersinia outer proteins: role in modulation of host cell signaling responses and pathogenesis / G.I. Viboud, J.B. Bliska // Annual Review of Microbiology. — 2005. — № 59. — P. 69–89.
7. Шестакова И. В. Клинико-прогностические критерии различных форм и вариантов течения иерсиниозной инфекции / И.В. Шестакова, Н.Д. Ющук, И.И. Балмасова // Тер. архив. — 2009. — Т. 81, № 11. — С. 24–32.
8. Cover T.L. Yersinia enterocolitica / T.L. Cover, R.C. Aber // New England Journal of Medicine. — 1989. — Vol. 321, № 1. — P. 16–24.
9. Шестакова И. В. Иерсиниоз: диагностические ошибки / И.В. Шестакова, Н.Д. Ющук, Т.И. Попова // Врач. — 2007. — № 7. — С. 71–74.