Журнал «Актуальная инфектология» 1 (6) 2015
Вернуться к номеру
Генетические ограничения эффективности и безопасности массовых вакцинаций населения
Авторы: Супотницкий М.В. — Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, г. Москва
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Низкая эффективность массовой иммунизации населения и поствакцинальные осложнения не всегда связаны с неудовлетворительным качеством вакцин или нарушением техники вакцинации, допущенным медицинским персоналом. В работе показано, что динамика эпидемического процесса, наиболее характерная для него клиническая картина болезни, эффективность и безопасность вакцинации, частота поствакцинальных осложнений среди прочих факторов находятся в тесной зависимости от относительного количества в популяции лиц с дефектами (полиморфизмами) генов иммунной системы и физиологических систем, препятствующих развитию болезни. Полиморфизация таких генов происходит спонтанно, путем образования снипов и делеций, распределяющихся в следующих поколениях в соответствии с законами Менделя. Накоплению полиморфизмов, участвующих в патогенезе инфекционной болезни, как это ни парадоксально, способствовал достигнутый прогресс в борьбе с контагиозными циклическими инфекциями, и в частности с натуральной оспой. Было снято селективное давление на популяции людей, устранявшее индивидуумов с дефектами иммунной и других систем организма, не способных эффективно отвечать на инвазию возбудителя инфекционной болезни. Темпы накопления полиморфизмов возрастают в относительно генетически однородных популяциях (жители островных государств) и в популяциях, практикующих браки между родственниками. Отказаться от борьбы с возбудителями контагиозных циклических инфекций невозможно. Поэтому необходимо ожидать дальнейшего роста регистрируемых случаев поствакцинальных осложнений, причины которых следует искать в геноме вакцинированного человека и, соответственно, внести коррекции в стратегию массовой иммунизации различных групп населения и методологию выяснения причин поствакцинальных осложнений. В работе также описаны полиморфизмы аллелей генов иммунной системы, достоверно ассоциирующиеся с низкой эффективностью вакцинации против кори, краснухи, эпидемического паротита, гриппа, гепатита В и осложнениями, возникающими после вакцинации живой противооспенной вакциной и туберкулезной вакциной на основе Mycobacterium bovis BCG.
Низька ефективність масової імунізації населення і поствакцинальні ускладнення не завжди пов’язані з незадовільною якістю вакцин або порушенням техніки вакцинації, що допустив медичний персонал. У роботі показано, що динаміка епідемічного процесу, найбільш характерна для нього клінічна картина хвороби, ефективність і безпека вакцинації, частота післявакцинальних ускладнень серед інших факторів перебувають у тісній залежності від відносної кількості в популяції осіб з дефектами (поліморфізм) генів імунної системи і фізіологічних систем, перешкоджають розвитку хвороби. Поліморфізація таких генів відбувається спонтанно, шляхом утворення сніпів і делецій, що розподіляються в наступних поколіннях відповідно до законів Менделя. Накопиченню поліморфізмів, що беруть участь у патогенезі інфекційної хвороби, як це не парадоксально, сприяв досягнутий прогрес у боротьбі з контагіозними циклічними інфекціями, і зокрема з натуральною віспою. Було знято селективний тиск на популяції людей, що усуває індивідуумів з дефектами імунної та інших систем організму, не здатних ефективно відповідати на інвазію збудника інфекційної хвороби. Темпи накопичення поліморфізмів зростають у відносно генетично однорідних популяціях (мешканці острівних держав) і в популяціях, що практикують шлюби між родичами. Відмовитися від боротьби зі збудниками контагіозних циклічних інфекцій неможливо. Тому необхідно очікувати подальшого зростання реєстрованих випадків поствакцинальних ускладнень, причини яких слід шукати в геномі вакцинованої людини і, відповідно, внести корекції в стратегію масової імунізації різних груп населення і методологію з’ясування причин поствакцинальних ускладнень. У роботі також описані поліморфізми алелей генів імунної системи, що вірогідно асоціюються з низькою ефективністю вакцинації проти кору, краснухи, епідемічного паротиту, грипу, гепатиту В та ускладненнями, які виникають після вакцинації живою противіспенною вакциною і туберкульозною вакциною на основі Mycobacterium bovis BCG.
Low efficiency of cohort immunization and postvaccinal complication are not always connected with vaccine unsatisfactory quality or violation of vaccination requirements by medical workers. The paper demonstrates that epidemic dynamics, disease clinical manifestation typical for it, efficiency and safety of immunization, postvaccinal complications incidence also closely interrelate with relative quantity of persons with anomalies (polymorphism) of immune response genes and physiologic systems protected from disease development. Polymorphism of these genes has a spontaneous development by single nucleotide polymorphism and deletions forming apportioning in next generations according to Mendel’s laws. Polymorphism accumulation involved into infectious diseases pathogenesis is ironically a result of progress in control of contagious cycle infections, particularly natural smallpox. There was taken off a selective pressure from a population that extracted persons unable to react effectively on infectious agents invasion. Velocity of polymorphism accumulation is growing in relatively genetically homogeneous population (inhabitants of island countries) and in populations with typical intermarriages. It is impossible to refuse from control of contagious infectious agents. So we should expect of increase of registered postvaccinal complication associated rather with human genome peculiarity than with other reasons. That causes the necessity to adjust a strategy of immunization of various cohorts and methods for determining the reasons of postvaccinal complications. The paper also describes polymorphism of immune response genes significantly associated with low effectiveness of vaccination against measles, rubella, epidemic parotitis, B hepatitis and complications after live smallpox and tuberculosis vaccine Mycobacterium bovis BCG.
Статья опубликована на с. 100-115
В руководствах по иммунопрофилактике инфекционных болезней низкая эффективность вакцинации и поствакцинальные осложнения обычно объясняются нарушениями холодовой цепи при транспортировке и хранении вакцин или небрежностью, допущенной медицинским персоналом уже при проведении вакцинации [1]. Однако далеко не всегда эти нарушения удается доказать. Кроме того, у разных людей ответы иммунной системы на вакцинацию одной и той же вакциной различаются по максимальному уровню специфических антител в сыворотке крови, авидности антител, продолжительности их циркуляции в кровеносном русле, продолжительности иммунологической памяти, цитокиновым ответам и другим параметрам [2]. Следовательно, проблемы эффективности и безопасности вакцинации населения выходят за пределы контроля показателей качества вакцин, утвержденных соответствующими нормативными документами, и правильности проведения самой вакцинации. Они неизбежно упираются в особенности генетической организации иммунной системы и других систем организма человека, участвующих в патогенезе болезни. Цель настоящей работы — показать генетические ограничения эффективности и безопасности массовых вакцинаций населения.
В работе мы рассмотрим причины накопления в популяциях людей мутаций в генах, экспрессия которых связана с эффективным ответом иммунной и других систем организма на вторжение возбудителя инфекционной болезни, обобщим сведения о таких генах и проанализируем роль этих мутаций как в клиническом течении инфекционной болезни, так в развитии поствакцинального процесса.
Устойчивость и восприимчивость к возбудителям инфекционных болезней. Относятся к полигенным пороговым наследственным признакам. Люди, наследственно восприимчивые к возбудителю инфекционной болезни, не заболевают, если не было их экспонирования к этому возбудителю. Люди, устойчивые к этому же возбудителю, заболевают при превышении определенного порога дозы заражения. Вне эпидемического процесса такие признаки могут рассматриваться как нейтральные. Селективными они становятся при контакте с возбудителем инфекционной болезни, и их носители подпадают под действие естественного отбора. Частота встречаемости отдельных генов (аллелей генов) в инфицированной популяции людей варьирует. Поэтому наблюдается множество переходных вариантов патологии между типичными формами проявления инфекционной болезни1 (рис. 1).
За более чем 200 лет, прошедших с начала массовых вакцинаций против натуральной оспы по способу, предложенному Эдвардом Дженнером (Edward Anthony Jenner, 1749–1823), популяционный состав населения изменился. Натуральная оспа, доминировавшая среди эпидемических болезней на протяжении столетий, исчезла, и ее селективное давление на популяции людей прекратилось. В отличие от чумы, вспыхивавшей опустошительными эпидемиями с временными промежутками в несколько десятилетий и даже столетий, натуральная оспа присутствовала среди людей постоянно. Годовые колебания смертности различались в разы, но не на порядки. С 1667 по 1800 г. число умерших от натуральной оспы в Лондоне на 1000 умерших от других причин составляло в среднем 65 человек в год. Но это была иная оспа по охватываемому ею контингенту по сравнению с тем, что врачи наблюдали в ХХ в. До практики массовых вакцинаций натуральная оспа представляла собой исключительно детскую болезнь, которой болели все дети до 1 года. Европейские врачи еще в начале XVIII в. придерживались точки зрения авторов раннего Средневековья Рази и Авиценны, что оспа является врожденной болезнью. Она развивается у ребенка в результате брожения менструальной крови матери, которой тот питался, находясь в ее утробе. Такое понимание причин возникновения натуральной оспы держалось несколько тысяч лет [5].
В. Губерт [5] привел данные шведских и британских статистических исследований XVII–XVIII вв., свидетельствующие о том, что летальность среди детей, заболевших натуральной оспой, была постоянной на протяжении нескольких столетий и не превышала 6–10 % от количества заболевших. Только в начале XVIII в., когда натуральная оспа по неизвестным причинам стала менее распространенной болезнью и появилось большое количество людей, не перенесших ее в детстве, врачи пришли к выводу о ее заразности.
Современные данные о механизмах иммунного ответа у человека на вирус натуральной оспы говорят о том, что в первую очередь от натуральной оспы погибают индивидуумы, иммунная система которых не способна эффективно отвечать на инвазию вируса выработкой нейтрализующих антител. У таких пациентов оспа развивается в геморрагической форме, вирус в высоких титрах обнаруживается в фарингеальном тракте, увеличивая риск передачи болезни по цепочке2 [6] . То есть натуральная оспа на протяжении столетий изымала из популяций индивидуумы, имеющие генетические дефекты иммунной системы. Свой вклад в селекцию генотипов вносили другие контагиозные болезни — грипп, корь и др. (рис. 2).
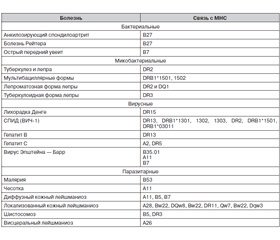
G.A. Poland et al. [8] относят к генетическим дефектам иммунной системы полиморфизмы генов главного комплекса гистосовместимости (МНС); цитокинов; рецепторов цитокинов; мембранных рецепторов, узнаваемых вирусами (membrane-based viral receptors); толл-подобных рецепторов; рецепторов витаминов А и D; сигнальных молекул и др. Полиморфизмы генов, продукты которых вовлечены в ответы иммунной системы, находятся в сложной ассоциации с полиморфизмами генов, обусловливающими популяционные особенности населения на территории, где происходит распространение инфекционной болезни. Примеры таких ассоциаций приведены в табл. 1.
Ошибочно считать, что устойчивость человека к заражению возбудителем инфекционной болезни и способность его организма противодействовать развивающимся патологическим процессам зависят только от ответов его иммунной системы. A.L. Rasmussen et al. [10] показали связь выраженности экспрессии генов рецепторов эндотелиальной тирозинкиназы (endothelial receptor tyrosine kinase) Tie1 и Tek (Tie2) с клиническим течением лихорадки Эбола. В экспериментах на генетически модифицированных мышах они обнаружили, что коагулопатия при лихорадке Эбола наиболее выражена у тех линий животных, у которых экспрессия Tie1 и Tek подавлена. Экспрессия этих генов активирует коагулирующие факторы системы крови, такие как тромбин (F2), тканевой фактор (tissue factor, F3), и рецепторы, активируемые протеазами (protease activated receptors 1, 3 и 4; PAR1/F2R, PAR3/F2RL2, PAR4/F2RL3), что снижает риск развития тромбогеморрагического синдрома. По их мнению, полиморфизмы генов Tie1 и Tek могут определять клиническое течение и летальность при лихорадке Эбола у людей в природных очагах этой болезни. Однако влияние генетических дефектных физиологических систем организма человека на патогенез инфекционной болезни изучено гораздо хуже, чем роль в этих процессах различных генетических дефектов иммунной системы.
Главный комплекс гистосовместимости (major histocompatibility complex; MHC, ГКГС)3. Это группа антигенов клеточной поверхности, играющих важную роль в клеточном узнавании и в ответах иммунной системы, направленных на подавление инфекционного процесса. Молекулы I класса МНС связывают и презентируют пептиды микроорганизма CD8+ T-лимфоцитам; молекулы II класса МНС связывают и презентируют пептиды микроорганизма CD4+ T-лимфоцитам, что обеспечивает координацию действий различных звеньев иммунной системы в подавлении инфекционного процесса. Щель, связывающая пептиды микроорганизма (peptide-binding clefts), образованная молекулами МНС, содержит высокополиморфные кластеры аминокислот, способные ограничивать спектр пептидов, презентируемых T-лимфоцитам. В тех случаях, когда белки МНС не в состоянии связать пептидный фрагмент чужого антигена, Т-хелперы остаются ареактивными и их помощь В-клеткам не реализуется.
Белки МНС кодируются большим семейством генов со сложной интрон-экзонной организацией. Наследуются кодоминантно. У человека гены МНС находятся в хромосоме 6 (6p21). Общее число фенотипов МНС составляет около 20 млрд. Сиквенс-анализ генов 8 различных гомозиготных МНС-гаплотипов4 позволил выявить у них до 44 тыс. однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP; произносится как снип) и вставок/делеций, а также подтвердить наличие более чем 300 локусов, включающих более 160 белок-кодирующих генов (protein-coding genes). И те и другие в кодирующих или регуляторных регионах генов МНС приводят к изменениям в структуре и функции экспрессируемых белков. Средняя плотность снипов для генов МНС варьирует от 1 до более чем 60 на т.п.о. ДНК5. Наиболее полиморфными являются гены, относящиеся к молекулам I и II классов МНС (рис. 3).
/103/103.jpg)
Молекулы I класса МНС (HLA-A, -B, -C, -E, -F и -G) экспрессируются на поверхности всех ядросодержащих клеток, формирующих ткани, и представляют собой гетеродимеры, включающие тяжелую a-цепь и однодоменный b2-микроглобулин, нековалентно связанный с основным полипептидом. Связывание антигенного пептида молекулой I класса происходит в антигенсвязывающей щели, образованной a-спиральными участками a- и a2-доменов. Антигены I класса определяют индивидуальную антигенную специфичность. При вирусной инфекции они вызывают гибель инфицированных вирусом фагоцитирующих клеток [12].
Молекулы II класса МНС (HLA-DR, -DQ, -DM и -DP) — гетеродимеры, состоящие из двух нековалентносвязанных цепей: a и Р, каждая из которых включает два домена (a1a2 и b1b2 соответственно). МНС класса II обеспечивают взаимодействие между макрофагами и В-лимфоцитами. Они участвуют в формировании всех видов иммунного ответа: противомикробного, трансплантационного, противоопухолевого и др. Связь между свойствами МНС и классами генов представлена в табл. 2.
Среди европейского населения наиболее часто отмечены гаплотипы, включающие антигены МНС-A3 и МНС-B7; МНС-А2 и МНС-В7; МНС-A1 и МНС-B8; МНС-A2 и МНС-B15; МНС-A2 и МНС-B35 и другие. Среди лиц монголоидных популяций отмечалась распространенность антигенов МНС-A9 и 11 за счет снижения МНС-A1. Среди африканцев наблюдался подъем концентрации антигена МНС-A30 за счет снижения частоты встречаемости антигенов МНС-A1, 2 и 116. Частота встречаемости отдельных антигенов МНС среди этнических групп и населения, проживающего на различных территориях, не только отличается, но и меняется со временем, но рассмотрение этих процессов не входит в задачу данной работы7. В табл. 3 показана частота встречаемости антигенов МНС среди 600 здоровых доноров крови г. Москвы.
Ассоциация полиморфизмов генов МНС с тяжестью течения инфекционного процесса. С полиморфизмом генов МНС связано такое явление, как неэффективный контроль иммунного ответа (табл. 1). Иммунная система людей с таким генетическим дефектом не реагирует на некоторые критические эпитопы патогенов, и инфекционная болезнь у них развивается значительно легче, ее клиническое течение проходит тяжелее, чем у тех лиц, у которых Т-хелперы активируются. Поэтому при анализе распределения аллелей МНС в популяции люди с аллелью, не способной к связыванию данного антигена, обнаруживаются среди больных в статистически значимых ассоциациях.
Другая причина ассоциации полиморфизмов МНС с отдельными инфекционными болезнями заключается в том, что антигенные структуры возбудителя инфекции имитируют или моделируют молекулы МНС. Развиваются аутоиммунитет в отношении молекул МНС, дисфункция и истощение Т-клеток. Иммунная система утрачивает способность противодействовать возбудителю инфекционной болезни (рис. 4).
/105/105.jpg)
Учитывая то, что МНС играет универсальную роль в реакциях распознавания и взаимодействия на клеточном уровне, можно предположить существование намного большего количества генетически опосредованных механизмов влияния комплекса на сопротивляемость организма к инфекционным болезням. В табл. 4 перечислены ассоциации, установленные между различными полиморфизмами МНС и некоторыми инфекционными болезнями. Указаны лишь антигены, обнаруживаемые в статистически значимой ассоциации.
С одними и теми же полиморфизмами МНС в отдельных этнических группах ассоциируют сразу несколько инфекционных болезней, например ВИЧ, возбудители гепатита В, проказы и туберкулеза среди представителей этносов негроидной расы в Африке.
Ку-лихорадка (Q-fever). Клиническая картина при ку-лихорадке отличается разнообразием. У пациентов, носителей аллели DRB1*11, перенесших ку-лихорадку, наблюдается осложнение, названное слабостью после ку-лихорадки (post-Q-fever fatigue patients, QFS). У макрофагов людей, носителей данной аллели, обнаружена пониженная секреция интерферона гамма и IL-2 в ответ на стимуляцию лигандами в короткоживущих культурах [17].
Малярия. Установлена связь между аллелью B53 и защитой от тяжелых форм малярии — церебральной и сопровождающейся развитием выраженной анемии [18]. Аллель DRB1 ассоциирована с резистентностью к развитию анемии во время болезни [19].
Хантавирус Puumala. Индивидуумы, экспрессирующие гены аллели B8, переносят болезнь более тяжело. У них хантавирусная инфекция проявляется пониженным артериальным давлением, повышенным содержанием креатинина в крови. Одновременно наблюдается большее количество вируса в моче и крови. У лиц с аллелью B27 болезнь протекает в мягкой форме. Почти все больные с гаплотипом A1-B8-DR3, у которых прогрессивно развивался шок, одновременно экспрессировали аллель TNF2. Аллель связана с повышенной продукцией фактора некроза опухолей макрофагами в ответ на инфекцию [20].
Болезнь Лайма. Показана связь аллели DRB1*0401 с развитием хронических артритов после перенесения болезни Лайма и отсутствием со стороны организма человека реакции на антибиотикотерапию. Эта аллель связана также с повышенным риском развития тяжелых ревматоидных артритов. При исследовании антительных ответов у пациентов, перенесших болезнь Лайма, реакции иммуноглобулина G (IgG) на поверхностный наружный белок A (OspA) и OspB спирохеты часто обнаруживались в самом начале длительно текущих артритов. После проведения курса лечения антибиотиками у пациентов с аллелью DR4 и антительными ответами на OspA и OspB артриты продолжались значительно дольше, чем в тех случаях, когда ответы на данные белки отсутствовали [21].
Лепра. В разных этнических группах предрасположенность к лепре и клиническое течение болезни проявляются по-разному благодаря полиморфизму МНС. Наличие аллели DR2 определяет предрасположенность человека к обеим формам проказы (туберкулоидной и лепроматозной). Среди некоторых народов Индии и Бразилии аллель ассоциирована с лепроматозной формой проказы. Среди египтян — с туберкулоидной формой. DQ-аллели, особенно DQw1, ассоциированы с туберкулоидной лепрой среди населения Индии, Кореи, Таиланда и Японии и с лепроматозной формой болезни среди отдельных групп населения Индии и Японии. DQ-аллели встречаются вместе с аллелью DR2. Аллель DR3 ассоциирована с туберкулоидной формой проказы среди населения Мехико, Суринама и Венесуэлы. Для отдельных аллелей MHC класса I также установлена связь с развитием разных клинических форм лепры, но пока наблюдения одних исследователей не находят подтверждения в работах других [22].
Туберкулез. Выявлена связь между легочной формой туберкулеза и полиморфизмами MHC. Аллели DR2 и DR3 ассоциируются с легочным туберкулезом и туберкулоидной проказой. DR2 определяет восприимчивость больного к легочному туберкулезу и резистентность к антитуберкулезным препаратам [22, 23].
Клещевой энцефалит. Среди больных клещевым энцефалитом в Хабаровском крае обнаружено статистически достоверное увеличение частоты встречаемости антигена MHC А3 (р < 0,001). Реже, чем в популяции, встречались такие антигены, как MHC-А11, А19, А28, В35 (р < 0,01) и Cw3 (р < 0,001). Установлено учащение встречаемости в популяции антигена А3 (р < 0,001) при стертой форме болезни; А3, В15, В16, В27 (р < 0,001) — при менингеальной форме болезни; А3, А10, В16, Cw7 (р < 0,001) — при очаговых формах клещевого энцефалита [24].
Ниже рассмотрим проявления полиморфизмов генов МНС в ответе на иммунизацию различными вакцинами.
Иммунопрофилактика кори, свинки и краснухи8. Специфические аллели генов белков классов I и II МНС ассоциированы с вариациями уровня антител в сыворотке после однократной вакцинации MMR-вакциной (measles-mumps-rubella vaccine) [25–27]. В частности, аллели генов, относящихся к классу II DRB1*03, DQA1*0201 и классу I B8, B13 и B44, ассоциированы с низким уровнем противокоревых антител у вакцинированных здоровых американских школьников. В случае МНС-гомозиготности вакцинированных пациентов показано значительное снижение уровня специфических антител после однократной вакцинации либо даже их отсутствие. Повторная вакцинация коревой вакциной, увеличение ее дозы при однократной вакцинации позволяли преодолеть генетическую рестрикцию иммунного ответа [28]. Также установлено, что гаплотипы DRB1*07-DQB1*02-DPB1*02 и DRB1*07-DQB1*03-DPB1*04 находятся в строгой ассоциации с низким уровнем антител в ответ на вакцинацию коревой вакциной. Для гаплотипа A*26-Cw*12-B*38 показана строгая ассоциация с высоким уровнем антител и пролиферации лимфоцитов в ответ на вакцинацию против вируса эпидемического паротита [29]. Супертипы (supertype) B44 и B58 строго ассоциированы с низким уровнем противокоревых антител. Наиболее часто встречающийся супертип B7 ассоциирован с высоким уровнем специфических антител.
При оценке результатов вакцинации против эпидемического паротита (свинка) установлена ассоциация аллели МНС-DQB1*0303 с низким титром специфических антител [30]. Аллели МНС-A (*2402 и *6801) ассоциированы с низким содержанием в сыворотке крови IFN-гамма (показатель выраженности клеточного иммунитета), который должен вырабатываться в ответ на вакцинацию живой вакциной против краснухи [31]. Таким образом, ответы на введение MMR-вакцины со стороны обоих звеньев иммунитета, клеточного (лимфопролиферация и секреция цитокинов) и гуморального (антитела), зависят от полиморфизмов МНС-генов [32].
Иммунопрофилактика гриппа. Основной ответ со стороны иммунной системы человека направлен на трансмембранные гликопротеины вируса гриппа: гемагглютинин (hemagglutinin, H) и нейраминидазу (neuraminidase, N). Производные этих же гликопротеинов составляют основу коммерческих гриппозных вакцин. Показана ассоциация МНС-A*1101 (p = 0,0001) и A*6801 (p = 0,09) аллелей с высокими титрами антител к H1- и H3-гемагглютининам у здоровых субъектов, вакцинированных тривалентной гриппозной вакциной, содержащей вирусные антигены штаммов вируса гриппа A/H1N1 New Caledonia/20/99, A/H3N2 California/7/2004 и B/Shanghai/361/2002 [33,34]. Однако у индивидуумов с аллелью МНС-DQB1*0603-9/14 антител в ответ на вакцинацию не образовывалось [35].
Иммунопрофилактика натуральной оспы. При однократной вакцинации живой оспенной вакциной Dryvax™ высокие уровни противооспенных антител ассоциировались с аллелями класса II DQB1*0302 (p = 0,003) и DQB1*0604 (p = 0,03)9. Еще более четкая корреляция с выраженными иммунными ответами на вакцинацию была установлена для аллелей генов, кодирующих белки МНС класса I: МНС-B*1501 (p = 0,006), B*3508 (p = 0,02), B*4901 (p = 0,04), B*5701 (p = 0,04), B*5802 (p = 0,05), C*0303 (p = 0,01) и C*0704 (p = 0,02). С низкими уровнями в сыворотке крови IFN-гамма ассоциировались гены, кодирующие белки МНС класса I: B*3701 (p = 0,03), B*4001 (p = 0,03), B*5301 (p = 0,04), B*5601 (p = 0,03), C*0102 (p = 0,03), C*0702 (p = 0,04) и C*0801 (p = 0,01) [36].
Иммунопрофилактика гепатита В. Вакцинация оказывалась неудачной у индивидуумов с аллелями DRB1*03, DRB1*07 и DQB1*03. Антитела либо не образовывались, либо их обнаруживали в сыворотке крови в низком титре [37–39]. M. Thursz [40] считает, что эти данные также свидетельствуют о возможности большей чувствительности этих пациентов к инфицированию вирусом гепатита В и длительном поддержании инфекции в персистентном состоянии.
Полиморфизмы генов цитокинов и их рецепторов. Эффективность иммунного ответа на антигены вакцин и способность иммунной системы формировать длительную иммунную память находятся в зависимости от обмена сигналами между клетками иммунной системы, осуществляемого с помощью низкомолекулярных белков — цитокинов. Их продуцентами являются лимфоциты, макрофаги, гранулоциты, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.
TNF-aльфа (tumor necrosis factor, фактор некроза опухоли) — цитокин, активирующий макрофаги и способствующий презентации антигенов посредством MHC класса II. Является важным модулятором продукции хемокинов, необходимых для эффективной миграции лейкоцитов в очаг воспаления. Низкая продукция TNF-aльфа недостаточна для активизации макрофагов до того уровня, когда они способны затормозить инфекционный процесс. Избыточная продукция TNF-aльфа вызывает расстройства гемодинамики (снижает сократимость миокарда, минутный объем крови, диффузно увеличивает проницаемость капилляров), цитотоксический эффект на клетки организма.
Наибольшее значение в эпидемиологии проявления тяжелого клинического течения инфекционной болезни имеет аллель TNF*2, ассоциированная с повышенным синтезом макрофагами фактора некроза опухолей. TNF*2 отличается от распространенной аллели TNF1 более сильным транскрипционным активатором, способствующим увеличению экспрессии TNF-aльфа. Повышенная продукция TNF-aльфа усиливает прогрессирование инфекционной болезни через локальные повреждения тканей и повышает вирулентность патогенов. Установлено, что повышенное в сравнении с нормой количество TNF-aльфа в альвеолярных макрофагах людей усиливает рост M.tuberculosis [41]. Чрезмерная продукция TNF-aльфа ассоциируется также со слизисто-кожным лейшманиозом [42], рубцовой трахомой [43], церебральной малярией [44] и фатальными исходами при менингококковых заболеваниях [45]. Эта же аллель способствует более тяжелому течению инфекции, вызываемой хантавирусом Puumala [46].
Лимфотоксин aльфа (lymphotoxin α, LTA; ранее назывался TNF-бета). Ген LTA локализован на хромосоме 6p21 в непосредственной близости к гену TNF-aльфа и кодирует лимфотоксин — хемокин, секретируемый лимфоцитами и натуральными киллерными клетками. Растворимый α-лимфотоксин представляет собой гомотримеры (homotrimers), способные связываться теми же рецепторами, что и TNF-aльфа. В то же время гетеродимеры (heterotrimers) формируют связанный с мембраной бета-лимфотоксин, взаимодействующий с рецепторами бета-лимфотоксина. Через эти рецепторы лимфотоксины вызывают плейотропные (pleiotropic) иммуномодуляторные эффекты. Локус MHC класса II, включающий LTA, был связан с чувствительностью бразильцев к лепре. Также с повышенной восприимчивостью к лепре у бразильцев ассоциирован гаплотип TNF*1/LTA*2, но не TNF*1/LTA*1. Эти данные предполагают причастность варианта гена лимфотоксина — LTA*2 к развитию эпидемий проказы в отдельных популяциях населения Бразилии [47].
Снипы — самая распространенная причина полиморфизма генов цитокинов и их рецепторов и, соответственно, различий в уровне цитокиновой секреции клетками иммунной системы в ответ на антигенный раздражитель. Обнаружена ассоциация между наличием снипов в структурных и регуляторных участках генов TNF-aльфа, IL-6 (ген интерлейкина 6) и IL-1R (ген антагониста рецептора к интерлейкину 1В) и слабым гуморальным иммунным ответом на однократное введение коревой вакцины [48, 49]. Эти же исследователи по результатам двукратной вакцинации паротитной вакциной установили строгую ассоциацию снипов в генах IL-12RB2 и IL-12RB1 с дозозависимым снижением титров антител и клеточными ответами соответственно [30]. Ими показано, что наличие снипов в генах IL-10 (интерлейкин 10) и IL-12RB2 (рецептор интерлейкина 12) ассоциировано со слабыми гуморальными и клеточными ответами на введение коревой вакцины. В то же время наличие снипов в гене IL-2 (интерлейкин 2) ассоциировано с выраженными гуморальными и клеточными ответами на коревую вакцину [49].
Полиморфизмы цитокиновых генов могут проявляться поствакцинальными осложнениями. S.L. Stanley et al. [50], исследуя причины развития лихорадки (t ≥ 37,7 °C) у пациентов, вакцинированных оспенной вакциной DryvaxTM, обнаружили, что лихорадочная реакция на введение вакцины находится в достоверной ассоциации со специфическими гаплотипами IL-1-генного комплекса на хромосоме 2 и гаплотипом в пределах гена IL-18 на хромосоме 11. Обнаружена связь миоперикардита, возникающего у человека после вакцинации DryvaxTM, с отдельными гаплотипами IL-1, IL-18 и др. Полиморфизмы генов IL-1, IL-4 или IL-18 являются причиной таких же поствакцинальных осложнений у пациентов после иммунизации MMR-вакциной и др. [51, 52].
Недостаточная экспрессия IL-12 и его клеточного рецептора (IL-12Rb1) приводит к снижению секреции IFN-гамма NK- и T-клетками и, соответственно, к недостаточности клеточно-опосредованного иммунного ответа. Крупная делеция в гене IL-12, наследуемая по аутосомно-рецессивному типу, ассоциирована с диссеминацией туберкулезной вакцины на основе штамма BCG у детей [53]. Аналогичные наблюдения сделаны H. Elloumi-Zghal et al. [54] при исследовании детей с генерализацией вакцины BCG (лихорадка, аденопатия разной локализации, гепатоспленомегалия и др.). Ими показана гетерогенность мутаций в гене рецептора IL-12 (IL-12Rb1) и зависимость клинического течения болезни от типа мутации. Однако у родителей этих детей мутаций в гене IL-12Rb1 обнаружено не было. Авторы объясняют накопление таких мутаций среди жителей Туниса распространением в этой стране близкородственных браков.
Тяжелое клиническое течение генерализация вакцины BCG приобретает у новорожденных детей с мутацией в гене рецептора IL-2 (IL-2Ry), что связано с ключевой ролью IL-2 в индукции пролиферации В-лимфоцитов и цитотоксических Т-лимфоцитов, и синтезе и секреции других лимфокинов: IL-4, IL-6, гамма-интерферона, колониестимулирующих факторов (CSFs), факторов некроза опухолей (TNFs) [55].
Интерфероны. Под интерферонами понимают группу сходных по свойствам белков — цитокинов, подавляющих внутриклеточное размножение вирусов. Интерферон альфа и интерферон бета продуцируются лейкоцитами и фибробластами; гамма-интерферон — продукт CD4 Т-клеток воспаления, CD8 Т-клеток, натуральных киллеров. Врожденная недостаточность системы интерферона снижает способность фагоцитирующих клеток противодействовать размножению бактериальных возбудителей инфекционных болезней. Вспышки болезней, вызванные малопатогенными микобактериями Mycobacterium fortuitum, M.chelonei, M.avium, M.smegmatis, бациллы Кальметта — Герена (M.bovis) и др., являются следствием присутствия в человеческих популяциях какого-то порогового количества людей с мутациями в следующих четырех генах: IFN-γR1 (рецептор гамма-интерферона 1), IFN-γR2 (рецептор гамма-интерферона 2), IL-12Rγ1 (рецептор b1 интерлейкина-12) и IL-12p40 [19, 56].
Ген IFN-γR1 расположен в регионе хромосомы 6q22q23. Различные мутации гена приводят к разным последствиям. Например, если ген IFN-γyR1 полностью утратит способность к экспрессии белков, формирующих рецептор, то на поверхности клетки такого рецептора не будет. Известны также мутации, приводящие к экспрессии на клеточной поверхности мутантных белков, способных связывать IFN-γR1, однако не трансдуцирующих сигнал по сигнальным путям клетки [57].
Мутантный ген IFN-γR1 обычно обнаруживают у родственников в семьях больных туберкулезом. В зависимости от типа наследования (рецессивного и доминантного) и этнической принадлежности человека, носителя мутации, меняется клиника осложнения и уменьшаются шансы на возможность эффективной терапии. У представителей французского этноса мутация гена IFN-γR1 приводит к диссеминации BCG и летальному лептоменингиту [58]; у японцев — к тяжелым формам BCG-остеомиелита [59], что, возможно, связано с относительной генетической однородностью японского этноса, изолированно проживающего на островах уже более тысячи лет. Полная инактивация гена IFN-γR1 приводит к развитию летальной лепроматоидной BCG-инфекции [58]. На рис. 5 на примере трех семей показан процесс накопления в популяции людей с мутациями гена IFN-γR1.
/108/108.jpg)
Внешне процесс накопления в популяции людей с мутациями гена IFN-γR1 будет проявляться учащением случаев осложнений, возникающих у детей после вакцинации вакциной BCG, что ошибочно можно принять за результат плохого контроля качества вакцины производителями. Процесс накопления мутаций в гене IFN-γR1 далеко не случаен, так как ген располагается в участке хромосомы, участвующем в ее репликации, где высока вероятность возникновения спонтанных мутаций вследствие ошибок в спаривании нуклеотидов [57].
В двух независимых клинических исследованиях обнаружена ассоциация двух несинонимичных снипов в гене метилентерахлоридфолатредуктазы (methylenetetrahydrofolate reductase gene) и двух снипов в гене фактора регуляции интерферона (IFN regulatory factor-1 gene), с тяжелыми осложнениями (лихорадка, лимфаденопатия или генерализованная сыпь), развивающимися после вакцинации живой оспенной вакциной APSV (Aventis Pasteur smallpox vaccine) [60].
Клеточные рецепторы, не относящиеся к цитокиновым. Такое деление рецепторов, участвующих в иммунных ответах на патогенные микроорганизмы, условно. В данной работе оно проведено для отделения иммунных реакций, управление которыми осуществляется низкомолекулярными белками-цитокинами, от тех, которые вызываются непосредственным взаимодействием патогенного микроорганизма с рецепторами клеток.
Толл-подобные рецепторы — класс клеточных рецепторов с одним трансмембранным фрагментом, распознающих консервативные структуры микроорганизмов и активирующих клеточный иммунный ответ. Известно 13 толл-подобных рецепторов млекопитающих, обозначаемых аббревиатурами от TLR1 до TLR13. У человека обнаружено 10 толл-подобных рецепторов (от TLR1 до TLR10). Они играют роль моста между врожденным и адаптивным иммунитетом [61].
Благодаря снипам TLR обладают выраженной полиморфностью N. Dhiman et al. [62] при генотипировании 190 пациентов в возрасте от 12 до 18 лет обнаружили 6 вариантов снипов в генах TLR. Их роль в иммунных ответах на вакцинацию изучена у пациентов, вакцинированных живой коревой вакциной. Установлено, что гетерозиготные варианты rs3775291 (Phe412Leu) и rs5743305 (–926 п.о. в промоторном регионе гена) TLR3 ассоциированы со слабыми антительными и лимфопролиферативными ответами (p ≤ 0,02) на двукратную вакцинацию коревой вакциной. Гетерозиготные варианты rs4986790 (Gly299Asp) и rs4986791 (Ile399Thr) в гене TLR4 демонстрируют высокий уровень секреции IL-4 (p ≤ 0,02). Гетерозиготные варианты снипов в TLR5 (rs5744174) и TLR6 (rs5743818) ассоциированы с высокими уровнями секреции IFN-γ (p ≤ 0,02).
Рецепторы SLAM (signaling lymphocyte activation molecule) и CD46 (membrane cofactor protein). Рецепторы SLAM расположены на мембране лимфоцитов и стимулируют Т- и В-лимфоциты, рецептор CD46 экспрессируется всеми клетками тканей человека, кроме эритроцитов, и выполняет функцию кофактора фактора комплемента I, сериновой протеазы, которая защищает аутологические клетки против атаки системой комплемента с помощью протеолиза факторов C3b и C4b, прикрепляющихся к ткани. С обоими рецепторами взаимодействует вирус кори. G.A. Poland et al. [63] показали ассоциацию минорных аллелей rs3796504 и rs164288 SLAM-гена с дозозависимым четырехкратным снижением IgG-антител в сыворотке крови детей, вакцинированных живой коревой вакциной. Снип (rs2724384), расположенный в интронном участке гена CD46, ассоциирован с двухкратным дозозависимым снижением IgG-антител в сыворотке крови после вакцинации живой коревой вакциной.
Рецепторы витаминов А (retinoic acid receptor, RAR) и D (vitamin D receptor, VDR). Витамин А (ретинол), витамин D (холекальциферол) и их рецепторы — важные регуляторы иммунных ответов на возбудители инфекционных болезней. Метаболиты витаминов А и D, такие как ретиноевая кислота (retinoic acid) и 1,25-дигидроксивитамин D3 (1,25-dihydroxyvitamin D3), соответственно, обладают самостоятельным иммунорегуляторным действием [64].
Известен один тип рецептора для витамина D — рецептор мембраны ядра клетки VDR/RXRA; и три типа рецепторов ретиноевой кислоты, принадлежащих к семейству ядерных рецепторов для гормонов: aльфа-рецептор ретиноевой кислоты (retinoic acid receptor alpha, RARA), бета-рецептор ретиноевой кислоты (retinoic acid receptor beta, RARB) и гамма-рецептор ретиноевой кислоты (retinoic acid receptor gamma, RARG). Благодаря наличию снипов в промоторных и интронных областях гены рецепторов витаминов А и D гетерогенны [64].
Рецептор витамина D образует гетеродимер (heterodimer) с ретиноидным aльфа-X-рецептором клеточного ядра (nuclear retinoid X receptor alpha, RXRA). Посредством рецептора VDR/RXRA модулируются цитокиновые ответы Т-клеток. Мутация в гене, кодирующем мембранный белок, формирующий рецептор, приводит к врожденной низкой усвояемости витамина D. Одновременно этот генотип ассоциируется с повышенным риском развития остеопорозов. Полиморфизмы гена рецептора витамина D связаны с повышенной восприимчивостью к возбудителям инфекций, таким как ВИЧ-1, вирус гепатита В (HBV), человеческий Т-лимфотропный вирус первого типа (HTLV-1) и микобактерии, вызывающие туберкулез [65, 66].
Установлено статистически достоверное снижение выраженности гуморальных (титры специфических антител в сыворотке крови) и клеточных иммунных ответов (содержание IL-2, IL-6, IL-10, IFN-aльфа, IFN-гамма и TNF-альфа в сыворотке крови) на коревую вакцину у здоровых детей белой расы, с поврежденными снипами генами рецепторов витаминов А и D [64].
Врожденная недостаточность функции фагоцитоза. В хромосоме 2q35 человека был идентифицирован ген NRAMP1 (natural resistance-associated macrophage protein gene 1, другое название — SLC11A1), гомологичный мышиному Bcg-гену, который придает мышам резистентность к бациллам Кальметта — Герена и к возбудителю лепры. Биохимическая функция белка полностью не ясна, но есть основания считать, что он способствует функции фагоцитоза у макрофагов и «представлению» ими антигенов Т-хелперам. Первые прямые доказательства причастности мутантных аллелей этого гена к развитию проказы получены при изучении эпидемиологии болезни среди населения Южного Вьетнама [67]. Отдельные аллели гена с высокой частотой преобладают в восточноафриканской популяции, но редко встречаются в европейских. Это наблюдение может частично объяснить более высокую в сравнении с другими этническими группами чувствительность восточных африканцев к туберкулезу [65]. Нетранслируемый ген NRAMP1 у жителей Гамбии ассоциируется с открытыми формами легочного туберкулеза и, следовательно, с передачей M.tuberculosis по эпидемической цепочке — от одного заболевшего к другому [19]. Установлена ассоциация N02C-аллели NRAMP1 у детей различных этнических групп, живущих в Большом Хьюстоне (США), со злокачественным течением туберкулеза [68]. Выявлена ассоциация мутантных аллелей этого гена с диссеминацией у детей вакцины BCG [69].
Маннозасвязывающий лектин (mannose-binding lectin 2, MBL2). Кальцийзависимый маннозасвязывающий лектин сыворотки крови связывается с терминальными маннозными группами на поверхности различных бактерий и вирусов. Тем самым он инициирует активацию комплемента (классический путь) и механизм опосонофагоцитоза (opsonophagocytosis), не зависящего от антител и Clq (одна из трех субъединиц белка Cl комплемента, в ее составе имеется рецептор для связывания с Fc-фрагментом антитела). Мутация в экзоне 1 MBL2 снижает концентрацию MBL в сыворотке, вероятно, вследствие интерференции с олигомеризованным белком. Низкие уровни MBL могут быть связаны с рекуррентными инфекциями у детей. Мутация в экзоне 1 у отдельных этнических групп ассоциируется с менингеальным туберкулезом [70]. L. Pöyhönen et al. [71] получили данные, позволяющие им предположить, что низкое содержание MBL в сыворотке крови детей ассоциировано с риском развития у них BCG-остеитов.
Приведенные данные показывают фрагментарную изученность роли отдельных аллелей генов человека в ответах иммунной системы на возбудители инфекционной болезни или вакцинацию. В то же время участие отдельных генов в иммунных ответах может носить универсальный характер (TNF*2, NRAMP1 и др.). Полиморфизм генов IL-1, IL-4 или IL-18 является причиной сходных поствакцинальных осложнений у пациентов после иммунизации MMR-вакциной, живой оспенной вакциной и др. [50–52]. Поэтому в табл. 5 нами указана, помимо известной, еще и их возможная ассоциация с осложнениями, развивающимися после вакцинации.
Динамика эпидемического процесса, наиболее характерная для него клиническая картина болезни, эффективность и безопасность вакцинации, частота поствакцинальных осложнений, среди прочих факторов находятся в тесной зависимости от относительного количества в популяции лиц с дефектами (полиморфизмами) генов иммунной системы и систем, участвующих в патогенезе болезни. Полиморфизация таких генов происходит спонтанно, в результате образования снипов и делеций, распределяющихся в следующих поколениях в соответствии с законами Менделя. Снятие селективного давления на популяции людей со стороны возбудителей контагиозных циклических инфекций одновременно устранило механизмы, ограничивающие этот процесс. Темпы накопления полиморфизмов возрастают в относительно генетически однородных популяциях (жители островных государств) и в популяциях, практикующих браки между родственниками.
Иммунизация живой коревой вакциной малоэффективна у индивидуумов с МНС I B8, B13, B44, B58; МНС II DRB1*03, DQA1*0201 DRB1*07-DQB1*02-DPB1*02 и DRB1*07-DQB1*03-DPB1*04; снипами в генах, кодирующих рецепторы TLR3 (rs164288, rs3775291, rs3796504, rs5743305), SLAM (rs2724384) и CD46.
Иммунизация живой паротитной вакциной малоэффективна у индивидуумов с МНС II DQB1*0303 и снипами в генах IL-12RB2, IL-12RB1, IL-10 и IL-12RB2.
Иммунизация живой вакциной против краснухи малоэффективна у индивидуумов с МНС-A (*2402 и *6801).
Иммунизация вакциной против гепатита В малоэффективна у индивидуумов с МНС II DRB1*03, DRB1*07 и DQB1*03.
Иммунизация гриппозными вакцинами малоэффективна у индивидуумов с МНС DQB1*0603-9/14.
Осложнения после вакцинации живой оспенной вакциной возможны у индивидуумов с МНС класса I: B*3701, B*4001, B*5301, B*5601, C*0102, C*0702 и C*0801 и с отдельными гаплотипами IL-1, IL-18.
Диссеминация туберкулезной вакцины на основе штамма BCG у ребенка возможна при наличии снипов и делеций в генах: NRAMP1, MBL (развитие BCG-остеита), витамина D, IL-2, IL-12, IFN-гамма и их рецепторов.
Расследование случаев поствакцинальных осложнений должно проводиться с учетом причастности генетического фактора, включая, помимо генов иммунной системы, выявление влияния на патогенез инфекционной болезни генетических дефектных физиологических систем организма человека.
1. Ясинский А.А., Михеева И.В. Безопасность иммунизации // Вакцины и вакцинация. Национальное руководство / Зверев В.В., Семенов Б.Ф., Хаитов Р.М. — М., 2011. — С. 137–61.
2. Blackwell J.M., Jamieson S.F., Burgner D. HLA and Infectious Diseases // Clinical Microbiology Reviews. — 2009. — № 22(2). — Р. 370–85.
3. Петухов В.Л., Жигачев А.И., Назарова Г.А. Ветеринарная генетика. — М., 1996.
4. Hill A. Genetics of infectious disease // Phil. Trans. R. Soc. B. — 2012 — № 367. — Р. 840–9.
5. Губерт В.О. Оспа и оспопрививание. — СПб., 1896.
6. Downie A.W., McCarthy K. The antibody response in man following infection with viruses of the pox group. III. Antibody response in smallpox // J. Hyg. (London). — 1958. — № 56. — Р. 479–87.
7. Rumyantsev S.N. The origin of individual differences in the course and severity of diseases // The Sci. World J. — 2006. — № 6. — Р. 1674–704.
8. Poland G.A., Ovsyannikova I.G., Jacobson R.M. Vaccine immunogenetics: bedside to bench to population // Vaccine. — 2008. — № 26(49). — Р. 6183–8.
9. Marquet S., Schurr E. Genetics of susceptibility to infectious diseases: tuberculosis and leprosy as examples // Drug Metabolism and Disposition. — 2001. — № 29(4). — Р. 478–83.
10. Rasmussen A.L., Okumura A., Ferris M.T., Green R., Feldmann F., Kelly S.M. et al. Host genetic diversity enables Ebola hemorrhagic fever pathogenesis and resistance // Science. — 2014. — № 346(6212). — Р. 987–91.
11. Blackwell J.M., Jamieson S.F., Burgner D. HLA and Infectious Diseases // Clinical Microbiology Reviews. — 2009. — № 22(2). — Р. 370–85.
12. Галактионов В.Г. Иммунология. — М., 1998.
13. Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология. — СПб., 1998.
14. Короткова И.Ю. Клиническая иммуногенетика заболеваний, злокачественных новообразований и хронических воспалительных процессов: Автореф. дис… д-ра мед. наук. — Новосибирск, 2007.
15. Бухарин О.В., Усвяцов Б.Я. Бактерионосительство. — Екатеринбург, 1996.
16. Singh N., Agrawal S., Rastogi A. Infectious diseases and immunity: Special reference to major histocompatability complex // Emerging Infectious Diseases. — 1997. — № 3(1). — Р. 24–34.
17. Helbig K., Harris R., Ayres J., Dunckley H., Lloyd A., Robson J., Marmion B.P. Immune response genes in the post-Q-fever fatigue syndrome, Q fever endocarditis and uncomplicated acute primary Q fever // Q.J. Med. — 2005. — № 98. — Р. 565–74.
18. Hill A., Elvin J., Will A., Aidoo M., Allsopp C.E., Gotch F.M. et al. Molecular analysis of the association of HLA-B53 and resistance to severe malaria // Nature. — 1992. — № 360. — Р. 434–9.
19. Hill A. Genetics and genomics of infectious disease susceptibility // British Medical Bulletin. — 1999. — № 55(2). — Р. 401–13.
20. Wilson A., Symons J., McDowell T., McDevitt H.O., Duff G.W. Effects of polymorphism in the tumor necrosis factor alpha promoter on transcriptional activation // Proc. Natl. Acad. Sci. USA. — 1997. — № 94(10). — Р. 3195–9.
21. Kalish R.A., Leong J.M., Steere A.C. Association of treatment–resistant chronic Lyme arthritis with HLA-DR4 and antibody reactivity to OspA and OspB of Borrelia burgdorferi // Infect. Immun. — 1993. — № 61(7). — Р. 2774–9.
22. Fitness J., Tosh K., Hill A. Genetics of susceptibility to leprosy // Genes and Immunity. — 2002. — № 3. — Р. 441–53.
23. Singh N., Agrawal S., Rastogi A. Infectious diseases and immunity: Special reference to major histocompatability complex // Emerging Infectious Diseases. — 1997. — № 3(1). — Р. 24–34.
24. Захарычева Т.А., Колотушкина Г.Б., Жукова С.Г., Сай И.А. Антигены системы HLA у больных различными формами клещевого энцефалита в хабаровском крае // Нейроиммунология. Юбилейная X конференция. 28–31 мая 2001 г. — Т. 2. — С. 223–97.
25. Poland G.A., Ovsyannikova I.G., Jacobson R.M., Vierkant R.A., Jacobsen S.J., Pankratz V.S., Schaid D.J. Identification of an association between HLA class II alleles and low antibody levels after measles immunization // Vaccine. — 2001. — № 20. — Р. 430–8.
26. Jacobson R.M., Poland G.A., Vierkant R.A., Pankratzd V., Schaidd D.J., Jacobsene S.J. et al. The association of class I HLA alleles and antibody levels following a single dose of measles vaccine // Hum. Immunol. — 2003. — № 64. — Р. 103–9.
27. Ovsyannikova I.G., Jacobson R.M., Vierkant R.A., Shane Pankratz V., Jacobsen S.J., Poland G.A. Associations between human leukocyte antigen (HLA) alleles and very high levels of measles antibody following vaccination // Vaccine. — 2004. — № 22. — Р. 1914–20.
28. Ovsyannikova I.G., Jacobson R.M., Vierkant R.A., Pankratz V.S., Poland G.A. HLA supertypes and immune responses to measles-mumps-rubella viral vaccine: findings and implications for vaccine design // Vaccine. — 2007. — № 25. — Р. 3090–100.
29. Ovsyannikova I.G., Pankratz S.V., Vierkant R., Jacobson R.M., Poland G.A. Human leukocyte antigen haplotypes in the genetic control of immune response to measles-mumps-rubella vaccine // J. Infect. Dis. — 2006. — № 193. — Р. 655–63.
30. Ovsyannikova I.G., Jacobson R.M., Dhiman N., Vierkant R.A., Pankratz V.S., Poland G.A. Human leukocyte antigen and cytokine receptor gene polymorphisms associated with heterogeneous immune responses to mumps viral vaccine // Pediatrics. — 2008. — № 121. — Р. 1091–9.
31. Ovsyannikova I.G., Jacobson R.M., Ryan J.E. et al. Relationship between HLA polymorphisms and interferon and interleukin-10 cytokine production in healthy individuals after rubella vaccination // Clin. Vaccine Immunol. — 2007. — № 14. — Р. 115–22.
32. Poland G.A., Ovsyannikova I.G., Jacobson R.M. Application of pharmacogenomics to vaccines // Pharmacogenomics. — 2009. — № 10(5). — Р. 837–52.
33. Poland G.A., Ovsyannikova I.G., Jacobson R.M. Immunogenetics of seasonal influenza vaccine response // Vaccine. — 2008. — № 26. — Р. 35–40.
34. Poland G.A., Ovsyannikova I.G., Jacobson R.M. Immunogenetics of seasonal influenza vaccine response // Vaccine. — 2008. — № 26. — Р. 6183–8.
35. Gelder C.M., Lambkin R., Hart K.W., Fleming D., Williams O.M., Bunce M. et al. Associations between human leukocyte antigens and nonresponsiveness to influenza vaccine // J. Infect. Dis. — 2002. — № 185. — Р. 114–7.
36. Ovsyannikova I.G., Jacobson R.M., Targonski P.V. et al. Vaccine Congress. Amsterdam: The Netherlands; 2007. Influence of host genetic variation on the immune response to the smallpox vaccine; p. 9–11. Abstract 033.
37. Willems A., Leroux–Roels G. Response to hepatitis B vaccine: multiple HLA genes are involved // Tissue Antigens. — 1998. — № 51(6). — Р. 593–604.
38. Poland G.A., Ovsyannikova I.G., Jacobson R.M., Vierkant R.A., Jacobsen S.J., Pankratz V.S., Schaid D.J. Identification of an association between HLA class II alleles and low antibody levels after measles immunization // Vaccine. — 2001. — № 20. — Р. 430–8.
39. Wang C., Tang J., Song W., Lobashevsky E., Wilson C.M., Kaslow R.A. HLA and cytokine gene polymorphisms are independently associated with responses to hepatitis B vaccination // Hepatology. — 2004. — № 39(4). — Р. 978–88.
40. Thursz M. Pros and cons of genetic association studies in hepatitis B // Hepatology. — 2004. — № 40(2) — Р. 284–6.
41. Engele M., Stossel E., Castiglione K., Schwerdtner N., Wagner W., Bölcskei P. et al. Induction of TNF in human alveolar macrophages as a potential evasion mechanism of virulent Mycobacterium tuberculosis // J. Immunol. — 2002. — № 168. — Р. 1328–37.
42. Cabrera M., Shaw M.A., Sharples C., Williams H., Castes M., Convit J. et al. Polymorphism in tumor necrosis factor genes associated with mucocutaneous leishmaniasis // J. Exp. Med. — 1995. — № 182. — Р. 1259–64.
43. Conway D.J., Holland M.J., Bailey R.L., Campbell A.E., Mahdi O.S.M., Jennings R. et al. Scarring trachoma is associated with polymorphism in the tumor necrosis factor alpha (TNF-alpha) gene promoter and with elevated TNF-alpha levels in tear fluid // Infect. Immun. — 1997. — № 65. — Р. 1003–6.
44. McGuire W., Hill A., Allsopp C., Greenwood B.M., Kwiatkowski D. Variation in the TNF-aльфа promoter region associated with susceptibility to cerebral malaria // Nature. — 1994. — № 371. — Р. 508–11.
45. Nadal D., Leppert D., Frei K., Gallo P., Lamche H., Fontana A. Tumour necrosis factor-alpha in infectious meningitis // Arch. Dis. Child. — 1989. — № 64. — Р. 1274–9.
46. Wilson A., Symons J., McDowell T., McDevitt H.O., Duff G.W. Effects of polymorphism in the tumor necrosis factor alpha promoter on transcriptional activation // Proc. Natl. Acad. Sci. USA. — 1997. — № 94(10). — Р. 3195–9.
47. Shaw M.A., Donaldson I.J., Collins A., Peacock C.S., Lins-Lainson Z., Shaw J.J. et al. Association and linkage of leprosy phenotypes with HLA class II and tumour necrosis factor genes // Genes. Immun. — 2001. — № 2. — Р. 196–204.
48. Dhiman N., Ovsyannikova I.G., Vierkant R.A., Pankratz V.S., Jacobson R.M., Poland G.A. Associations between cytokine/cytokine receptor SNPs and humoral immunity to measles, mumps and rubella in a Somali population // Tissue Antigens. — 2008. — № 72. — Р. 211–20.
49. Dhiman N., Ovsyannikova I.G., Cunningham J.M., Robert A. Vierkantc, V. Pankratzc S., Jacobson R.M. et al. Associations between measles vaccine immunity and single nucleotide polymorphisms in cytokine and cytokine receptor genes // J. Infect. Dis. — 2007. — № 195. — Р. 21–9.
50. Stanley S.L. Jr, Frey S.E., Taillon-Miller P., Guo J., Miller R.D., Koboldt D.C. et al. The immunogenetics of smallpox vaccination // J. Infect. Dis. — 2007. — № 196. — Р. 212–219.
51. Usonis V., Bakasenas V., Kaufhold A., Chitour K., Clemens R. Reactogenicity and immunogenicity of a new live attenuated combined measles, mumps and rubella vaccine in healthy children // Pediatr. Infect. Dis. J. — 1999. — № 18. — Р. 42–48.
52. Vestergaard M., Hviid A., Madsen K.M., Wohlfahrt J., Thorsen P., Schendel D., Melbye M., Olsen J. MMR vaccination and febrile seizures: evaluation of susceptible subgroups and long-term prognosis // JAMA. — 2004. — № 292. — Р. 351–7.
53. Altare F., Lammas D., Revy P., Jouanguy E., Döffinger R., Lamhamedi S. et al. Inherited Interleukin 12 deficiency in a child with bacille Calmette-Guerin and Salmonella enteritidis disseminated Infection // J. Clin. Invest. — 1998. — № 102(12). — Р. 2035–40.
54. Elloumi-Zghal H., Ridha Barbouche M., Chemli J., Bejaoui M., Harbi A., Snoussi N., Abdelhak S., Dellagi K. Clinical and genetic heterogeneity of inherited autosomal recessive susceptibility to disseminated Mycobacterium bovis Bacille Calmette-Guerin infection // The Journal of Infectious Diseases. — 2002. — № 185. — Р. 1468–75.
55. Li-Hsin H., Shyh-Dar S., Jyh-Der W., Shin-Chi, Chin-Yuan T., Fu-Yuan H. Disseminated bacille Calmette-Guérin disease as the initial presentation of X-linked severe combined Immunode-ficiency. A case report // Asian Pacific Journal of Allergy and Immunology. — 2005. — № 23. — Р. 221–6.
56. Marquet S., Schurr E. Genetics of susceptibility to infectious diseases: tuberculosis and leprosy as examples // Drug Metabolism and Disposition. — 2001. — № 29(4). — Р. 478–83.
57. Jouanguy E., Lamhamedi-Cherradi S., Lammas D. et al. A human IFNGR1 small deletion hotspot associated with dominant susceptibility to mycobacterial infection // Nat. Genet. — 1999. — № 21. — Р. 370–8.
58. Jouanguy E., Lamhamedi-Cherradi S., Altare F., Fondanèche M.C., Tuerlinckx D., Blanche S. et al. Partial interferon-γ receptor 1 deficiency in a child with tuberculoid Bacillus Calmette-Guerin infection and a sibling with clinical tuberculosis // J. Clin. Invest. — 1997. — № 100(11). — Р. 2658–64.
59. Sasaki Y., Nomura A., Kusuhara K., Takada H., Ahmed S., Obinata K., Hamada K., Okimoto Y., Hara T. Genetic basis of patients with bacille Calmette-Guerin osteomyelitis in Japan: identification of dominant partial interferon– receptor 1 deficiency as a predominant type // J. Infect. Dis. — 2002. — № 185. — Р. 706–9.
60. Reif D.M., McKinney B.A., Motsinger A.A., Chanock S.J., Edwards K.M., Rock M.T., Moore J.H. et al. Genetic basis for adverse events after smallpox vaccination // J. Infect. Dis. — 2008. — № 198. — Р. 1–7.
61. Dhiman N., Ovsyannikova I.G., Vierkant R.A., Pankratz V.S., Jacobson R.M., Poland G.A. Associations between cytokine/cytokine receptor SNPs and humoral immunity to measles, mumps and rubella in a Somali population // Tissue Antigens. — 2008б — № 72. — Р. 211–20.
62. Dhiman N., Ovsyannikova I.G., Vierkant R.A. et al. Associations between SNPs in toll-like receptors and related intracellular signaling molecules and immune responses to measles vaccine: preliminary results // Vaccine. — 2008. — № 26. — Р. 1731–36.
63. Poland G.A., Ovsyannikova I.G., Jacobson R.M. Application of pharmacogenomics to vaccines // Pharmacogenomics. — 2009. — № 10(5). — Р. 837–52.
64. Ovsyannikova I.G., Haralambieva I.H., Vierkant R.A., O’Byrne M.M., Jacobson R.M., Poland G.A. Effects of vitamin A and D receptor gene polymorphisms/haplotypes on immune responses to measles vaccine // Pharmacogenet Genomics. — 2012. — № 22(1). — Р. 20–31.
65. McNicholl J., Smith D.K., Qari S., Hodge T. Host genes and HIV: the role of the chemokine receptor gene CCR5 and its allele // Emerging Infectious diseases. — 1997. — № 3(3). — Р. 261–72.
66. Bellamy R., Ruwende C., Corrah T., McAdam K.P.W.J., Thursz M., Whittle H.C., Hill A.V.S. Tuberculosis and chronic hepatitis B virus infection in africans and variation in the vitamin D receptor gene // The Journal of Infectious Diseases. — 1999. — № 179. — Р. 721–4.
67. Abel L., Vu D.L., Oberti J., Nguyen V.T., Van V.C., Guilloud-Bataille M., Schurr E., Lagrange P.H. et al. Complex segregation analysis of leprosy in southern Vietnam // Genet. Epidemiol. — 1995. — № 12. — Р. 63–82.
68. Malik S., Abel L., Tooker H., Poon A., Simkin L., Girard M. et al. Alleles of the NRAMP1 gene are risk factors for pediatric tuberculosis disease // Proc. Natl. Acad. Sci. USA. — 2005. — № 102(34). — Р. 12183–8.
69. Alm J., Sanjeevi C.B., Miller E.N., Dabadghao P., Lilja G., Pershagen G. et al. Atopy in children in relation to BCG vaccination and genetic polymorphisms at SLC11A1 (formerly NRAMP1) and D2S1471 // Genes and Immunity. — 2002. — № 3. — Р. 71–7.
70. Hoal-Van H., Epstein J., Victor T., Hon D., Lewis L.A., Beyers N. et al. Mannosebinding protein B allele confers protection against tuberculous meningitis // Pediatr. Res. — 1999. — № 45(Pt. 1). — Р. 459–64.
71. Pöyhönen L., Kröger L., Gröndahl-Yli-Hannuksela K., Vuononvirta J., Huhtala H., He Q., Korppi M. Variant MBL2 genotypes producing low mannose-binding lectin may increase risk of Bacillus Calmette-Guerin osteitis in vaccinated newborns // Acta Paediatr. — 2013. — № 102(11). — Р. 1095–9.

/101/101.jpg)
/102/102.jpg)
/104/104.jpg)
/105/105_2.jpg)
/110/110.jpg)
/111/111.jpg)
/112/112.jpg)