Статья опубликована на с. 91-95
Введение
Синдром грушевидной мышцы (СГМ) по своей сути является периферической невропатией седалищного нерва, обусловленной дисфункцией грушевидной мышцы. Очень часто в клинической практике СГМ остается недиагностированным по причине того, что клинические проявления могут маскировать заболевание под картину других состояний: грыжи межпозвоночного диска, поясничной радикулопатии, дисфункции пояснично-крестцового сочленения, сакроилеита, ишиаса или бурсита большого вертела бедренной кости.
Не вовремя или неверно поставленный диагноз может привести к необратимым патологическим изменениям седалищного нерва, проявляющимся болью, парестезиями, гиперестезиями или мышечной слабостью. Задача врача — определить симптомы и признаки СГМ и вовремя начать адекватную терапию.
Эпидемиология
СГМ встречается у 6–35 % пациентов с болью в нижней части спины (БНЧС) [3, 4, 11]. Такой разброс можно объяснить трудностью диагностики СГМ и частым его невыявлением на фоне сопутствующих маскирующих патологий. Пик встречаемости наблюдается у людей в возрасте 30–50 лет независимо от профессии или уровня физической активности [7–12]. Наиболее часто страдают женщины. Вероятно, это связано с особенностями строения таза и более широким углом четырехглавой мышцы бедра [3].
Анатомические особенности
Грушевидная мышца (рис. 1) является наружным ротатором, слабым абдуктором и слабым флексором бедра. Мышца берет свое начало на передней поверхности крестца, обычно на уровне S2-S4 позвонков и крепится к переднемедиальному краю большого вертела бедренной кости при помощи круглого сухожилия [1, 13, 14]. Иннервируется мышца спинномозговыми корешками S1-S2, реже — L5.
Этиология и патогенез
Выделяют первичные и вторичные СГМ. Первичные синдромы имеют под собой особый анатомический субстрат, такой как разделение грушевидной мышцы седалищным нервом, разделение самого нерва или его аномальное расположение [8, 9, 12]. Вторичные СГМ являются следствием микро- или макротравмы, разной длины ног (разница длины должна составлять минимум 1,0–1,5 см), локальной ишемии или ишемического масс-эффекта [11, 21, 22]. В клинической практике чаще встречаются вторичные СГМ и составляют до 85 % всех случаев [4, 11].
Наиболее частая причина СГМ (около 50 % всех случаев) — макротравма ягодиц, приводящая к локальному воспалению, мышечному спазму и компрессии седалищного нерва [15]. Травма может иметь место за несколько месяцев до появления клинической симптоматики. Выделяясь из спазмированной мышцы, провоспалительные вещества, такие как простагландин, брадикинин и гистамин, раздражают седалищный нерв, что приводит к возникновению порочного круга «боль — спазм — воспаление» [25]. Микротравма может возникнуть вследствие перегрузки грушевидной мышцы в результате длительной ходьбы, бега или продолжительного сидения на твердой поверхности.
Клиническая картина
Наиболее частым симптомом СГМ является усиление боли в области ягодицы, появляющееся после продолжительного (более 15–20 минут) нахождения в положении сидя. Пациенты могут жаловаться на трудности при ходьбе или боль при внутренней ротации противоположной ноги (например, в положении сидя, нога на ногу) [8, 9, 11, 21, 23].Часто пациенты жалуются на боль, онемение, чувство покалывания или ползания мурашек по задней поверхности бедра. Данная симптоматика наблюдается при компрессии малоберцовой ветви седалищного нерва.
Симптомы, встречающиеся при СГМ
Усиление или появление боли в положении сидя, стоя или лежа более 15–20 минут.
Боль и/или парестезии в области ягодиц и задней поверхности бедра.
Боль уменьшается при ходьбе и усиливается в покое.
Боль при вставании со стула.
Смена положения тела не устраняет боль полностью.
Боль в области противоположного крестцово-подвздошного сочленения.
Сложности при ходьбе (анталгическая походка, свисающая стопа).
Онемение стопы.
Слабость в одноименной ноге.
Головная, абдоминальная, тазовая боль.
Диспареуния у женщин.
Боль при дефекации.
Клинические признаки, указывающие на СГМ, прямо или косвенно связаны с мышечным спазмом и/или компрессией нерва. Характерным признаком является болезненность при пальпации грушевидной мышцы, особенно в области ее прикрепления к большому вертелу бедренной кости. Пациенты могут отмечать боль при пальпации в области крестцово-подвздошного сустава, большой седалищной вырезки или самой грушевидной мышцы, которая может принимать вид болезненного тяжа.
Клинические признаки, указывающие на СГМ
Болезненность при пальпации в области крестцово-подвздошного сочленения, большой седалищной вырезки и грушевидной мышцы.
Болезненная, спазмированная грушевидная мышца.
Вытяжение одноименной конечности умеренно уменьшает боль.
Мышечная слабость в одноименной конечности.
Положительный симптом грушевидной мышцы.
Положительный симптом Лассега.
Положительный симптом Фрайберга.
Положительный симптом Пэйса (САВР-тест — сгибание, аддукция, внутренняя ротация).
Положительный симптом Беатти.
Ограниченная медиальная ротация одноименной конечности.
Короткая нога на стороне поражения.
Атрофия мышц ягодицы (в хронических случаях).
Диагностика
Несмотря на то что существует целый ряд тестов, которые могут помочь в выявлении СГМ, ни один из них не может считаться специфичным для данной патологии.
Симптом грушевидной мышцы проявляется в пассивной наружной ротации пораженной ноги в положении пациента лежа на спине.
Симптом Лассега при положительном результате выявляет боль при сгибании прямой ноги в тазобедренном суставе.
Симптом Фрайберга определяется в положении лежа и проявляется болью при внутренней ротации бедра.
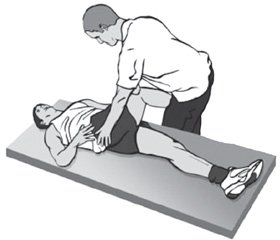
Симптом Пэйса (САВР-тест — сгибание, аддукция, внутренняя ротация) при положительном результате проявляется болью при сгибании, аддукции и внутренней ротации бедра. Методика проведения теста: пациент лежит на боку, здоровая нога снизу, бедро согнуто под углом 60 градусов, колено — от 60 до 90 градусов. Фиксируя таз одной рукой, экзаменатор выполняет аддукцию и внутреннюю ротацию бедра путем надавливания на колено верхней, поврежденной ноги. Схематически симптом Пэйса (САВР-тест) представлен на рис. 2.
Симптом Беатти имеет некоторое сходство с предыдущим симптомом. Пациент лежит на кушетке, здоровая нога снизу, и держит верхнее колено на уровне примерно 10 см от поверхности кушетки. В случае положительного теста пациент будет отмечать боль, указывающую на поражение седалищного нерва.
Ранее считалось, что для определения СГМ достаточно использования лишь клинических тестов, направленных на выявление описанных выше симптомов [19, 20], однако на сегодняшний день показана роль электромиографии (ЭМГ), компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) в диагностике данного патологического состояния.
ЭМГ позволяет выявить миопатические и нейропатические изменения. Одним из индикаторов является H-рефлекс, латентность которого увеличивается в позиции сгибания, аддукции и внутренней ротации бедра по сравнению с нормальным физиологическим положением [26].
КТ и МРТ являются важным диагностическим инструментом для выявления увеличения грушевидной мышцы в размерах.
Лечение
На всех этапах обследования — от сбора жалоб до неврологического осмотра — доктор должен иметь в виду возможность наличия у пациента СГМ. Раннее выявление данной патологии и вовремя начатое консервативное лечение (нестероидные противовоспалительные препараты (НПВП), миорелаксанты, холод и покой) — залог успешности терапии [27]. По данным литературы, положительный исход в таком случае достигается у 79 % пациентов.
НПВП и парацетамол являются препаратами выбора для лечения БНЧС и СГМ [28]. Пациенты, принимающие НПВП, по сравнению с теми, которые принимали плацебо, отмечали значительное снижение боли уже через неделю лечения [29].
Миорелаксанты, наряду с НПВП, являются одной из наиболее часто назначаемых групп препаратов при СГМ. В исследовании Browning было показано, что пациенты, принимающие миорелаксанты, отмечали пятикратное ослабление симптомов уже на 14-й день в отличие от группы плацебо [30].
Несколько исследований было посвящено роли наркотических анальгетиков при хронической мышечно-скелетной боли [31, 32]. Был показан их эффект в контроле сильной, трудно купируемой боли, однако было отмечено, что из-за высокого риска развития побочных явлений, таких как запоры, общая седация и другие, они показаны для краткосрочного применения.
Самым быстрым и эффективным методом купирования боли, воспаления и отека при СГМ являются инъекции глюкокортикоидов (ГК) непосредственно в брюшко мышцы [3]. ГК оказывают противовоспалительное и противоотечное действие непосредственно в тканях, тем самым прерывая порочный круг «боль — спазм — воспаление», а также обладают ремиелинизирующим эффектом при локальных аутоиммунных поражениях периферических нервов. Высокой эффективностью и продолжительностью действия характеризуется препарат Депос — пролонгированный инъекционный двухкомпонентный ГК. Депос состоит из двух солей бетаметазона. Входящая в его состав быстрорастворимая соль бетаметазона натрия фосфат (2,63 мг) быстро абсорбируется из места введения, что обеспечивает скорое начало терапевтического действия (через 20–40 мин после введения), а микрокристаллическая депо-фракция бетаметазона дипропионат (6,43 мг) медленно абсорбируется из депо, которое образуется в месте инъекции, и обусловливает длительное действие препарата (до 4 недель) и противовоспалительный эффект.
Депос оказывает выраженное противовоспалительное и противоаллергическое действие за счет торможения высвобождения интерлейкинов-1 и -2, гамма-интерферона из лимфоцитов и макрофагов, медиаторов воспаления; индуцирования образования липокортинов; снижения метаболизма арахидоновой кислоты.
Основные свойства Депоса [33–35]:
— по противовоспалительной активности Депос в 25–40 раз превышает гидрокортизон, а метилпреднизолон — в 5–8 раз;
— продолжительность действия Депоса до 4 недель;
— высокая эффективность при малой дозе;
— способность дольше находиться в кровяном русле в не связанном с белками плазмы состоянии;
— отсутствие минералокортикоидного эффекта (отсутствует задержка натрия, жидкости, обострение артериальной гипертензии, сердечной недостаточности);
— по профилю безопасности молекула бетаметазона считается наиболее легко переносимой среди всех ГК.
Существует несколько вариантов введения, по данным исследования, не отличающихся по эффективности [1]. К 20 мл 0,5% раствора новокаина добавляют 1 мл препарата Депос. В положении пациента лежа на животе определяют три ориентира: верхняя задняя ость подвздошной кости, седалищный бугор и большой вертел; соединяют эти точки и проводят биссектрису угла; иглу медленно вводят между нижней и средней частью биссектрисы на глубину 40–60 мм до упора в крестцово-остистую связку.
Альтернативной методикой локальной терапии СГМ является наложение на 20–30 мин компрессов с димексидом, анестетиками и ГК на область компрессии и воспаления нерва. Димексид обеспечивает транспорт анестетика и ГК через кожные покровы, кроме того, сам оказывает противовоспалительное действие.
Важным немедикаментозным методом воздействия является мануальная терапия, включающая мягко-тканные техники, миофасциальный релиз и техники, направленные на мышечное растяжение [4, 9].
Заключение
Несмотря на большой прогресс в исследованиях СГМ, многое еще остается неясным. Это прежде всего касается уточнения эпидемиологических данных, факторов риска и оптимальных схем лечения. До настоящего времени остается неясной длительная временная диссоциация между провоцирующим фактором и появлением клинических манифестаций.
СГМ является комплексным состоянием, которое часто упускается из виду при дифференциальной диагностике боли в бедре и БНЧС. Существует ряд клинических тестов, которые можно применять для диагностики СГМ. Важную роль в этом процессе играют данные ЭМГ, КТ и МРТ.
Подход к лечению пациентов с СГМ должен быть комплексным и включать системную фармакотерапию, локальную терапию ГК и методы мануальной терапии.
Список литературы
1. Нефедов А.Ю. Анализ эффективности локальной инъекционной терапии спондилогенного рефлекторного синдрома грушевидной мышцы / А.Ю. Нефедов, С.П. Канаев, К.О. Кузьминов, А.Е. Козлов // Мануальная терапия. — 2009. — № 4 (36). — С. 10-15.
2. Баринов А.Н. Тоннельные невропатии: обоснование патогенетической терапии / А.Н. Баринов // Врач. — 2012. — № 4. — С. 31-7.
3. Pace J.B., Nagle D. Piriformis syndrome // West J. Med. — 1976. — 124. — 435-439.
4. Papadopoulos E.C., Khan S.N. Piriformis syndrome and low back pain: a new classification and review of the literature // Orthop. Clin. North Am. — 2004. — 35. — 65-71.
5. Яхно Н.Н. Невропатическая боль: особенности клиники, диагностики и лечения / Н.Н. Яхно, А.Н. Баринов // Врач. — 2007. — № 3. — С. 16-22.
6. Chaitow L. Soft Tissue Manipulation: A Practitioner’s Guide to the Diagnosis and Treatment of Soft-Tissue Dysfunction and Reflex Activity. — 3rd ed. — Rochester: Healing Arts Press, 1988.
7. Beaton L.E., Anson B.J. The sciatic nerve and the piriformis muscle: their interrelation a possible cause of coccygodynia // J. Bone Joint Surg. Am. — 1938. — 20. — 686-688.
8. Benson E.R., Schutzer S.F. Posttraumatic piriformis syndrome: diagnosis and results of operative treatment // J. Bone Joint Surg. Am. — 1999. — 81. — 941-949.
9. Te Poorten B.A. The piriformis muscle // J. Am. Osteopath. Assoc. — 1969. — 69. — 150-160.
10. Brown J.A., Braun M.A., Namey T.C. Pyriformis syndrome in a 10-year-old boy as a complication of operation with the patient in a sitting position // Neurosurgery. — 1988. — 23. — 117-119.
11. Foster M.R. Piriformis syndrome // Orthopedics. — 2002. — 25. — 821-825.
12. Beatty R.A. The piriformis muscle syndrome: a simple diagnostic maneuver // Neurosurgery. — 1994. — 34. — 512-514.
13. Williams P.L., Warwick R. Gray’s Anatomy. — 36th ed. — Philadelphia: WB Saunders Co, 1980.
14. Hollinshead H.W. Buttock, hip joint and thigh // Anatomy for Surgeons: The Back and Limbs. — Vol. 3. — 2nd ed. — New York: Hoeber Medical Division, Harper and Row, 1969. — 663-666.
15. Beason L.E., Anson B.J. The relation of the sciatic nerve and its subdivisions to the piriformis muscle // Anat. Record. — 1937. — 70. — 1-5.
16. Pecina M. Contribution to the etiological explanation of the piriformis syndrome // Acta Anat. (Basel). — 1979. — 105. — 181-187.
17. Benzon H.T., Katz J.A., Benzon H.A., Iqbal M.S. Piriformis syndrome: anatomic considerations, a new injection technique, and a review of the literature // Anesthesiology. — 2003. — 98. — 1442-1448.
18. Зимакова Т.В. Бедренные невропатии / Т.В. Зимакова, Ф.А. Хабиров, Т.И. Хайбуллин [и др.] // Практическая медицина. — 2012. — № 2. — С. 51-6.
19. Solheim L.F., Siewers P., Paus B. The pyriformis muscle syndrome: Sciatic nerve entrapment treated with section of the piriformis muscle // Acta Orthop. Scand. — 1981. — 52. — 73-5.
20. Cameron H.U., Noftal F. The piriformis syndrome (editorial) // Can. J. Surg. — 1988. — 31. — 210.
21. Retzlaff E.W., Berry A.H., Haight A.S., Parente P.A., Lichty H.A., Turner D.M. et al. The piriformis muscle syndrome // J. Am. Osteopath. Assoc. — 1974. — 73. — 799-807.
22. Steiner C., Staubs C., Ganon M., Buhlinger C. Piriformis syndrome: pathogenesis, diagnosis, and treatment // J. Am. Osteopath. Assoc. — 1987. — 87. — 318-323.
23. Hughes S.S., Goldstein M.N., Hicks D.G., Pellegrini V.D. Extrapelvic compression of the sciatic nerve. An unusual cause of pain about the hip: report of five cases // J. Bone Joint Surg. Am. — 1992. — 74. — 1553-1559.
24. Lynn B. Cutaneous hyperalgesia // Br. Med. Bull. — 1977. — 33. — 103-8.
25. Jankiewicz J.T., Hennrikus W.L., Houkom J.A. The appearance of the piriformis muscle in computed tomography and magnetic resonance imaging: A case report and review of the literature // Clin. Orthop. — 1991. — 262. — 205-9.
26. Fishman L.M., Zybert P.A. Electrophysiologic evidence of piriformis syndrome // Arch. Phys. Med. Rehabil. — 1992. — 73. — 359-64.
27. Fishman L.M., Dombi G.W., Michaelsen C., Ringel S., Rozbruch J., Rosner B. et al. Piriformis syndrome: diagnosis, treatment, and outcome — a 10-year study [review] // Arch. Phys. Med. Rehabil. — 2002. — 83. — 295-301.
28. Harwood M.I., Smith B.J. Low back pain: a primary care approach // Clin. Fam. Pract. — 2005. — 7. — 56-59.
29. Van Tulder M.W., Scholten R.J., Koes B.W., Deyo R.A. Nonsteroidal anti-inflammatory drugs for low back pain: a systematic review within the framework of the Cochrane Collaboration Back Review Group // Spine. — 2000. — 25. — 2501-2513.
30. Browning R., Jackson J.L., O’Malley P.G. Cyclobenzaprine and back pain: a meta-analysis // Arch. Intern. Med. — 2001. — 161. — 1613-1620.
31. Schnitzer R.J., Gray W.L., Paster R.Z., Kamin M. Efficacy of tramadol in treatment of chronic low back pain // J. Rheumatol. — 2000. — 27. — 772-778.
32. Biasi G., Manca S., Manganelli S., Marcolongo R. Tramadol in the fibromyalgia syndrome: a controlled clinical trial versus placebo // Int. J. Clin. Pharmacol. Res. — 1998. — 18. — 13-19.
33. Машковский М.Д. Фармакологический справочник «Лекарственные средства».
34. Городецкий В.В., Тополянский А.В., Лаптев А.О. Глюкокортикоидная терапия сегодня: эффективность и безопасность // Лечащий врач. — 2002. — № 3.
35. Инструкция по медицинскому применению препарата Депоc (Регистрационное удостоверение № UA/13142/01/01).

/91-1.jpg)
/93-1.jpg)