Международный неврологический журнал 5 (75) 2015
Вернуться к номеру
М’язовий больовий синдром у пацієнтів, які перенесли інсульт
Авторы: Орос М.М., Луц В.В. - Ужгородський національний університет; Мукачівська центральна районна лікарня
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
У статі розглядається проблема лікування м’язового больового синдрому (МБС) у пацієнтів, які перенесли інсульт. Наведено дослідження з вивчення частоти виникнення МБС у пацієнтів, які перенесли інсульт, та розробки тактики лікування даного ускладнення. Продемонстрована ефективність лорноксикаму в зменшенні МБС та зроблено висновок про необхідність урахування особливості формування та локалізації МБС при розробці програм реабілітації хворих із постінсультними геміпарезами та геміплегіями.
В статье рассматривается проблема лечения мышечного болевого синдрома (МБС) у пациентов, перенесших инсульт. Представлено исследование по изучению частоты возникновения МБС у пациентов, перенесших инсульт, и разработке тактики лечения данного осложнения. Продемонстрирована эффективность лорноксикама в уменьшении МБС, сделано заключение о необходимости учета особенности формирования и локализации МБС при разработке программ реабилитации больных с постинсультными гемипарезами и гемиплегиями.
The article deals with the problem of treatment for muscle pain syndrome (MPS) in patients who have had a stroke. A study on the incidence of MPS in patients with stroke and on the development of treatment strategy for this complication is presented. Lornoxicam effectiveness has been demonstrated in reducing the MPS, and there has been made a conclusion of the need to consider the features of the formation and localization of MPS when developing rehabilitation programs for patients with poststroke hemiparesis and hemiplegia.
інсульт, біль, міофасціальний синдром, лорноксикам.
инсульт, боль, миофасциальный синдром, лорноксикам.
stroke, pain, myofascial syndrome, lornoxicam.
Статья опубликована на с. 65-68
Актуальність
Інсульт є другою, а в деяких країнах — третьою причиною смертності населення. Щорічно близько 16 млн людей уперше переносять інсульт, а близько 7 млн помирають через це. У середньому частота інсульту становить 150–200 випадків на 100 тис. населення [1–3]. У найближчі десятиліття експерти Всесвітньої організації охорони здоров’я припускають подальше збільшення кількості мозкових інсультів. Згідно з прогнозами, до 2030 р. захворюваність на інсульт зросте на 25 %, що обумовлено старінням населення планети та зростанням поширеності в популяції факторів ризику мозкових інсультів [3, 5].
Інсульт чинить руйнівний вплив на життя пацієнтів і тих, хто забезпечує догляд за ними, і є величезним фінансовим тягарем для системи охорони здоров’я. Економічні витрати, пов’язані з втратою працездатності після інсульту і необхідністю постійного догляду за такими пацієнтами, величезні. У розвинених країнах на нього припадає близько 4 % усіх витрат охорони здоров’я [3]. Саме тому розробка ефективних схем лікування та реабілітації осіб із цереброваскулярною патологією — важлива медико-соціальна проблема, актуальність якої зростає рік у рік. Найбільш часто інвалідизація обумовлена наявністю рухового і когнітивного дефіциту, що розвивається при церебральній ішемії. Реабілітація допомагає постінсультним хворим відновити втрачені навички, коли частина мозку піддається ушкодженню. Однак, крім грубих неврологічних дефіцитів, постінсультний біль значно погіршує якість життя хворих, посилює депресивні прояви і ускладнює проведення реабілітаційних заходів, значно уповільнюючи при цьому соціальну адаптацію.
Біль після інсульту можна класифікувати по-різному. За сучасними уявленнями, його умовно поділяють на такі види больових синдромів:
— центральний постінсультний біль;
— мязово-скелетний біль (постпаретичний і міофасціальний синдроми);
— біль, пов’язаний з ураженням суглобів паретичних кінцівок, — «синдром больового плеча»;
— больовий синдром, пов’язаний із болючим спазмом м’язів паретичних кінцівок;
— головний біль.
Кожен больовий синдром зустрічається з різною частотою, також в одного пацієнта може бути одразу декілька типів больових синдромів (рис. 1).
/66.jpg)
Паретичний біль виникає в паретичних кінцівках вже на 2-му тижні від початку інсульту при русі кінцівок. Має ріжучий, гострий, часто пекучий характер. Цей вид болю — добра ознака початку відновлення кінцівок. Якийсь період (через інсульт) до м’язів не надходять імпульси з головного мозку. Але коли починається процес відновлення, м’язи отримують імпульси і відповідають болем. При їх стисканні утворюється підвищений м’язовий тонус. Це перше скорочення м’язів після «сплячки», що виникла через інсульт. Біль з’являється тоді, коли починається активна реабілітація кінцівок. Люди часто ставлять біль на перше місце і найчастіше припиняють реабілітаційні заходи. Але цього в жодному разі робити не можна! Якщо припинити реабілітаційні заходи, можуть виникнути стійкі контрактури.
Разом із тим при центральних парезах і паралічах роль вторинних м’язових феноменів [5, 9, 27], що формуються у м’язах паретичних кінцівок і утруднюють відновлення рухових функцій, вивчена недостатньо. Через це представляє інтерес дослідження особливостей формування міофасціальних больових синдромів у хворих із церебральними геміплегіями. Болі, контрактури та трофічні зміни паретичних кінцівок, що приєднуються в пізньому періоді хвороби, при постінсультній геміплегії обтяжують перебіг основного захворювання, обмежують рухи, перешкоджають проведенню відновлювальних заходів [1, 10].
Ряд учених розглядають м’язові болі з позицій концепції міофасціального больового синдрому (МБС), для якого в класичному варіанті характерна наявність тригерних точок (ТТ) [4, 8, 22, 27]. Міофасціальні ТТ — утворення, розташовані зазвичай у межах «тугого тяжа» зацікавленого м’яза і мають підвищену чутливість при тиску на них [4, 5, 8, 27]. Стимуляція ТТ призводить до локального здригування і викликає біль у віддаленому від тиску, але суворо визначеному місці [5, 27]. Проте спроби ідентифікувати характерні гістологічні [4, 8, 9, 21], біохімічні [27] або радіологічні [4, 8] зміни в ділянці ТТ певного результату не дали. За допомогою електронної мікроскопії було виявлено незначний некроз міофібрил [24], мітохондріальні зміни мієлінових тілець [17], звивистість базальної мембрани [14], включення ліпофусцину [21], атрофія волокон типу I і «поїдених міллю» волокон типу II [25]. Усі ці ознаки є неспецифічними, проте знаходяться у відповідності з фактором локальної гіпоксії [21, 27], що є центральним пунктом однієї з моделей патогенезу.
Метою нашого дослідження було встановити частоту виникнення МБС у пацієнтів, які перенесли інсульт, та розробити тактику лікування цього ускладнення.
Методи та матеріали
Було досліджено 100 хворих віком від 29 років до 71 року з церебральним гемісиндромом, які перенесли інсульт, серед них 62 чоловіки та 38 жінок. За давністю захворювання хворі розподілялися так: гострий період захворювання (до 3 міс.) був у 37 хворих, ранній відновний (від 4 до 6 міс.) — у 23, пізній відновний (від 7 до 12 міс.) — у 23, наслідки захворювання (більше ніж рік) — у 17. Як контроль нами була обрана «здорова» сторона.
При обстеженні хворих детально оцінювали обсяг активних і пасивних рухів у суглобах кінцівок (у градусах), м’язовий тонус (у ступенях) і м’язову силу (у ступенях), трофічні порушення у паретичних кінцівках, чутливі порушення.
Визначення рухових порушень дало такі результати: у верхній кінцівці парез легкого ступеня визначався у 4 % хворих, помірного — 30 %, вираженого — 25 %, плегія — у 34 %, у нижній кінцівці — відповідно за ступенями: у 15, 39, 28, 10 %. У 8 % хворих у нижній кінцівці парезів не було. Таким чином, у хворих переважав парез верхньої кінцівки (грубий парез + плегія — у 60 %).
М’язовий тонус у паретичних кінцівках був також критерієм розподілу пацієнтів. Хворі розподілялися таким чином: у верхній кінцівці — гіпотонія у 16 % хворих, нормотонія — у 2 %, гіпертонус I ст. — у 40 %, гіпертонус II ст. — у 29 %, гіпертонус III ст. — у 2 %, у нижній кінцівці — відповідно за ступенями: у 29, 3, 50, 8 %.
Детальне обстеження міофасціальних ТТ проводилося за критеріями, запропонованими J. Travell (1983): а) локалізація; б) тривалість активності; в) вираженість активності (по 3-бальній системі) — слабка (1 бал) болючість, про яку судили по словесному звіту; помірна (2 бали), на яку хворий відповідав місцевою орієнтовною та/або мімічною реакцією; різка (3 бали), що супроводжувалася загальною реакцією хворого; г) наявність м’язового тяжа поблизу ТТ; ґ) викликання локальної судомної відповіді і симптому «стрибка»; д) наявність у так званій відображеній зоні глибокої болючості та вегетативних проявів [32].
Реабілітаційний потенціал і незалежність хворих у повсякденному житті оцінювали за запропонованою нами детальної схемою з використанням різних шкал і систем оцінок: візуальна аналогова шкала (ВАШ) болю, індекс Barthel.
При проведенні лікувальних заходів всі пацієнти були розподілені на дві групи по 50 пацієнтів у кожній, причому в кожній було по 31 чоловіку та 19 жінок. У першій групі використовували тільки фізіотерапію (фонофорез, масаж, постізометричну релаксацію), а в другій — фізіотерапію та лорноксикам. У нашій роботі використовували препарат Ксефокам у дозі 8 мг два рази на добу перорально протягом 10 днів. На відміну від інших оксикамів (наприклад, мелоксикаму) для Ксефокаму характерний короткий період напіввиведення — 3–4 години, що забезпечує можливість відновлення протекторного рівня простагландинів шлунково-кишкового тракту (ШКТ) та значно знижує його побічну дію на слизову оболонку шлунка [6, 7]. Це є дуже важливим для пацієнтів з інсультом, які і без того приймають ряд препаратів, що можуть негативно впливати на ШКТ. Ксефокам не тільки пригнічує синтез простагландинів, але й стимулює вироблення власних ендорфінів, забезпечуючи фізіологічне знеболювання шляхом активації антиноцицептивної системи [33]. Крім того, Ксефокам не пригнічує синтез лейкотрієну, що опосередковано гальмує больові імпульси у спинному мозку [34]. За анальгетичним ефектом Ксефокам порівнянний з 20 мг морфіну при лікуванні післяопераційного болю, при цьому має кращий профіль безпеки [35].
Результати та їх обговорення
Виявлено, що МБС у хворих із церебральними геміпарезами виникає, як правило, в перші тижні після інсульту на фоні наростання спастичності в паралізованих кінцівках (у 93 % спостережень). За кількістю ТТ у паретичних кінцівках виявлено такий розподіл хворих: у верхній кінцівці — 1 ТТ у 7 %, 2 ТТ — у 42 %, 3 ТТ — у 30 %, 4 і більше ТТ — у 11 %; у нижній кінцівці — відповідно у 27, 28, 12, 2 %. У 31 хворого активних ТТ у нижній кінцівці не виявилося.
Найбільш часто міофасціальні ТТ локалізувалися в плечовій області: m.deltoideus (у 96 % спостережень), m.biceps brachii (92 %), m.triceps brachii (53 %), m.trapecius (44 %), m. pectoralis major (25 %), m. teres major (у 18 %). У нижній кінцівці ТТ розташовувалися в ділянці передньолатеральної поверхні стегна — m.rectus femoris (у 46 % спостережень), m.vastus lateralis (42 %); в сідничній ділянці — m.gluteus major (у 27 %), m.tensor fasciae latae (12 %).
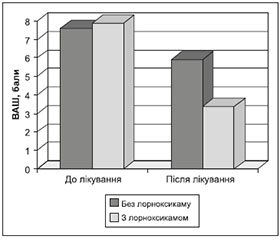
Що стосується лікування, то всі пацієнти були протестовані за ВАШ до і після лікування. Ми оцінювали середній бал групи за ВАШ до і після проведеного лікування, результати наведені на рис. 2.
/67.jpg)
Аналізуючи рис. 2, ми відзначаємо, що на початку лікування середні бали обох груп були майже однакові — 7,6 бала та 7,9 бала, після проведеного лікування середній бал вираженості болю у пацієнтів, які приймали лорноксикам, був майже у два рази меншим, ніж у групі без останнього, — 3,4 бала та 5,9 бала відповідно.
Висновок
У більшості випадків (73 %) у верхній кінцівці виявлялася зона глибокої болючості з вегетативними проявами — так звана відображена зона, що локалізувалася переважно в ділянці передньомедіальної поверхні передпліччя і в ділянці променево-зап’ясткового суглоба, що також підтверджують дані J. Travell, D. Simons (1989). У нижній кінцівці зона відображеної болючості зустрічалася рідше (в 37,4 %) і розташовувалася в ділянці передньомедіальної поверхні гомілки і стопи. У здорових кінцівках, обстежених нами як контроль, активних ТТ виявлено не було, що свідчить про важливу роль центральних порушень регуляції функцій м’язів у розвитку МБС.
Результати роботи свідчать про високу ефективність лорноксикаму у лікуванні МБС, що виник у пацієнтів, які перенесли інсульт.
Отримані нами дані дозволяють судити про особливості формування МБС у хворих із церебральними геміпарезами. Як будь-який больовий синдром, МБС ускладнює перебіг захворювання і утруднює відновну терапію, посилюючи спастику і обмежуючи обсяг активних рухів. Тому необхідно враховувати особливості формування та локалізації МБС при розробці програм реабілітації хворих із постінсультними геміпарезами та геміплегіями.
1. Волошин П.В. Аналіз поширеності та захворюваності на нервові хвороби в Україні / П.В. Волошин, Т.С. Міщенко, Є.В. Лекомцева // Международный неврологический журнал. — 2006. — № 3(7). — С. 9-13.
2. Новое в изучении взаимосвязи нейропсихологических синдромов и психовегетативных расстройств при межполушарной функциональной асимметрии мозга в неотложной неврологии / Г.А. Изюмова, Д.П. Изюмов, P.C. Ярашев // Український неврологічний журнал. — 2011. — № 4(21). — С. 66-70.
3. Мищенко Т.С. Эпидемиология неврологических заболеваний в Украине / Т.С. Мищенко // НейроNEWS. — 2008. — № 3. — С. 76-78.
4. Міщенко Т.С. Епідеміологія цереброваскулярних захворювань в Україні / Т.С. Міщенко // Судинні захворювання головного мозку. — 2006. — № 1. — С. 3-7.
5. Орос М.М. Клініко-діагностичні критерії та прогнозування транзиторно-ішемічних атак: дис… канд. мед. наук: 14.01.15 «Нервові хвороби» / Орос М.М. — Ужгород, 2007. — 177 с.
6. Авксентюк А.В. Лорноксикам (ксефокам) — новый нестероидный противовоспалительный препарат с интенсивным и пролонгированным анальгетическим эффектом // Междунар. неврол. журнал. — 2005. — № 3.— С. 39-44.
7. Новиков Г.А., Вайсман М.А., Рудой С.В., Прохоров Б.М. Возможности нестероидного противовоспалительного анальгетика Ксефокама в терапии хронической боли онкологического генеза // Паллиативная медицина и реабилитация. — 2004. — № 1. — С. 11-14.
8. Пантелеєнко Л.В. Вплив нейропротекторної терапії, застосованої у гострий період ішемічного інсульту, на якість життя хворих через 3 місяці після його виникнення / Л.В. Пантелеєнко, Л.М. Трепет // Український неврологічний журнал. — 2009. — № 4(13). — С. 45-50.
9. Characteristics and outcomes of patients with seizures according to the time of onset in relation to stroke / J. De Reuck [et al.] // Eur. Neurol. — 2008. — Vol. 59. — P. 225-228.
10. Event-related desynchronization of sensorimotor EEG rhythms in hemiparetic patients with acute stroke / Stepien M. [et al.] // Neurosci Lett. — 2010. — Vol. 7. — P. 57.
11. Flossmann E. Prognosis of vertebrobasilar transient ischaemic attack and minor stroke / E. Flossmann, P.M. Rothwell // Brain. — 2003. — Vol. 126(9). — P. 1940-1954.
12. Predicting coma and other low responsive patients outcome using event — related brain potentials: а meta-analysis / J. Daltrozzo [et al.] // Clinical Neurophysiology. — 2007. — Vol. 118. — P. 606-614.
13. Predictive Variables for Mortality After Acute Ischemic Stroke / A. Carter [et al.] // Stroke. — 2007. — Vol. 38. — Р. 1873-1880.
14. Prestroke Cognitive Performance, Incident Stroke and Risk of Dementia: The Rotterdam Study / Reitz Christiane [et al.] // Stroke. — 2008. — Vol. 39. — P. 36-41.
15. Prevalence and risk factors associated with reversed Robin Hood syndrome in acute ischemic stroke / Alexandrov A.V. [et al.] // Stroke. — 2009. — Vol. 40(8). — P. 2738-2742.
16. Su Y.Y. Parameters and grading of evoked potentials: prediction of unfavorable outcome in patients with severe stroke / Y.Y. Su, S.Y. Xiao, W.F. Haupt, Y. Zhang, H. Zhao // J. Clin. Neurophysiol. — 2010. — Vol. 27(1). — P. 25-29.
17. Award Е.А. // Arch. Phys. Med. — 1973. — Vol. 54. — P. 440-453.
18. Bateman J.E. The Shoulder and Neck. — Philadelphia: W.B. Saunders, 1972.
19. Bistevins R., Awad E.A. // Arch. Phys. Med. Rehabil. — 1981. — Vol. 62. — P. 74-83.
20. Bracini M., Duranti R., Galletti R., Pantaleo Т., Zucchi P.L. // Pain. — 1981. — Vol. 10. — P. 57-66.
21. Budinova-Smela I., Frantova A., Slepicka I. // Neural. — 1960. — Vol. 23. — P. 176-181.
22. Fassbender H.G. Pathology of Rheumatic Diseases. — Springer-Verlag, New York, 1975.
23. Hubbard D., Berkoff G. // Spine. — 1993. — Vol. 18. — P. 1803-1807.
24. Ignelzi R.I., Atkinson J.H. // Neurosurgery. — 1980. — Vol. 6. — P. 577-583.
25. Melzack R. // Arch. Phys. Med. Rehabil. — 1981. — Vol. 62. — P. 114-117.
26. Miehlke K., Schluze G., Eger W. // Z. Rheumaforsch. — 1960. — Vol. 19. — P. 310-330.
27. Porta M. Treatment of miofafascial Pain by ihjection with Botulinum Toxin. — Bollington, 1997.
28. Procacci P., Zoppi M. // Pain. — 1981. — Suppl. 1, 6.
29. Schmalbruch H. // Brain. — 1973. — Vol. 96. — P. 637-640.
30. Shore N.A. Occlusal Equilibration and temporamandibular Joint Dysfunction. — Philadelphia: J.B. Lippincott, 1959.
31. Sola A.E., Rodenberger M.L., Gettys B.B. // Am. J. Phys. Med. — 1955. — Vol. 34. — P. 585-590.
32. Тревелл Дж.Г., Симоне Д.Г. Миофасциальные боли / Пер. с англ. — М., 1989.
33. Kullich W., Klein G. // Akt. Rheumatol. 1992. — Vol. 17. — P. 128-132
34. Balfour J. et al. Lornoxicam: A Review // Drugs. — 1996 Apr. — Vol. 51(4). — P. 639-657.
35. Rosenow D.E., Albrechtsen M., Stolke D. A comparison of patient-controlled analgesia with lornoxicam Versus morphine in patients undergoing lumbar disk surgery // Anesth. Analg. — 1998. — Vol. 86(5). — P. 1045-50.
1. Тринус К. Ф. Вестибулярный анализатор и его роль в деятельности человека / К. Ф. Тринус // Врачебное дело. — 1988. — № 6. — С. 108-113.
2. An assessment of antioxidant status in patients with carbon monoxide poisoning / S. Zengin, S. Karta, B. Can [et al.] // World J. Emerg Med. — 2014. — Vol.5, N2. — PP.91-95.
3. Neuropsychological performance in patients with carbon monoxide poisoning / Z.T. Yeh, C.F. Tsai, P.K. Yip [et al.] // Appl. Neuropsychol. Adult. — 2014. — Vol. 21, N4. — PP. 278-287.
4. Xiang W.P. Delayed encephalopathy of acute carbon monoxide intoxication in rats: potential mechanism and intervention of dexamethasone / W.P. Xiang, H. Xue, B.J. Wang // Pak. J. Pharm. Sci. — 2014. — Vol.27, Suppl.6. — PP.2025-2028.