Статья опубликована на с. 19-24
Высокий риск кардиальных нарушений у пациентов с эпилепсией отмечен исследователями давно. Одними из первых обратили внимание на подобную связь W. Penfield и T. Erikson, указав в 1941 году на изменения сердечного ритма во время эпилептического припадка (ЭП). В последние годы данной проблеме был посвящен ряд исследований C.P. Panayiotopoulos et al. (2008, 2010), J.A. French et al. (2004), D. Aulrein (2009), В.А. Карлова (2010); патологии кардиоваскулярной системы было уделено много внимания и на последнем конгрессе AES (2014) [1, 18].
Кардиальная патология при эпилепсии может проявляться как в виде нарушений ритма и проводимости, так и в виде кардиоваскулярных заболеваний [14]. Связь между кардиальной патологией и эпилепсией имеет двусторонний характер: эпилепсия может быть причиной кардиальной патологии (иктальные и интериктальные аритмии, SUDEP, нарушения проводимости), кардиальные заболевания могут иметь прямую связь с развитием эпилепсии и быть проявлением одного патологического процесса (метаболические нарушения, каналопатии). Кроме того, обе эти патологии могут сосуществовать как независимые заболевания, т.е. быть коморбидными (эпилепсия и гипертоническая болезнь, ишемическая болезнь сердца), утяжеляя течение каждой патологии в отдельности и ухудшая прогноз для пациента в целом [13, 14, 25]. Отдельным вопросом является влияние антиэпилептических препаратов (АЭП) на функционирование сердечно-сосудистой системы как у пациентов без кардиальных заболеваний, так и у лиц с отягощенным кардиальным анамнезом, принимающих ряд соответствующих препаратов [13, 21, 23].
По данным литературы, риск развития внезапной смерти у пациентов с эпилепсией в 2,9–3,2 раза выше, чем в популяции. Учеными принят термин SUDEP — внезапная неожиданная смерть у больных эпилепсией. Основными причинами развития SUDEP у пациентов с эпилепсией считают подавляющее действие эпилептической активности на сосудодвигательный и дыхательный центры ствола мозга, а также развитие фатальных аритмий, к которым относятся асистолия, блокада синусового узла, нарушения атриовентрикулярной проводимости, суправентрикулярная тахикардия, желудочковая тахикардия, фибрилляция желудочков как во время припадка, так и в интериктальный период [13, 23]. Можно предположить, что механизм SUDEP ассоциирован с недостаточностью вегетативного обеспечения и нарушением вегетативного реагирования при эпилепсии. Наиболее высокий риск внезапной смерти выявлен при ночной и левополушарной эпилепсии. Сердечно-сосудистая дисрегуляция часто наблюдается при лобной эпилепсии у детей [13].
Во время эпилептического припадка отмечались –суправентрикулярная и желудочковая тахикардия, брадикардия, асистолия и другие аритмии (блокада синусового узла, АV-блокада, желудочковые эктопические ритмы). Эти электрокардиографические (ЭКГ) аномалии были зарегистрированы при различной локализации эпилептогенных очагов: кора островка, лобная доля мозга, поясная извилина, миндалины, гиппокамп. Синусовая тахикардия наблюдается как при парциальных, так и при первично-генерализованных приступах, брадикардия и асистолия — преимущественно при парциальных припадках. Чаще ЭКГ аномалии встречались у пациентов с большей длительностью и частотой возникновения припадков и при наличии генерализованных тонико-клонических припадков [6, 17, 22].
В других исследованиях было показано наличие депрессии сегмента ST во время или сразу после припадка, а также удлинение интервала QT, сопровождающего эпилептическую активность на электроэнцефалографии (ЭЭГ). Эти изменения были связаны с увеличением частоты внезапной смерти [17, 26]. S.J. Tavernor и соавт. посвятили свои исследования изучению изменения сегмента ST и удлинению интервала QT во время приступов эпилепсии. Было установлено, что удлинение интервала QT отмечалось во всех случаях, когда впоследствии развилась внезапная смерть [17].
Полученные результаты свидетельствуют также о том, что в возникновении различий доминирующих нарушений сердечного ритма у больных с генерализованной (ГЭ) и парциальной эпилепсией (ПЭ) значительную роль могут играть имеющиеся у них различия в вегетативной регуляции деятельности сердца. Так, отмечаемая у больных ГЭ склонность к тахикардии и тахиаритмии может рассматриваться как результат преимущественной активации симпатической нервной системы, а характерные для больных ПЭ нарушения проводимости по типу блокад — как проявление повышенной активности парасимпатической нервной системы [3, 7]. В другом исследовании было показано, что иктальная брадикардия и асистолия наиболее характерны для лобной и височной эпилепсии. Авторы также высказывают предположение о роли кардиореспираторного рефлекса в развитии иктальной брадикардии [6, 7].
В последние годы некоторые разновидности тахиаритмий были отнесены к генетическим нарушениям функционирования каналов, которые управляют ионными потоками через мембраны клеток сердца. Такие каналопатии — аномально функционирующие каналы вследствие врожденных мутаций — могут поразить любую электрически активную клетку и не ограничиваются только сердцем. Так, некоторые виды мигрени, эпилепсии, периодического паралича и заболеваний мышечной ткани, по-видимому, обусловлены каналопатией [2, 8]. Аритмии, вызванные каналопатиями, включают: синдром Бругада (один из основных признаков — удлинение интервала QT), синдром ранней реполяризации желудочков, синдром J-волны, волны лямбда.
Патология интервала QT описана в интериктальном периоде, нередко удлинение QT связывают с приемом ряда АЭП (карбамазепин, фенитоин). Патология QT может быть предвестником летальной вентрикулярной тахикардии и SUDEP. Укорочение QT/QTc также является маркером развития кардиальных аритмий. Укорочение интервала QT было описано для примидона, ламотриджина и руфинамида. Редукция вариабельности сердечного ритма и удлинение QT — при приеме карбамазепина, фенитоина. Барбитураты в большей степени, чем «новые» АЭП, вызывают нарушение сердечной проводимости и удлинение QT. Пролонгация интервала PR более чем 0,20 с (AV-блокада I ст.) клинически проявляется брадикардией и синкопальными состояниями. Известен ряд АЭП, вызывающих удлинение PR: карбамазепин, эсликарбазепина ацетат, лакозамид, прегабалин, менее значимо — ламотриджин [19, 24].
Активно изучаются факторы риска развития кардио-васкулярной патологии у пациентов, принимающих различные АЭП. Так, было описано увеличение массы тела у пациентов, принимающих вальпроаты, карбамазепин и вигабатрин. Было выдвинуто несколько теорий, призванных объяснить этот феномен: увеличение количества потребляемой пищи и содержания углеводов в рационе, повышение уровня инсулина в крови или изменение его метаболизма, влияние АЭП на ГАМК-трансмиссию, снижение оксидации β-окисления свободных жирных кислот вследствие дефицита карнитина, снижение связывания пальмитата, глюконеогенез, влияние генетических факторов. Выявлены повышение концентрации инсулина и снижение концентрации связанного с протеинами инсулиноподобного фактора роста в сыворотке крови на фоне приема вальпроатов [20]. Увеличение массы тела может вызывать повышение цифр артериального давления (АД), снижение толерантности к глюкозе, развитие сахарного диабета ІІ типа, повышая кардиоваскулярный риск. В исследовании Dr Sandra Petty и соавт. 52 % обследованных, страдающих эпилепсией, имели 2 и более фактора кардиоваскулярного риска, тогда как в группе контроля этот показатель составил 28 %, что, по мнению авторов, может быть связано с меньшим уровнем активности и употреблением большего количества углеводов пациентами с эпилепсией по сравнению со здоровыми обследованными [10]. В исследовании у 40,4 % пациентов, принимающих вальпроаты, развилось ожирение, а у 40 % обследованных с ожирением в дальнейшем развился метаболический синдром [27].
Еще одним важным фактором кардиоваскулярного риска является распределение жировой ткани, в частности абдоминальное ожирение. В исследовании, проведенном на близнецах и сибсах, было показано увеличение массы тела и количества абдоминальной жировой ткани у пациентов, длительно принимающих вальпроаты (средняя длительность терапии составляла 11 лет), что также ассоциировалось с повышением цифр АД. Авторами отмечена прямая зависимость между длительностью терапии и массой тела, но не с количеством абдоминальной жировой ткани. Данный побочный эффект не регрессировал со временем. При сравнении по половому признаку в исследовании было показано, что женщины более склонны к увеличению массы тела на фоне приема вальпроатов, чем мужчины [9]. В исследовании с участием женщин, принимавших ферментиндуцирующие АЭП (фенитоин или карбамазепин), было показано наличие у пациенток центрального ожирения с недостаточностью эстрогенов.
В другом исследовании сравнивалось действие на массу тела приема вальпроатов, карбамазепина и ламотриджина. Результаты показали нейтральность карбамазепина и ламотриджина к изменению массы тела, тогда как у пациентов, принимавших вальпроаты, достоверно чаще развивалось ожирение [5, 21]. Однако способность вальпроатов вызывать дислипидемию спорна, тогда как доказано, что карбамазепин вызывает повышение общего холестерина сыворотки крови. Ламотриджин не вызывал нарушений липидограммы [9].
Эпидемиологические исследования показали, что уровень смертности вследствие кардиоваскулярных заболеваний, ассоциированных с атеросклерозом сосудов, выше у взрослых пациентов с эпилепсией по сравнению с лицами, не страдающими эпилепсией. Влияние АЭП на развитие атеросклероза является предметом дискуссии. Одни исследователи выявили достоверную связь длительной терапии некоторыми АЭП с модификацией факторов риска атерогенеза, другие исследователи доказывают снижение смертности от ишемической болезни сердца пациентов с контролируемой эпилепсией по сравнению с общей популяцией. Последние данные подтвердили связь «старых» АЭП с развитием нежелательных метаболических эффектов, вовлеченных в механизмы эндотелиальной дисфункции и атерогенеза. Несколько исследований также выявили увеличение толщины комплекса интима-медиа у пациентов с эпилепсией по сравнению со здоровыми обследованными [4, 11, 16]. Более того, было установлено увеличение толщины комплекса интима-медиа у детей, принимавших вальпроаты, тогда как данное изменение не было выявлено у детей, принимавших окскарбазепин. Доказано влияние энзиминдуцирующих АЭП (карбамазепин, фенитоин) на развитие дислипидемии, а именно повышение общего холестерина, липопротеидов низкой и очень низкой плотности и триглицеридов [12, 15].
Таким образом, хотя связь эпилепсии и приема ряда АЭП и развития кардиальных нарушений не вызывает сомнений, имеющиеся литературные данные достаточно противоречивы.
Целью настоящего исследования было изучение влияния течения эпилепсии и терапии АЭП на ряд функциональных и биохимических показателей для выявления и оценки риска развития сердечно-сосудистой патологии у больных эпилепсией.
Материалы и методы исследования
Под нашим наблюдением находились 30 пациентов, страдающих эпилепсией и кардиальной патологией, и группа сравнения — 30 пациентов, страдающих эпилепсией без таких нарушений. Пациенты обеих групп были сопоставимы по полу и возрасту. Из них женщин было 27 (46 %), мужчин — 33 (54 %) пациента. Длительность заболевания составляла в среднем (M ± Std) 8,50 ± 0,57 года. Длительность приема АЭП составляла в среднем 7,00 ± 0,86 года.
Всем обследованным проводились клинико-неврологическое, стандартное ЭКГ-, ЭЭГ-исследования, исследование вариабельности сердечного ритма (ВСР), оценка показателей липидного спектра крови, индекса массы тела, выявление абдоминального ожирения (отношение окружности талии к окружности бедер), ультразвуковая допплерография (УЗДГ) магистральных сосудов шеи, по показаниям МРТ головного мозга. Обследуемые не принимали препаратов, влияющих на показатели липидограммы.
Симптоматическая эпилепсия (СЭ) отмечена у 24 (80 %) пациентов, криптогенная — у 6 (20 %) больных. Причиной развития СЭ являлись: последствия нейроинфекций — у 5 (20,8 %) пациентов, последствия ЧМТ — у 8 (33,4 %), последствия острых нарушений мозгового кровообращения — у 3 (12,5 %), хроническое нарушение мозгового кровообращения (дисциркуляторная энцефалопатия II ст.) — у 2 (8,3 %), гиппокампальный склероз — у 6 (23 %).
Комплексные парциальные припадки (КПП) отмечены у 30 % обследованных с кардиальными нарушениями (КН) и у 43 % пациентов без них, генерализованные тонико-клонические — у 60 % обследованных с КН и у 49 % пациентов без них, сочетание вторично-генерализованных тонико-клонических припадков с парциальными (простыми и комплексными) наблюдалось у 37,5 % пациентов с КН и у 33,7 % — без них.
Среднее количество припадков в месяц составило (M ± Std) у пациентов с кардиальной патологией 14,0 ± 1,7, у пациентов без кардиальной патологии — 5,80 ± 1,02 припадка.
Все пациенты принимали монотерапию АЭП в стабильной среднетерапевтической дозировке: вальпроаты от 10 до 20 мг/кг, карбамазепин от 10 до 20 мг/кг, ламотриджин от 1,25 до 2,5 мг/кг, леветирацетам (левецитам) от 12 до 20 мг/кг.
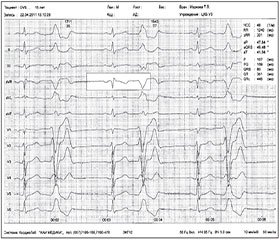
При анализе ЭКГ-изменений у пациентов с нарушениями ритма и проводимости были выявлены: синусовая брадикардия — у 33 % пациентов с симптоматической и криптогенной эпилепсией с ПГП, ВГП и комплексными парциальными припадками, принимавших карбамазепин; синусовая тахикардия — у 7 % обследованных с СЭ с ВГП на фоне приема вальпроатов и у 4 % пациентов, принимающих ламотриджин; суправентрикулярная экстрасистолия — у 10 % пациентов с симптоматической и криптогенной эпилепсией с ВГП, ПГП и КПП на фоне приема карбамазепина и у 5 % обследованных, принимающих ламотриджин; желудочковая экстрасистолия (в том числе частая) — у 11 % обследованных с СЭ с ВГП на фоне приема карбамазепина; блокада (полная или неполная) правой ножки пучка Гиса — у 21 % больных с СЭ с ВГП, парциальными (простыми, комплексными) припадками на фоне приема карбамазепина и у 6 % обследованных, принимающих вальпроаты; синдром ранней реполяризации желудочков — у 1 пациента с СЭ с КПП на фоне приема карбамазепина в дозе 1000 мг/сутки в течение 10 лет (рис. 1). У 1 пациента с криптогенной эпилепсией развилась желудочковая экстрасистолия по типу бигеминии на фоне брадикардии после приема карбамазепина в дозе 1200 мг/сутки в течение 2 лет (рис. 2). У 6 % пациентов, принимавших карбамазепин, развился синдром слабости синусового узла. Мы не наблюдали удлинения интервала QTс более 430 мс, однако было замечено, что длительность QTс достоверно больше у пациентов с аритмиями по сравнению с пациентами без кардиальной патологии (р < 0,01).
/22.jpg)
При изучении ВСР у пациентов с брадикардией и блокадой ножек пучка Гиса было отмечено преобладание мощности спектра ВСР в диапазоне HF и некоторое снижение мощности в диапазоне LF (HF > LF > VLF) у 10 % обследованных, что говорит о доминировании парасимпатической регуляции сердечной деятельности; преобладание мощности спектра ВСР в диапазоне VLF и HF (VLF > HF > LF) выявлено у 15 % больных с брадикардией, желудочковыми экстрасистолами, что свидетельствует о доминировании парасимпатической регуляции с вовлечением центральных эрготропных механизмов в регуляцию сердечной деятельности.
У больных с синусовой тахикардией и экстрасистолией отмечалось преобладание мощности спектра ВСР в диапазоне LF и снижение мощности спектра в диапазоне HF (LF > HF > VLF — в 5 % случаев; LF > VLF > HF — в 12 % случаев), что говорит о доминировании симпатической регуляции сердечной деятельности; преобладание мощности спектра ВСР в диапазоне VLF и LF (VLF > LF > НF) выявлено у 35 % больных с суправентрикулярной и желудочковой экстрасистолией, нарушениями атриовентрикулярной проводимости, что свидетельствует о доминировании симпатических влияний с вовлечением центральных эрготропных механизмов в регуляцию сердечной деятельности.
Снижение общей мощности спектра ВСР было отмечено у 89 % обследованных с КН и у 43 % — без них.
При анализе ЭЭГ отмечено снижение частоты альфа-ритма на 1 Гц и более на стороне поражения у пациентов с СЭ в 55 % случаев. Эпилептиформные феномены обнаружены у 47 % пациентов в виде спайков, острых волн, комплексов спайк-волна, полиспайк-волна, острая волна — медленная волна. У 87 % пациентов с СЭ очаг выявленной эпилептиформной активности соответствовал морфологическим изменениям по данным МРТ головного мозга. При сравнении ЭЭГ пациентов с нарушениями сердечного ритма, проводимости и без таковых было отмечено: снижение медианной частоты спектра ЭЭГ — у 54 %, диффузное преобладание медленноволновой активности, преимущественно в тета-диапазоне, — у 70 % обследованных с кардиальными нарушениями, что может свидетельствовать о вовлечении в патологический процесс медиобазальных структур мозга у пациентов с эпилепсией и нарушениями сердечного ритма и проводимости.
Показатели липидного спектра
При проведении сравнительного анализа было установлено, что пациенты, принимающие карбамазепин, имели достоверно более высокие показатели общего холестерина, триацилглицеридов, ЛПОНП и коэффициента атерогенности, а также более низкие уровни ЛПВП по сравнению с пациентами, принимавшими ламотриджин и леветирацетам (р < 0,01). При сравнении показателей липидограммы пациентов, принимавших карбамазепин и вальпроаты, были выявлены более высокие показатели ЛПОНП и ТГ у пациентов, получавших карбамазепин (р < 0,05). Данные представлены в табл. 1.
/23.jpg)
Пациенты, принимавшие вальпроаты, имели достоверно более высокие уровни ЛПОНП и коэффициента атерогенности по сравнению с пациентами, принимавшими ламотриджин и леветирацетам (р < 0,01). Пациенты, принимавшие леветирацетам (левецитам), имели достоверно более низкие уровни ЛПОНП, ЛПНП, ТГ и коэффициента атерогенности (КА), более высокий уровень ЛПВП по сравнению с пациентами, получавшими карбамазепин и вальпроаты (р < 0,001), более высокий уровень ЛПВП и более низкий уровень КА по сравнению с пациентами, получавшими ламотриджин (р < 0,01).
По данным УЗДГ оценивали толщину комплекса интима-медиа (ТКИМ). Было выявлено, что ТКИМ достоверно больше у пациентов, принимающих вальпроаты, по сравнению с пациентами, принимающими ламотриджин, леветирацетам (р < 0,01) и карбамазепин (р < 0,05).
У пациентов, принимающих вальпроаты, ИМТ в среднем составил 27,30 ± 0,71 кг/м2 и был достоверно выше по сравнению с пациентами, принимающими ламотриджин, леветирацетам (р < 0,01) и карбамазепин (р < 0,05).
Отношение окружности талии к окружности бедер у пациентов, принимавших вальпроаты, в среднем составило 0,97 ± 0,12 и было достоверно выше по сравнению с показателями, полученными у пациентов, принимающих карбамазепин, ламотриджин и леветирацетам (р < 0,01). Полученные данные говорят о преимущественно абдоминальном типе ожирения у пациентов, принимающих вальпроаты, что является фактором риска развития кардиоваскулярных заболеваний.
Таким образом, эпилепсия сопровождается повышением риска кардиоваскулярных заболеваний. Прием ряда АЭП, в свою очередь, может провоцировать развитие нарушений сердечного ритма, проводимости, а также способствовать развитию состояний, повышающих риск кардиоваскулярных заболеваний (гиперлипидемия, абдоминальное ожирение, увеличение толщины комплекса интима-медиа). Так, было выявлено, что у пациентов, принимавших карбамазепин, достоверно чаще наблюдались синусовая брадикардия, атриовентрикулярная блокада и блокада ножек пучка Гиса, желудочковая экстрасистолия, синдром слабости синусового узла. У пациентов, принимающих вальпроаты, достоверно чаще встречались синусовая тахикардия, суправентрикулярная экстрасистолия. Препаратом выбора для пациентов с риском развития кардиоваскулярной патологии и/или наличием кардиальных нарушений является леветирацетам. Леветирацетам не оказывает аритмогенного действия, не влияет на активность печеночных ферментов, не провоцирует развитие ожирения и гиперлипидемии. Основной механизм действия препарата — связывание с протеином SV2A синаптических везикул (этот белок необходим для нормальной нейротрансмиссии) — отличен от механизмов действия традиционных АЭП. Этим объясняется отсутствие межлекарственных взаимодействий, характерных для ряда АЭП, что позволяет применять левецитам параллельно с рядом других препаратов, необходимых для лечения кардиальной патологии.
Выводы
1. Пациенты с эпилепсией, имеющие кардиальную патологию, требуют адекватного ведения и диагностики.
2. Факторами повышенного риска развития КН у пациентов с эпилепсией являются частые и генерализованные тонико-клонические ЭП, снижение общей мощности ВСР, преобладание мощности LF в спектре ВСР в сочетании с высокими показателями VLF.
3. Нарушения сердечного ритма и проводимости, в особенности брадикардия и атриовентрикулярная блокада, являются противопоказанием для назначения карбамазепина; вальпроаты и карбамазепин не должны применяться при дислипидемии, увеличении ТКИМ более 1,17 мм по данным УЗДГ.
4. Леветирацетам является препаратом выбора для лечения пациентов с эпилепсией и кардиальными нарушениями, так как не оказывает влияния на деятельность сердечно-сосудистой системы, не взаимодействует с другими препаратами, не влияет на ферментативную систему печени, не требует титрования дозы и, следовательно, дает возможность быстрее сократить частоту эпиприпадков, а значит, и риск фатальных аритмий.
Список литературы
1. Карлов В.А. Эпилепсия у детей и взрослых, женщин и мужчин: Руководство для врачей. — М.: ОАО «Изд. «Медицина», 2010. — 720 с.
2. Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти // Клиническая практика. — 2012. — 4. — 6-75.
3. Altenmuller D.M., Zehender M., Schulze-Bonhage A. High-grade atrioventricular block triggered by spontaneous and stimulation-induced epileptic activity in the left temporal lobe // Epilepsia. — 2004. — 45. — 1640-1644.
4. Belcastroa V., D’Egidio C. Metabolic and endocrine effects of valproic acid chronic treatment // Epilepsy Research. — 2013. — Р. 8.
5. Biton V., Levisohn P., Hoyler S. Lamotrigine versus valproate monotherapy-associated weight change in adolescents with epilepsy: results from a post hoc analysis of a randomized, double-blind clinical trial // J. Child Neurol. — 2003. — 18. — 133-139.
6. Britton J.W., Ghearing G.R., Benarroch E.E., Cascino G.D. The ictal bradycardia syndrome: localization and lateralization // Epilepsia. — 2006. — 47. — 737-744.
7. Chu J., Majmudar S. Cardiac asystole associated with seizures of right hemispheric onset // Epilepsy Beh. Volume. — 2014. — 2. — Р. 127-129.
8. Eggleston K.S. Ictal tachycardia: The head-heart connection // Seizure — European Journal of Epilepsy. — Aug. 2014. — Vol. 23. — Is. 7. — P. 496-505.
9. El-Khatiba F.,Markus R. Valproate, weight gain and carbohydrate craving: A gender study. — doi:10.1016/j.seizure.2006.12.009.
10. Elliott J.O., Jacobson M.P., Haneef Z. Cardiovascular risk factors and homocysteine in epilepsy // Epilepsy Res. — 2007. — 76(2–3). — Р. 113-23.
11. El-Farahaty R.M., El-Mitwalli A. Atherosclerotic Effects of Long-Term Old and New Antiepileptic Drugs Monotherapy: A Cross-Sectional Comparative Study // J. Child Neurol. — October 23, 2014. — 0883073814551388.
12. Erdemir A., Cullu N., Yis U. et al. Evaluation of serum lipids and carotid artery intima media thickness in epileptic children treated with valproic acid // Brain. Dev. — 2008. — doi:10.1016/j.braindev.2008.11.001.
13. Hitiris N., Suratman S., Kelly K., Stephen L.J. Sudden unexpected death in epilepsy: a search for risk factors // Epilepsy Behav. — 2007. — 10. — 138-41.
14. Jansen K., Lagae L. Cardiac changes in epilepsy // Seizure: J. Brit. Epilepsy Assoc. — 2010 — 19. — 455-460.
15. Lo Pinto-Khoury C., Mintzer S. Antiepileptic drugs and markers of vascular risk // Current Treatment Options in Neurolo-gy. — 07/2010. — 12(4). — 300-8.
16. Mehrpour M., Shojaie M., Zamani B., Gharibzadeh S., Abbasi M. Atherogenic consequence of antiepileptic drugs: a study of intima-mediathickness // Neurol. Sci. — Feb. 2014. — 35(2). — 253-7.
17. Nei M., Ho R.T., Sperling M.R. EKG abnormalities during partial seizures in refractory epilepsy // Epilepsia. — 2000. — 41. — 542-548.
18. Panayiotopoulos C.P. Antiepileptic Drugs, Pharmacopoeia // Paperback 2010-09-25, English Springer. — 108 p.
19. Patel Ch., Antzelevich Ch. Pharmacological approach to the treatment of long and short QT syndromes // Pharmacology and Therapeutices. — 2008. — 118. — 138-151.
20. Petty S.J., Kantor S. Weight and fat distribution in patients taking valproate: A valproate-discordant gender-matched twin and sibling pair study // Epilepsia. — Oct. 2014. — 55(10). — 1551-7.
21. Privitera M.D., Brodie M.J., Mattson R.H., Chadwick D.W., Neto W., Wang S. et al. Topiramate, carbamazepine and valproate monotherapy: double-blind comparison in newly diagnosed epilepsy // Acta Neurol. Scand. — 2003. — 107. — 165-175.
22. Rugg-Gunn F.J., Simister R.J. Cardiac arrhythmias in focal epilepsy: a prospective long-term study // Lancet. — 2004. — 364. — Р. 2212-2219.
23. Ryvlin P., Cucherat M., Rheims S. Risk of sudden unexpected death in epilepsy in patients given adjunctive antiepileptic treatment for refractory seizures: a meta-analysis of placebo-controlled randomised trials // The Lancet Neurology. — Nov. 2011. — V. 10. — Is. 11. — P. 961-968.
24. Sauer A., Moss A., McNitt S., Peterson D., Zareba W., Robinson J. et al. Long QT syndrome in adults // J. Am. Coll. Cardiol. — 2007. — 49. — 329-337.
25. So E.L. What is known about the mechanisms underlying SUDEP? // Epilepsia. — Dec. 2008. — 49, Supрl. 9. — 93-8.
26. Tigaran S., Vesterby A., Baandruup U. et al. SUDEP: postmortem evidence for malignant arrhythmias // Neurology. — 2002. — 58. — 335.
27. Verrotti A.,Rossella M. The metabolic syndrome in overweight epileptic patients treated with valproic acid // Epilepsia. — Feb. 2010. — Vol. 51. — Is. 2. — Р. 268-273.

/22.jpg)
/23.jpg)