Статья опубликована на с. 42-49
Метою нашої роботи є уточнення рівня порушень психоемоційної сфери та вегетативних порушень у пацієнток із хронічним больовим синдромом нижнього відділу спини на фоні хронічного аднекситу.
Матеріали та методи дослідження
Нами було проведено комплексне клінічне, нейровертебрологічне, нейропсихологічне, рентгенологічне, нейровізуалізаційне обстеження 110 пацієнток із болем нижнього відділу спини (БНС).
Усі хворі були розподілені на три групи: перша — хворі з хронічним аднекситом (34 пацієнтки); друга (основна група) — хворі з поєднанням БНС, остеохондрозу попереково-крижового рівня хребта та хронічного аднекситу (46 пацієнток); третя — хворі з БНС на фоні остеохондрозу попереково-крижового відділу хребта (30 пацієнток).
Обстеження пацієнток проводили за єдиною програмою з використанням формалізованих карт, що включали анамнестичний питальник, питальник скарг, дані неврологічного та нейроортопедичного обстеження, дані консультативного висновку гінеколога з описом бімануального обстеження, дані УЗД органів малого тазу, результати рентгенографії попереково-крижового відділу хребта, результати магнітно-резонансної томографії попереково-крижового відділу хребта. Для об’єктивізації вираженості больового синдрому ми використовували візуальну аналогову шкалу болю (ВАШ), для верифікації невропатичного компоненту болю — шкалу DN4, для скринінгу нейропсихологічних характеристик БНС на фоні хронічного аднекситу (рівня тривожності, депресії та порушення життєдіяльності) ми використовували шкали Спілбергера — Ханіна, PHQ-9 та питальник Освестрі відповідно.
Основну частину становили хворі віком від 26 до 36,8 року (60 %), що, безперечно, має велике соціальне значення з огляду на демографічну ситуацію в Україні та старіння нації.
При цьому ми можемо стверджувати, що майже 30 % відсотків наших пацієнток були віком від до 36,8 до 49 років, тобто це хворі найбільш працездатного віку, що збігається з даними багатьох авторів про віковий аспект захворювання. Тривалість БНС вертеброгенного ґенезу в більшості спостережень становила до 1 року (52 жінки — 68,4 %), що було подібним до анамнезу хронічного аднекситу (19 хворих — 55,8 %), середня тривалість больового синдрому становила 11,2 ± 4,0 місяця.
Біль у спині є найчастішою причиною звернення хворих до невропатолога, терапевта, ревматолога, нейрохірурга та рефлексотерапевта. 10–20 % населення в усьому світі щороку страждають від больових синдромів у спині. У США біль у спині посідає перше місце в структурі ревматичних захворювань серед дорослого населення. В Україні вертеброгенна патологія та захворювання периферичної нервової системи посідають друге місце після цереброваскулярної патології (показники захворюваності становлять 520 випадків на 100 тис. населення). У світі ця патологія лідирує серед захворювань, що зумовлюють тимчасову непрацездатність, а в Європі є другою за частотою причиною звертань до невропатолога. Водночас лише 40 % хворих звертаються за медичною допомогою. У віці 20–64 років болі в спині турбують 32 % жінок. Відомо також, що в третини пацієнтів гострий біль переходить у хронічний. Цей синдром має статус реєстраційної категорії в міжнародній класифікації хвороб (МКХ-10) через високий рівень його поширення, а також через те, що на практиці конкретна анатомічна причина болю в частини пацієнтів не встановлюється.
Актуальність вивчення психоемоційних аспектів больових синдромів набула нового забарвлення у світлі сучасного уявлення про соціальні аспекти здоров’я, мультифакторність формування больових синдромів на фоні соматичних захворювань, шляхи вирішення проблеми соціальної та фізичної дезадаптації особистості на фоні хронічних больових синдромів вертеброгенного ґенезу. Адже тривале хронічне напруження адаптаційних та компенсаторних механізмів на фоні хронічного фізичного дискомфорту у хворих із патологією вертеброгенного ґенезу та захворюваннями гінекологічної сфери призводить до формування тривожних та депресивних станів, що змінюють параметри фізіологічних процесів, до їх виснаження та поглиблення вторинних соматичних синдромів. Тому страх, тривога, депресія, безумовно, впливають на сприйняття болю та виходять на перший план при хронізації процесу, зумовлюючи афективні, когнітивні та поведінкові реакції.
Біль у нижній частині спини визначається як біль, що локалізується між XII парою ребер і сідничними складками. Синдрому властива значна етіологічна та прогностична гетерогенність, а також відсутність загальноприйнятої класифікації. Зазвичай БНС класифікують за анатомічними й тимчасовими ознаками (вертеброгенний і невертеброгенний, гострий, підгострий та хронічний біль), а також розрізняють біль механічний і запальний; первинну та вторинну, специфічну й неспецифічну дорсалгії. Дорсалгії входять у трійку основних причин тимчасової втрати працездатності.
Найбільш часті причини БНС: 1) вертеброгенні: остеохондроз хребта; протрузія диска; сакралізація, люмбалізація; артроз міжхребцевих суглобів; спінальний стеноз; нестабільність хребтово-рухового сегмента, спондилолістез; функціональні порушення (блоки хребців); остеопоротичні переломи тіл хребців; спондилоартрити; 2) екстравертебральні: міофасціальний больовий синдром; відбиті болі при захворюваннях внутрішніх органів; психогенні болі. У загальній структурі болю можна виділити п’ять компонентів: перцептуальний, емоційно-афективний, вегетативний, руховий та когнітивний. Основними патофізіологічними механізмами розвитку БНС і корінцевого болю вважають периферичну й центральну сенситизацію, а також невральну ектопію. Тимчасова гіперчутливість пошкодженої ділянки змушує пацієнта уникати нової травматизації, але тривала сенситизація втрачає адаптивну роль і сприяє хронізації болю.
Варто відзначити патогенетичну поліваріантність розвитку БНС, гетерогенність структур, що спричиняють біль, порушення компенсаторно-пристосувальних реакцій структур периферичного відділу нервової системи зі зниженням їх репаративних резервів. В останні роки спостерігається посилена увага з боку науковців та клініцистів до питань вивчення зв’язку болю в нижній частині спини із захворюваннями органів малого тазу. Найбільш ймовірно, що вертеброгенні чинники є не лише причинами больового синдрому у жінок, а й провокуючими та декомпенсуючими факторами на тлі вже сформованого рубцево-спайкового процесу, обумовленого тривалими хронічними інфекційно-запальними процесами гінекологічної сфери з вазомоторними та нейродистрофічними процесами. Хронічні соматичні захворювання істотно змінюють соціальну поведінку людини, призводять до психоемоційної лабільності, апатії, обмеження кола інтересів, порушення вольової активності, збіднення загального психічного складу.
Характеризуючи біль у спині, пацієнти описують інтенсивність, умови й гостроту виникнення, зміну відчуттів, а з часом — іррадіацію, порушення функції й розвиток поведінкових змін. Отже, поняття про соматичні зміни та больові відчуття включає комплекс соціальних факторів, психоемоційних змін, власного досвіду, що необхідно враховувати при обстеженні пацієнтів та визначенні лікувальної тактики. Без комплексного підходу до обстеження та ведення пацієнток із проявами болю в спині на фоні хронічних запальних захворювань органів малого тазу неможливо визначити правильну лікувальну тактику, оцінити характер больового синдрому, а відповідно проводити його контроль та корекцію, ефективно проводити фізіологічну та психосоціальну адаптацію.
Результати дослідження та їх обговорення
Аналізуючи скарги пацієнтів, ми виявили, що для хворих обох груп був характерний ниючий, тягнучий, рідше стріляючий біль у спині залежно від стадії патологічного процесу, з іррадіацією в кінцівки; частіше по зовнішній чи задній поверхні стегна, гомілки, зовнішній чи внутрішній поверхні ступні. Біль у більшості пацієнтів мав відносно постійний характер, обмежував об’єм рухів в хребті і при незначних рухах посилювався. Для оцінки больового синдрому ми використовували візуальну аналогову шкалу від 1 до 10 см. В обох групах пацієнти оцінювали больовий синдром: у першій — 5,6 ± 0,2 бала — помірний, у другій — 6,9 ± 0,3 бала — помірний, на межі вираженого.
/44-1.jpg)
За результатами наших досліджень, найбільш частими факторами, на тлі яких виникав чи загострювався больовий синдром у пацієнтів, були професійні навантаження — 28,2 %, загострення соматичного захворювання — 26,3 %, переохолодження — 31,8 %, фізичні перенавантаження, пов’язані з тривалою вимушеною позою, — 12,7 %. Слід зазначити, що в 72,3 % обстежених причиною проявів чи загострення болю у спині була комбінація двох і більше факторів ризику.
Аналізуючи результати клінічних спостережень, можна стверджувати, що клінічні прояви больового синдрому, незалежно від причинних факторів, були подібними. Головний пік захворюваності у двох клінічних групах припадав на середній вік, спільними були провокуючі фактори, що й призводили до загострення.
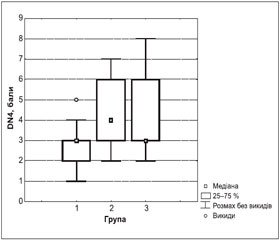
У наших пацієнток невропатичний синдром був виявлений у 34 (31,8 %) випадках. За даними питальника для діагностики невропатичного болю DN4, у пацієнток першої групи невропатичний компонент болю визначався у 6 випадках (4–5 балів — 20 % випадків), у другій групі його частота становила 23 випадки (4–7 балів — 52,1 %), у третій групі — 12 випадків (5–8 балів — 48 %).
Існує статистичний зв’язок між наявністю люмбо-ішіалгії та нейропатичним болем (χ2(1) = 5,81, φ = 0,23). Ризик виникнення нейропатичного болю у 2 рази вищий при наявності люмбоішіалгії (ВР = 2,1, 95 % ДІ: 1,2–4,0, р = 0,016). Нами виявлений статистичний зв’язок між наявністю радикулопатії та нейропатичним болем (χ2(1) = 8,06, φ = 0,28). Ризик виникнення нейропатичного болю у 3 рази вищий при наявності радикулопатії (р = 0,006).
При хронізації рецидивуючих БНС рівень вираженості порушень життєдіяльності, дезадаптації та інвалідизації ми оцінювали за питальником Освестрі. За його даними, у першій групі середнє значення становило 24,6 % (стандартне відхилення — 9,845), у другій групі — 33,5 % (стандартне відхилення — 8,607), у третій групі — 29,1 % (стандартне відхилення — 8,007).
У пацієнток другої групи виявлено кореляційний зв’язок середньої сили між вираженістю больового синдрому за ВАШ та порушеннями життєдіяльності за даними питальника Освестрі (ро Спірмена (ρ) = 0,41, р < 0,01).
У пацієнтів із вертеброгенними больовими синдромами відмічений зв’язок показників шкали DN4 для діагностики невропатичного болю з вираженістю порушення життєдіяльності за даними питальника Освестрі (ρ = 0,39, р < 0,05). Це, з одного боку, може відбивати процес соматизації в пацієнтів, які страждають від хронічного болю в спині, у рамках більш поширених хронічних больових синдромів, а з іншої — схильність пацієнтів до формування хронічного болю при недостатній активності антиноцицептивної системи або появу невропатичних характеристик як відображення центральної сенситизации, при якій є тенденція до виникнення поширеніших больових синдромів.
Відновне лікування при хронічних болях у спині суттєво відрізняється від лікування гострого болю. Хронічний перебіг захворювання, без чітких періодів загострення та ремісії, з постійними хронічними болями помірного характеру та слабкої інтенсивності, як правило, пов’язаний із наявністю в пацієнта вираженого емоційного дистресу та неоптимального ставлення до захворювання. У зв’язку з цим існує думка, що реабілітація пацієнтів із хронічним БНС є також психосоціальною проблемою. Тому в таких пацієнтів особливого значення набуває виявлення та оцінка емоційно-вольових порушень, тривожних та депресивних розладів.
Характерною ознакою для диференціальної діагностики між групами були вегетативні розлади, що спостерігались у хворих із супутньою патологією органів малого тазу першої групи — 16 (47,1 %) випадків, у хворих другої групи з попереково-крижовим болем та хронічним аднекситом — 31 (67,4 %) та мали місце у хворих із БНС на фоні остеохондрозу — 8 (29,6 %) випадків. При дослідженні чутливості з урахуванням іритації вегетативних вісцеральних сплетень органів малого тазу спостерігались ділянки гіперпатії, гіперестезії або гіпестезії, що мали плямистий контур та не збігалися із зонами сегментарної іннервації, у 4 (3,7 %) хворих першої групи та 4 (8,7 %) пацієнток другої групи.
Вегетативно-судинна дисфункція визначалася в 55 (51,4 %) випадках.
Вегетативні розлади проявлялись суб’єктивними та об’єктивними порушеннями та були обумовлені, на наш погляд, подразненням оболонкової гілки спинномозкових нервів. Так, у хворих другої та третьої групи виникали сегментарні вегетативно-судинні порушення, що проявлялись вісцеро-судинними та супутніми вісцеро-вісцеральними й вісцеро-сенсорними змінами. Вісцеро-судинні порушення характеризувались періодично виникаючим відчуттям печії або прохолоди, підвищеною мерзлякуватістю стоп, зміною потовиділення, охолодженням кінцівок при доторку, зміною дермографізму, що було виявлено у хворих з остеохондрозом попереково-крижового відділу хребта та супутнім хронічним аднекситом: вазомоторні порушення — 25 (54,3 %) випадків; червоний дермографізм визначався в 15 (44,1 %) осіб у першій групі, у 30 (65,2 %) — у другій групі та в 15 (55,6 %) — у третій групі. Вісцеро-вісцеральний синдром був у 14 (30,4 %) пацієнток другої групи з кардіалгіями. Біль був стискаючим у ділянці верхівки серця, з сенсопатичним забарвленням. Вираженість та тривалість кардіальних порушень підвищувалась при посиленні болю в нижньому відділі спини. Дистальний гіпергідроз визначався в 16 (47,1 %) хворих у першій групі, у 35 (76,1 %) — у другій, у 7 (25,4 %) — у третій групах. Астеноневротичний синдром був характерним для пацієнток першої групи — 11 (32,4 %) випадків, другої — 24 (52,2 %), третьої — 5 (18,5 %). Частота супутньої патології у вигляді вегетосудинної дисфункції становила 16 (47,1 %) у першій, 31 (67,4 %) — у другій та 8 (29,6 %) — у третій групах.
Вимір тривожності як властивості особи особливо важливий, оскільки вона багато в чому обумовлює поведінку суб’єкта. Певний рівень тривожності — природна й обов’язкова особливість активної дієздатної особи. У кожної людини існує свій оптимальний, або бажаний, рівень тривожності. Оцінка людиною свого стану в цьому плані є істотним компонентом самоконтролю й самовиховання.
Довготривалий біль периферичного походження може бути причиною дисфункції центральних механізмів болю, що обумовлює формування емоційно-афективних та депресивних компонентів сприйняття болю. З метою виявлення тривожних та депресивних розладів пацієнтки 3 груп обстежувалися за допомогою шкали особистісної та ситуативної тривожності Спілбергера — Ханіна та питальника PHQ-9. При аналізі рівня реактивної та особистісної тривожності в досліджених за допомогою шкали Спілберга ми враховували, що низьким вважався рівень тривожності до 30 балів, помірним — 31–45 балів, високим — 45 балів і вище. Серед пацієнток першої групи кількість випадків низької реактивної тривожності становила 15 (44,1 %) випадків, помірний рівень реактивної тривожності відзначено у 18 (52,9 %) випадках, високий рівень тривожності — 1 (2,4 %) випадок.
Прогностичними факторами хронізації болю в спині є ознаки, що можна виділити вже на ранній стадії захворювання. Усі прогностичні фактори розвитку хронічного болю можна поділити на біологічні та психосоціальні (уявлення пацієнта про хворобу, його поведінку тощо). Ми досліджували вираженість депресивних змін у всіх групах пацієнток, використовуючи питальник оцінки пацієнтом самопочуття PHQ-9. Рівень депресивних порушень у пацієнток усіх досліджених груп був у діапазоні мінімальних та легких депресивних порушень: до 10 балів — 60 (55,9 %) випадків та 10–14 балів — 25 (22,6 %). У першій групі мінімальні депресивні прояви виявлялися в 21 (61,8 %) особи, легка депресія — у 8 (23,15 %), що вимагало емоційної підтримки лікуючого лікаря, активного спостереження та за відсутності ознак покращення стану на фоні лікування БНС — призначення антидепресанта. У другій групі мінімальні депресивні прояви виявлялися у 20 (43,5 %) випадків, легка депресія — у 21 (45,7 %), у третій групі мінімальні депресивні прояви виявлено в 16 (59,3 %) осіб, легка депресія — у 8 (29,6 %) випадках.
Нами виявлено вдвічі більший відносний ризик виникнення депресії легкого ступеня в другій дослідженій групі (χ2(1) = 4,4, φ = 0,2, р < 0,05, зв’язок слабкої сили) та реактивної тривожності низького ступеня (χ2(1) = 4,7, φ = 0,2, р < 0,05, зв’язок слабкої сили).
Пацієнтки з легкою депресією вірогідно (р < 0,05) частіше мали більш виражений рівень порушення життєдіяльності, ніж пацієнтки з мінімальним рівнем (до 10 балів) депресії. Інтенсивність болю наростає в міру збільшення вираженості депресії, або ж відзначається зворотній взаємозв’язок у вигляді збільшення вираженості депресії в міру наростання інтенсивності больового синдрому. У пацієнток із більше вираженою депресією вірогідно (р < 0,05) відзначається більша кількість больових синдромів невропатичного характеру. У пацієнток із депресією відзначаються більш високі показники за скринінговим питальником DN4 для діагностики невропатичного болю. Непараметричний кореляційний аналіз гамма не виявив зв’язку між вираженістю депресії й нейровізуалізаційними характеристиками (число протрузій, гриж) в усіх досліджених групах хворих. Виявлено лише зв’язок слабкої сили між реактивною тривожністю високого ступеня та деформуючим спондильозом (χ2(1) = = 4,6, φ = 0,2, ВР = 2,0, р < 0,05).
Отже, не відмічено відношення вираженості депресивних розладів і нейроортопедичних порушень. На підставі цього можна припускати, що депресія в пацієнтів з БНС є не просто реакцією на обмеження рухової активності, вона більшою мірою пов’язана з інтенсивністю больового синдрому. Депресія й вираженість порушення життєдіяльності та інвалідизації чинять один на одного вплив, що взаємно посилюється.
Висновки
При формуванні хронічного БНС у пацієнток із хронічним аднекситом порушення психоемоційної сфери та ступінь дезадаптації більш виражені та потребують особливої діагностичної тактики й підходу до лікування. Вони впливають на вираженість і емоційне забарвлення больового синдрому. Це підтверджує значення психогенних факторів у патогенетичних механізмах формування хронічного больового синдрому. У пацієнток із БНС на фоні хронічного соматичного захворювання, а саме хронічного аднекситу, больовий синдром має більш виражений характер, вегетативне забарвлення. Врахування психоемоційних аспектів сприйняття болю дозволить оптимізувати діагностичний алгоритм та методику лікування хронічних больових синдромів.
Список литературы
1. Антоненко І.В. Оптимізація комплексного лікування хворих з запальними захворюваннями жіночих статевих органів змішаної етіології: Дис… канд. мед. наук: 14.01.01 / Одеський держ. медичний ун-т. — Одеса, 2006. — 144 с.
2. Актуальна неврологія (обрані лекції) / Під ред. проф. О.В. Ткаченко. — К.: Атіка, 2012. — 96 с.
3. Белова А.Н., Щепетова О.Н. Шкалы, тесты и опросники в медицинской реабилитации. — М.: Антидор, 2002. — 440 с.
4. Боженко Н.Л. Больові синдроми спини: Деякі психоемоційні аспекти і можливості корекції // Міжнародний неврологічний журнал. — 2013. — № 8 (62). — С. 103-107.
5. Боженко Н.Л. Досвід лікування больового синдрому в спині // Новости медицины и фармации. — 2007. — № 17 (224). — С. 10.
6. Боль. Диагностика и лечение боли в спине: современные аспекты // Здоров’я України. — 2008. — № 2 (183). — С. 31.
7. Голик В.А., Мороз Е.М. Лечение пациентов с болью в нижней части спины // Здоров’я України. — 2007. — № 6/1. — С. 43.
8. Грушецька О.В. Комплексне лікування хворих на хронічні неспецифічні запальні захворювання придатків матки з використанням немедикаментозних факторів: Дис... канд. мед. наук: 14.01.01 / Одеський держ. медичний ун-т. — Одеса, 2002. — 136 с.
9. Данилов А. Боль. — М., 2012.
10. Жданова М.П., Голубчиков М.В., Міщенко Т.С. Стан неврологічної служби України в 2006 році та перспективи розвитку. — Харків, 2007. — 24 с.
11. Клименко О.В., Головченко Ю.І., Каліщук-Слободін Т.М. та ін. Структура дегенеративно-дистрофічних захворювань хребта: клініка, діагностика та лікування // Consilium Medicum. Ukraina. — 2008. — № 2 (11). — С. 23-25.
12. Мачерет Є.Л. Патогенез, методи дослідження та лікування больових синдромів: Посібник // Чуприна Г.М., Морозова О.Г. [та ін.] — Харків: Контраст, 2006. — 168 с.
13. Міжнародна статистична класифікація хвороб та споріднених проблем охорони здоров’я. Десятий перегляд. — К.: Здоров’я, 2001. — Т. 3. — 817 с.
14. Морозова О.Г. Острая боль в спине: подходы к терапии // Здоров’я України. — 2007. — № 6/1. — С. 22-23.
15. Хубетова-Бондар І.В. Вегетативні дисфункції при хронічних запальних захворюваннях жіночої статевої сфери (клінічні, діагностичні і терапевтичні аспекти): Дис... канд. наук: 14.01.15. — 2006.
16. Audette J.F., Emenike E., Meleger A.L. Neuropathie low back pain // Gurr. Pain Headache Rep. — 2005. — 9. — 68-77.
17. The Bone and Joint Decade 2000–2010 for prevention and treatment of musculoskeletal disorders. — Lund, Sweden, 2008. — April 17–18.
18. Roelofs P.D.D.M., Deyo R.A., Koes B.W., Scholten R.J.P.M., Van Tulder M.W. Non-steroidal anti-inflammatory drugs for low back pain // Cochraine Database of Systematic Reviews 2008 Issue3. — doi10.1002/1451858.CD000396.pub3.
19. Aliraksinen О., Pontinen Pj. The reliability of a tissue соmрliаnсе meter (TCM) in the evaluation of muscle tension in healthy Subjects // Pain. — 1990. — Vol. 5. — P. 155-142.
20. Andersson G. Low back pain // Spin. — 1981. — Vol. 6 (1). — Р. 60.
21. Apkarian A.V., Stea R.A., Bolanowski S.J. Heat-induced pain diminishes vibrotactile perception: a touch gate // Somatosens Mot. Res. — 1994. — Vol. 11. — P. 259-267.
22. Premenstrual dysphoric disorder and changes in frontal alpha asymmetry. Baehr E., Rosenfeld P., Miller L., Baehr R. // International Journal of Psychophysiology. — 2004. — 52 (2). — 159-67. doi:10.1016/j.ijpsycho.2003.06.002 Source: PubMed.
23. Bennett M. The LANSS Pain Scale: the Leeds assessment’ of neuropathic symptoms and signs // Pain. — 2001. — Vol. 92. — P. 147-157.
24. Bennett M., Attal N., Backonja M. Using screening tools to identify neuropathic pain // Pain — 2007. — Vol. 127. — P. 199-203.
25. Bigos S., Battie M., Spengler D. A longitudinal, prospective study of industrial back injury reporting // Clin. Orthop Relat. Res. — 1992. — P. 21-34.
26. Bingel U., Gliischer J., Weiller С. et al. Somatotopic representation of nociceptive information in the putamen: an event-related fMRI study // Cereb. Cortex. — 2004. — Vol. 14 (12). — P. 1340-5.
27. Bingel U., Lorenz J., Glauche V., Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study // Neuroimage. — 2004. — Vol. 23 (1). — P. 224-32.
28. Boden S., Davis D., Dina T. Abnormal magnetic-resonance scans of lumbar spine in asymptomatic subjects // J. Bone Joint Surg. Am. — 1990. — Vol. 72. — P. 403-408.
29. Bogduk N., McGuirk B. Medical management of acute and chronic low back pain. An evidence-based approach // Pain research and clinical management. — 2002. — Vol. 13. — P. 1-24.
30. Boos N., Semmer N., Elfering A. et al. Natural history of individuals with asymptomatic disk abnormalities in MRI // Spine. — 2000. — Vol. 25. — P. 1482-92.
31. Bouhassira D., Attal N., Alchaar H., Boureau F., Bruxelle J., Cunin G. et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4) // Pain. — 2005. — Vol. 114. — P. 29-36.
32. Boswell M.V., Shar R.V., Everett C.R. et al. Interventional techniques in the management of chronic spinal pain: Evidence-based practice guidelines // Pain Psysician. — 2005. — 8. — P. 1-48.
33. Brisby F.I., Byrod G., Olmarker K. et al. Nitric oxide as a mediator of nucleus pulposus-induced effects on spinal nerve roots // J. Orthop Res. — 2000. — Vol. 18. — P. 815-820.
34. Brisby H., Olmarker К., Larsson К. et al. Proinflammatory cytokines in cerebrospinal fluid and serum in patients with disc herniation and sciatica // Eur. Spine J. — 2002. — Vol. 11. — P. 62-66.
35. Butler J.-E., Taylor J.L., Gandevia S.C. Responses of human motoneurons corticospinal stimulation during maximal voluntary contraction and ischemia // J. Neurosci. — 2003. — Vol. 23. — P. 10224-10230.
36. Cаssidy J.D., Carrol L.J., Cote P. Saskatchewan health and back pain survey. The prevalence of low back pain and related disability in Saaskathewan adults // Spine. — 2008. — 23. — 17. — P. 1860-1866.
37. Chavannes A., Gubbels J., Post D. et al. Acute low back pain: patients perceptions of pain four weeks after initial diagnosis and treatment in general practice // The Journal of the Royal College of General Practitioners. — 1986. — № 36. — P. 271-273.
38. Chiang C.Y., Li Z., Dostrovsky J.O., Sessle B.J. Central sensitization in medullary dorsal horn involves gap junctions and hemichannels // Neuroreport. — 2010. — 21. — 233-7.
39. Chen С., Gavanaugh J.M., Ozaktay С. et al. Effects of phospholipase A2 on lumbar nerve root structure and function // Spine. — 1997. — Vol. 22. — P. 1057-64.
40. Cholewicki J., Silfies S.P., Shah R.A. et al. Delayed trunk muscle reflex responses increase the risk of low back injuries // Spine. — 2005. — Vol. 30. — P. 2614-2620.
41. Cohen M., Quintner J. The horse is dead: let myofascial pain syndrome rest in peace // Pain Med. — 2008. — Vol. 9 (4). — 464-465.
42. Coste J., Delecoeuillerie G., Cohen de Eara A. et al. Clinical course andprognostic factors in acute low back pain: am inception cohort study in primary carepractice // Br. Med. J. — 1994. — № 308. — P. 577-580.
43. Creed F. Somatization and Pain Syndromes // Functional Pain Syndromes: presentation and pathophysiology / Ed. by Mayer E., Bushnell C. — Seatle: IASP PRESS, 2009. — 227-245.
44. Dillane J.B., Fry J., Kalton G. Acute back syndrome — a study from general practice // Br. Med. J. — 1966. — № 2. — P. 82-84.
45. Farina D. Effect of experimental muscle pain on motor unit properties // Fundamentals of musculosceletal pain / Еd. by Graven-Nielsen T., Arendt-Nielsen L., Mense S. — Seattle: IASP Press, 2008. — P. 461-475.
46. Freemont A.J., Peacock Т.Е., Goupille P. et al. Nerve ingrowth into diseased intervertebral disc in chronic back pain // Lancet. — 1997. — Vol. 350. — P. 178-181.
47. Goncalves D.A., Bigal M.E., Jales L.C. et al. Headache and symptoms of temporomandibular disorder: an epidemiological study // Headache. — 2010. — 50. — 231-41.
48. Graif M., Olchovcky D., Franke О. et al. Ultrasonic demonstration of iliopsoas hematoma causing femoral neuropathy // Jsr. J. Med. Sci. — 1982. — Vol. 18. — P. 967-968.
49. Graffari M., Alipour A., Farshad A. et al. Effect of psychosocial-factors on low back pain in industrial workers // Occup. Med. — 2006. — Vol. 56. — P. 455-460.
50. Greene H., Cholewicki J., Galloway M. et al. A history of low back injury is a risk-factor for recurrent back, injuries in varsity athletes // Am. J. Sport Med. — 2001. — Vol. 29. — P. 795-800.
51. Gu J.G., Albuquerque C., Lee C.J., MacDermott A.B. Sy-naptic strengthening through activation of Ca2+-permeable AMPA receptors // Nature. — 1996. — 381. — 793-796.
52. Hadler N. Arthritis and Allied conditions. — 13th Edition. — Baltimore, 1997. — Vol. 2. — P. 1821-1833.
53. Hides J.A., Jill G.A., Richardson C.A. Long term effects of specific stabilizing exercises for first episode low back pain // Spine. — 2001. — Vol. 26. — P. 243-248.
54. Higashino K., Matsui Y., Yagi S. et al. The alpha 2 type IX collagen tryptophan polymorphism is associated with the severity of disc degeneration in younger patients with herniated nucleus pulposus of the lumbar spine // Int. Orthop. — 2007. — Vol. 31 (1). — 107-111.
55. Jensen M.C., Brant-Zawadzki M.N., Obuchowski N. et al. Magnetic resonance imaging of the lumbar spine in people without back pain // New England Journal of Medicine. — 1994. — Vol. 331. — P. 69-73.
56. Kaaria S., Solovieva S., Leino-Arjas P. Associations of low back pain with neck pain: a study of industrial employees with 5-, 10-, and 28-year follow-ups // Eur. J. Pain. — 2009. — Vol. 13 (4). — P. 406-11.
57. Kapural L., Goyle A. Imaging for provocative discography and minimally invasive percutaneous procedures for treatment of discogenic lower back pain // Tech. Reg. Anesth. Pain Manage. — 2007. — Vol. 11 (2). — P. 73-80.
58. Kinkade S. Evaluation and Treatment of Acute Low Back Pain // American Family Physician. — 2007. — Vol. 75. — № 8. — P. 1181-1188.
59. Kopec J., Sayre E. Stressful experiences in childhood and chronic back pain in general population // Clinical Journal of Pain. — 2005. — Vol. 21. — 478-483.
60. Kuritsky L. Comprehensive therapy. — 1997. — Vol. 23 (5). — P. 332.
61. Lin Q., Peng Y., Willis W.D. Glycine and GABAA antagonists reduce the inhibition of primate spinothalamic tract neurons produced by stimulation in periaqueductal gray // Brain. Res. — 1994. — 654. — 286-302.
62. Linton S.J. A review of psychological risk factors in back and neck pain // Spine. — 2000. — Vol. 25. — P. 1148-1156.
63. Linton S.J. Do psychological factors increase the risk for back pain in the general population in both a cross-sectional and prospective analysis? // Eur. J. Pain. — 2005. — Vol. 9 (4). — P. 355-61.
64. Loeser J.D. Chapter 2. Pain as a disease // Handbook of Clinical Neurology. — 2006. — Vol. 81. — Р. 11-20.
65. Lu W.Y., Xiong Z.G., Lei S. et al. G-protein-coupled receptors act via protein kinase C and Src to regulate NMDA receptors // Nat. Neurosci. — 1999. — 2. — 331-338.
66. Mannion R.J., Costigan M., Decosterd I. et al. Neurotro-phins: peripherally and centrally acting modulators of tactile stimulus-induced inflammatory pain hyper-sensitivity // Proc. Natl Acad. Sci. USA. — 1999. — 96. — 9385-9390.
67. Mense S. Peripheferal and central mechanisms of musculosceletal pain // Fundamentals of musculosceletal pain / Ed. by Graven-Nielsen Т., Arendt-Nielsen L., Mense S. — Seattle: IASP Press, 2008. — P. 55-62.
68. Mense S., Hoheisel U. Mechanisms of central nervous hyperexcitability due to activation of muscle nociceptors // Fundamentals of musculosceletal pain / Ed. by Graven-Nielsen Т., Arendt-Nielsen L., Mense S. — Seattle: IASP Press, 2008. — P. 61-73.
69. Mankin H., Borges L. // Harrison’s principles of internal medicine. — 13th edition. — McGraw-Hill, Inc., 1994. — P. 34-35.
70. McCarron R.F., Wimpee M.W., Hudkins P.G. et al. The inflammatory effects of nucleus pulposus: a possible element in the pathogenesis of low back pain // Spine. — 1987. — Vol. 12. — P. 760.
71. Mense S., Floheisel U. Morphology and functional types of muscle nociceptors // Fundamentals of musculosceletal pain / Еd. by Graven-Nielsen Т., Arendt-Nielsen L., Mense S. — Seattle: IASP Press, 2008. — P. 3-17.
72. Pedersen J., Sjolander P., Wenngren B.I. et al. Increased intramuscular concentration of bradykinin increases the static fusimotor drive to muscle spindles in neck muscles of the cat // Pain. — 1997. — Vol. 70. — P. 83-91.
73. Olmarker K., Larsson K. Tumor necrosis factor a and nucleus-pulposus-induced nerve root injury // Spine. — 1998. — Vol. 23. — P. 2538-2544.
74. Olmarker K., Rydevik B. Selective inhibition of tumor necrosis factor-a prevents nucleus pulposus-inducedlthrombus formation, intraneural oedema, and reduction of nerve conduction velocity // Spine. — 2001. — Vol. 26. — P. 863-869.
75. Onda A., Yabuki S., Kikuchi S. Effects of neutralizing antibodies to tumor necrosis factor-alpha on nucleus pulposus-induced abnormal nociresponses in rat dorsal horn neurons // Spine. — 2003. — Vol. 28. — P. 967-72.
76. Perez C., Galvez R., Insausti J. et al. Assessment of neuropathic symptoms and signs scale for the diagnosis of neuropathic pain // Med. Clin. — 2006. — Vоl. 27. — 485-491.
77. Piperno M., le Graverand H., Reboul P. et al. Phospholipase A2 activity in herniated lumbar discs // Spine. — 1997. — Vol. 22. — P. 2061-2065.
78. Rodriguez M.A., Afari N., Buchwald D.S. Evidence for overlap between urological and nonurological unexplained clinical conditions // J. Urol. — 2009. — 182. — 2123-31.
79. Scholz J., Mannion R.J., Hord D.E. et al. A novel tool for the assessment of pain: validation in low back pain // PLoS Med. — 2009. — 6. — e1000047.
80. Sandkuhler J., Chen J.G., Cheng G., Randic M. Low-frequency stimulation of afferent Adelta fibers induces long-term depression at primary afferent synapses with substansia gelatinosa neurons in the rat // J. Neurosci. — 1997. — 17. — 6483-6491.
81. Schwarzer A.C., Aprill C.N., Bogduk N. The sacroiliac joint in chronic low back pain // Spine. — 1995. — Vol. 20. — P. 31-37.
82. Scholz J., Mannion R.J., Hord D.E. et al. A novel tool for the assessment of pain: validation in low back pain // PLoS Med. — 2009. — 6. — e100004724.
83. Straube S., Derry S., Moore R., McQuay H. Pregabalin in fibromyalgia: meta-analysis of efficacy and safety from company clinical trial reports // Pheumatology. — 2010. — 49. — 706-15.
84. Takahashi H., Suguro Т., Okazima Y. et al. Inflammatory cytokines in the herniated disc of the lumbar spine // Spine. — 1996. — Vol. 21. — P. 218-24.
85. Treede R.D., Jensen T.S., Campbell J.N. et al. Neuropathic pain: redefinition anda grading system for clinical and research purposes // Neurology. — 2008. — Vol. 70 — № 18. — 1630-1635.
86. Urban M.O., Gebhart G.F. Central mechanisms in pain // Med. Clin. North Am. — 1999. — 83. — 585-596.
87. Van den Hoogen H.J., Koes B.W., van Eijk J. The course of low back pain in general practice: a one year follow up study // Ann. Rheum. Dis. — 1998. — № 57. — P. 13-19.
88. Valeriani M., de Tommaso M., Restuccia D. et al. Reduced habituation to experimentalpain in migraine patients: a CO(2) laser evoked potential study // Pain. — 2003. — Vol. 105 (1–2). — P. 57-64.
89. Van Kleef M., Barendse G.A., Kessels F. et al. Randomized trial of radiofrequency lumbar facet denervation for chronic low back pain // Spine. — 1999. — Vol. 24. — P. 1937.
90. VonKorff M., Crane P., Miglioretti D. et al. Chronic spinal pain and physicalmental comorbidity in the United States: results from the national comorbidity survey replication // Pain. — 2005. — Vol. 113. — P. 331-339, 439.
91. Von Korff М., Deyo R.A., Cherkin D. et al. Back pain in primary care: outcomes at one year // Spine. — 1993. — Vol. 18, № 7. — P. 855-862.
92. Wiesinger В., Malker H., Englund E. Back pain in relation to musculoskeletal disorders in the jaw-face: a matched case-control study // Pain Suppl. — 2007. — Vol. 131 (3). — P. 311-319.
93. Woolf C.J. A new strategy for the treatment of inflammatory pain: prevention or elimination of central sensitization // Drugs. — 1994. — 47 (suppl. 5). — 1-9.
94. Woolf C.J., Costigan M. Transcriptional and posttranslational plasticity and the generation of inflammatory pain // Proc. Natl. Acad. Sci. USA. — 1999. — 96. — 7723-7730.
95. Woolf C.J., Salter M.W. Neuronal plasticity: increasing the gain in pain // Science. — 2000. — 288. — 1765-1769.
96. Woolf C.J., Shortland P., Sivilotti L.G. Sensitization of high mechanothreshold superficial dorsal horn and flexor motor neurones following chemosensitive primary afferent activation [comments] // Pain. — 1994. — 58. — 141-155.
97. Yen S.S.C., Jaffe R.B., Barbieri R.L. Reproductive Endocrinology. — Philadelphia — Tokyo: W.B. Saunders Company, 1999. — 823.
98. Yoshizawa H., Crock H. Blood supply of lumbosacral vertebrae, spinal cord, nerve roots and ganglia // Clinical anatomy and management of low back pain / Ed. by Giles L., Singer K. — Butterworth-Heinemann, 1997. — P. 134-155.
99. Zhou Y., Abdi S. Diagnosis and minimally invasive treatment of lumbar discogenic pain-a review of the literature // Clin. J. Pain. — 2006. — Vol. 22 (5). — P. 468-481.
100. Spitzer R., Kroenke, K., Williams, J. Validation and uti-lity of a self-report Version of PRIME-MD: the PHQ Primary Care Study // Journal of the American Medical Association. — 1999. — 282. — 1737-1744.
101. Дзісь Н.П. Незапальні хвороби жіночих статевих органів: погляд на проблему. — http://www.fetalmedic.com/stati-i-publikacii/nezapalni-khvorobi-zhinochikh-statevikh-organiv-poglyad-na-problemu.html
102. http://www.sirweb.org/patients/chronic-pelvic-pain
103. Neslihan Zehra Gultasl, Aydn Kurt, Ali Ipek, Mehmet Gumus, Kemal Rdvan Yazcoglu, Gulcin Dilmen, Ismet Tas. The relation between pelvic varicose veins, chronic pelvic pain and lower extremity venous insufficiency in women // Diagn. Interv. Radiol. — 2006. — 12. — 34-38.
104. Soleymani H., Ismail L., Currie I. GPs should be vigilant for pelvic inflammatory disease // Practitioner. — 2011 Mar. — 255 (1738). — 15-8.
105. Соколов А.А. Варикозна хвороба вен малого тазу. — http://lib4.net/z/1952-vnutrishnya_meditsina

/44-1.jpg)
/44-2.jpg)
/45-1.jpg)