Международный неврологический журнал 2 (72) 2015
Вернуться к номеру
Оптимізація лікування гострого порушення мозкового кровообігу
Авторы: Насонова Т.І. - Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
У статті наведені дані дослідження клінічної ефективності препарату Армадин у хворих із гострим ішемічним інсультом, його впливу на перебіг гострого періоду інсульту, смертність, запобігання розвитку ускладнень у ранній відновний період та лабораторні показники. Доведено, що застосування Армадину в комплексному лікуванні ішемічного інсульту сприяє відновленню втрачених функцій у пацієнтів у гострому періоді, позитивно впливає на самообслуговування та незалежність від сторонньої допомоги, запобігає виникненню ускладнень та повторних порушень мозкового кровообігу в гострому періоді ішемічного інсульту, впливає на реактивну тривогу та сприяє зменшенню її проявів. Встановлено, що Армадин покращує ліпідний спектр крові, тому може застосовуватись у хворих із гіперхолестеринемією та дисліпідемією.
В статье приведены данные исследования клинической эффективности препарата Армадин у больных с острым ишемическим инсультом, его влияния на течение острого
периода инсульта, смертность, предотвращение развития осложнений в ранний восстановительный период и лабораторные показатели. Доказано, что применение Армадина в комплексном лечении ишемического инсульта способствует восстановлению утраченных функций у пациентов в остром периоде, положительно влияет на самообслуживание и независимость от посторонней помощи, предотвращает возникновение осложнений и повторных нарушений мозгового кровообращения в остром периоде ишемического инсульта, влияет на реактивную тревогу и способствует уменьшению ее проявлений. Установлено, что Армадин улучшает липидный спектр крови, поэтому может применяться у больных с гиперхолестеринемией и дислипидемией.
The article presents data from a study of Armadin clinical efficacy in patients with acute ischemic stroke, its influence on the course of acute phase of the stroke, mortality, prevention of complications in the early recovery period and laboratory parameters. It has been proved that application of Armadin in the combined treatment of ischemic stroke helps to restore lost functions in patients in the acute period, has a positive effect on the self-care and independence of outside help, prevents complications and recurrent cerebrovascular disturbances in the acute phase of ischemic stroke, affects the reactive anxiety and reduces its manifestations. It is found that Armadin improves blood lipids, so it can be used in patients with hypercholesterolemia and dyslipidemia.
гострий ішемічний інсульт, комплексне лікування, Армадин.
острый ишемический инсульт, комплексное лечение, Армадин.
acute ischemic stroke, combined treatment, Armadin.
Статья опубликована на с. 41-48
Гострий інсульт залишається однією з провідних проблем сучасної медицини, насамперед у зв’язку з великою інвалідизацією та смертністю серед дорослого населення планети [1].
У структурі гострих порушень мозкового кровообігу (ГПМК) ішемічний інсульт займає перше місце і становить 80–85 % (Зозуля І.С. і співавт., 2012). Незважаючи на численні дослідження з лікування ішемічного інсульту, до сьогодні лише застосування системної тромболітичної терапії та ацетилсаліцилової кислоти мають ґрунтовну доказову базу, що показала свою ефективність. Однак системний троболізис, що суттєво впливає вже на розвинений інсульт і сприяє відновленню втрачених функцій, застосовується не частіше ніж у 20 % випадків навіть у розвинених країнах. Це пов’язано з багатьма факторами: часовий проміжок не більше ніж 4,5 години, наявність спеціалізованого профільного відділення, додаткового обладнання, перелік протипоказань та ін. На жаль, після того як при інфаркті мозку спливає час для проведення тромболітичної терапії, у лікаря залишаються можливості лише для реабілітації та вторинної профілактики в даного пацієнта. У зв’язку з цим на фармацевтичній арені продовжується пошук медичних препаратів, які б сприяли відновленню кровопостачання мозку та збереженню клітин в зоні пенумбри, впливаючи на початкові стадії апоптозу. Великі сподівання у зв’язку з цим науковці покладали на нейропротектори. Однак сьогодні так і не з’явилось достатньо доказів ефективності нейропротективних засобів у клініці, які показали хороші результати в експерименті. За даними A. Majid (2014), причина неузгодженості експериментальних та клінічних даних полягає в подвійності процесів, що виникають під час інсульту. Наприклад, активність клітин мікроглії, діяльність металопротеаз, процеси апоптозу й автофагії можуть мати як захисний, так і пошкоджуючий характер [2, 3]. У зв’язку з цим погляди вчених концентруються на розробці інших препаратів, що впливають на патогенетичні ланки мозкового ішемічного каскаду.
Відкриття єдиних механізмів ушкодження нейрона при різних патологічних станах — ексайтотоксичності і оксидативному стресі — велике досягнення нейробіологічних наук [4, 5]. Особлива небезпека розвитку оксидативного стресу в центральній нервовій системі визначається значною інтенсивністю окислювального метаболізму мозку, що становить 2 % від загальної маси людини, але утилізує до 50 % всього кисню, що споживає організм. Інтенсивність споживання кисню нейронами в десятки разів перевищує потреби інших клітин і тканин (350–450 мкл О2/1 хв порівняно з 70–90 мкл — для серця, 1,6–2,4 мкл — для скелетних м’язів).
Додатковими факторами розвитку оксидативного стресу в тканинах мозку є високий вміст у них ліпідів (близько 50 % сухої речовини), ненасичені зв’язки яких являють собою субстрат для перекисного окислення ліпідів (ПОЛ), аскорбату (у 100 разів більше, ніж у периферичній крові), що бере участь як прооксидант у неферментативних процесах ПОЛ. Активність ферментативних антиоксидантних систем (каталази, глутатіонпероксидази) у мозку значно нижча, ніж в інших тканинах, що ще більше підвищує ризик розвитку оксидативного стресу. Тому при значному підвищенні рівня продуктів ПОЛ ендогенна антиоксидантна система, саморегулююча система, недостатньо впливає на відновлення прооксидантно-антиоксидантної рівноваги, на підтримку балансу між енергозатратними та енергопродукуючими процесами.
Некерована та некомпенсована активація процесів ПОЛ та синтезу NO при виснаженні ендогенної системи антиоксидативного захисту призводить до розвитку оксидативного стресу, що є головним механізмом ушкодження клітин при різних патологічних станах [6]. Якщо оксидативний стрес має таке велике значення в ушкодженні мозкової речовини, логічно призначати курси антиоксидантної терапії хворим із гострим ішемічним інсультом. Ефективність антиоксидантної терапії при гострих цереброваскулярних захворюваннях підтверджена великою кількістю досліджень [1, 2, 6, 8, 10–12]. Дослідження на моделях інсульту показали, що застосування засобів, які зменшують концентрацію вільних радикалів кисню, обмежує ураження ішемізованої тканини мозку (Kent T.A. et аl., 2001). Одночасно деякі клінічні дослідження показали значне підвищення рівня продуктів ПОЛ у хворих із гострим ішемічним інсультом, і при традиційному лікуванні ГПМК висока активність вільнорадикального окислення зберігається.
Серед існуючих антиоксидантів увагу привертають препарати з комплексною дією, зокрема етилметилгідроксипіридину сукцинат (ЕМГПС), ефективність якого пов’язана з його властивостями:
— є інгібітором вільнорадикальних процесів: пригнічує перекисне окислення ліпідів, відновлює активність ферментів антиоксидантного захисту, активізуючи супероксиддисмутазу, глутатіонредуктазу, глутатіон- пероксидазу та каталазу;
— є мембранопротектором, покращуючи стан структури та функції мембрани клітин і синаптичну передачу;
— препарат посилює компенсаторну активацію аеробного гліколізу та знижує рівень пригнічення окислювального процесу в умовах гіпоксії;
— покращує реологічні властивості крові;
— підвищує концентрацію в головному мозку дофаміну;
— має гіполіпідемічну дію та ін.
Серед препаратів етилметилгідроксипіридину сукцинату на фармацевтичному ринку України особливої уваги заслуговує вітчизняний препарат Армадин виробництва фармацевтичної компанії «Мікрохім» у формі капсул по 125 мг та розчину для ін’єкцій (1 мл = 100 мг етилметилгідроксипіридину сукцинату). Таке поєднання дозових форм дозволяє ефективно комбінувати різні дозові режими і схеми та сприяє максимальній індивідуалізації лікування залежно від стану хворого. Армадин випускається в повній відповідності з європейськими критеріями якості й одночасно є доступним із точки зору економічного важеля.
Мета дослідження: вивчити клінічну ефективність препарату Армадин у хворих із гострим ішемічним інсультом, його вплив на перебіг гострого періоду інсульту, смертність, запобігання розвитку ускладнень у ранній відновний період та лабораторні показники.
Матеріали і методи
У відкрите порівняльне контрольоване дослідження на базі неврологічного відділення Київської міської клінічної лікарні № 9 були включені 20 пацієнтів (12 жінок та 8 чоловіків) віком від 44 до 74 років (у середньому 62,0 ± 4,2 року) з гострим ішемічним інсультом, які сформували основну групу та, крім стандартного лікування, отримували Армадин. Контрольну групу становили 10 хворих з ішемічним інсультом віком від 49 до 77 років (середній вік 63,0 ± 3,8 року), які отримували лише стандартне лікування.
Пацієнти обох груп отримували базисну терапію згідно з «Клінічним протоколом надання медичної допомоги хворим на ішемічний інсульт» [13] та «Уніфікованим клінічним протоколом медичної допомоги. Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація)» [14].
Всім хворим у першу добу був діагностований гострий ішемічний інсульт.
Підтип ішемічного інсульту встановлювався згідно з критеріями TOAST [20].
Діагноз встановлювався на підставі даних клініко-неврологічного обстеження, магнітно-резонансної томографії (МРТ), лабораторних методів дослідження. МРТ-дослідження головного мозку виконувалось на апараті Siemens MAGNETOM Avanto 1,5 Tл (напруга магнітного поля 1,5 Тесла) з отриманням зрізів у сагітальній, аксіальній та фронтальній площинах.
Визначали розміри вогнищ, співвідношення білої та сірої речовини (диференціація сірої та білої речовини, вимірювали товщину сірої речовини у лобних та тім’яних частках), гідратацію мозку, яку умовно поділили на 4 ступені: 0 — відсутність зниження гідратації, І — легкий ступінь, ІІ — середній ступінь, ІІІ — виражена дегідратація. Визначали розмір таламуса, гіпокампа, бокових шлуночків мозку, третього шлуночка мозку, товщину сірої речовини в лобній та скроневій частці.
Аналіз тривалості та оборотності неврологічного дефіциту проводили за шкалами NIHSS (National Institutes of Health Stroke Scale, СШA), European Stroke Scale (ESS), Scandinavian Scale (SS), індексом Бартел (ІБ), модифікованою шкалою Ренкіна (МШР), змінами ліпідного спектра крові, шкалами тривоги та якості життя. Окремо реєстрували кількість ускладнень, що розвинулись у гострий період під час перебування пацієнтів у відділенні.
Згідно зі шкалою інсульту Національного інституту здоров’я (NIHSS) визначались параметри, що відображають рівні порушень основних розладів унаслідок гострого цереброваскулярного захворювання в каротидному та вертебробазилярному басейні. Кількість балів — від 0 до 34. При цьому задовільному клінічному стану відповідає мінімальна кількість балів, а тяжкому — максимальна, 34 — кома.
Скандинавська шкала (Scandinavian Stroke Study Group, 1985) включає 10 критеріїв, що відображають переважно порушення рухових функцій верхніх та нижніх кінцівок, ходу, рухи очей, мовлення та рівень свідомості. Мінімальна кількість балів — 0, максимальна — 60.
Європейська шкала інсульту (European Stroke Scale) [22] використовується для визначення неврологічного дефіциту при ГПМК в каротидному басейні і характеризує саме рівень рухових порушень у хворого.
Формування постінсультного функціонального дефекту — ступінь інвалідизації (функціональної залежності) — визначали за допомогою модифікованої шкали Ренкіна [16, 17]. Шкала Ренкіна має 5 ступенів інвалідизації після інсульту. За показниками МШР умовно розрізняли стани: «що не інвалідизують» (значення МШР 2 бали та менше) — незначна функціональна неспроможність, пацієнт може самостійно себе обслуговувати; «що ведуть до інвалідизації» (значення МШР 3 бали та більше) — пацієнт як мінімум потребує деякої сторонньої допомоги в повсякденному житті.
Також оцінювали рівень повсякденної життєдіяльності і залежність у повсякденній життєвій активності за допомогою індексу Бартел [18, 19]. Визначення показників МШР та ІБ проводили на 16-ту добу. За показниками ІБ виділяли такі стани: ІБ в межах 60–80 балів (незначні обмеження в самообслуговуванні, пацієнти не потребують постійної сторонньої допомоги при виконанні побутових маніпуляцій); ІБ менше 85 балів (як мінімум пацієнти потребують деякої постійної сторонньої допомоги при прийомі їжі, персональній гігієні, відвідуванні туалету, одяганні, переміщенні тощо); ІБ менше 60 балів (виражені обмеження в самообслуговуванні, пацієнти потребують постійної істотної сторонньої допомоги при виконанні будь-яких побутових маніпуляцій).
Хворі були госпіталізовані в першу добу після початку інсульту. Критеріями виключення були: тяжка серцево-судинна патологія (ішемічна хвороба серця, інфаркт, серцева недостатність, кардіоміопатія та ін.), цукровий діабет у доінсультному періоді, супутня патологія, яка могла би впливати на розвиток інсультів та перебіг гострого періоду захворювання, а також на процеси постінсультного відновлення (онкологічні захворювання, епілептиформний синдром, хвороби системи крові, судинна деменція, алкоголізм), а також свідчення з медичної документації про раніше перенесені інсульти.
Клінічну оцінку первинних атеротромботичних та кардіоемболічних інсультів проводили під час госпіталізації, на п’яту та шістнадцяту добу призначеної терапії. Лабораторні показники визначали в 1-й та 16-й день лікування, шкали тривоги і якості життя застосовували залежно від стану хворого та його можливості усвідомлювати відповіді на питання в 1-шу — 3-тю добу та 15–16-ту добу лікування.
Під час перебування пацієнтів у стаціонарі фіксувалися неврологічні та соматичні ускладнення. Раннє неврологічне погіршення (прогресування інсульту) — погіршення неврологічного статусу пацієнтів на 2 та більше бали за шкалою NIHSS або смерть пацієнта протягом перших 5 діб від початку інсульту [15]. У випадках появи нової вогнищевої неврологічної патології, що не могла бути пояснена вже наявним ураженням головного мозку, діагностували повторний ішемічний інсульт.
Серед соматичних ускладнень раннього постінсультного періоду реєстрували: пневмонії з гіпертермією, клінічними та рентгенологічними ознаками, інфекції сечовивідних шляхів, підтверджені змінами лабораторних показників, запори, пірексію — підвищення температури тіла понад 37,5 °C, що триває довше ніж 24 години і причину якого неможливо встановити [21], та тромбоз глибоких вен.
Всім хворим проводили ультразвукову допплерографію магістральних судин голови в екстракраніальному відділі та транскраніальну допплерографію, ЕКГ-моніторинг та контроль артеріального тиску. Дуплексне сканування брахіоцефальних судин із кольоровим картуванням потоку проводили в положенні пацієнта лежачи за допомогою апарата Imagic Agile (Kontron, Франція) з використанням лінійного датчика LA523K з частотою 7,5 МГц. Дуплексне сканування церебральних судин — датчиком із фазованою решіткою 1-5РА.
Визначали середню лінійну швидкість кровотоку, пульсаційний індекс та індекс резистивності в ділянці сифона внутрішньої сонної артерії, в інтракраніальних сегментах передніх, середніх і задніх вертебральних артерій і базилярної артерії, а також у базальних венах Розенталя та прямому синусі. Для дослідження кровотоку в указаних судинах застосовували три основних доступи — транстемпоральний (для локації середньої, передньої та задньої мозкових артерій і вен Розенталя), трансорбітальний (для вивчення сифона внутрішньої сонної артерії і кавернозного синуса) і трансокципітальний (для локації вертебральної, базилярної артерій і прямого синуса).
Оцінювали наявність атеросклеротичних бляшок у загальних сонних артеріях, внутрішніх сонних артеріях, хребцевих артеріях, а також відсоток стенозування просвіту цих артерій.
Пацієнти основної та контрольної групи отримували стандартне лікування, передбачене «Клінічним протоколом надання медичної допомоги хворим на ішемічний інсульт» та «Уніфікованим клінічним протоколом медичної допомоги. Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація)», що включало, крім загальних заходів, магнію сульфат, антиагреганти, антикоагулянти, гіпотензивні та серцеві глікозиди за показаннями. Крім того, пацієнти основної групи отримували Армадин у перші 5 днів по 200 мг двічі на добу внутрішньовенно краплинно на 100 мл фізіологічного розчину зі швидкістю 60 крапель на хвилину, з шостої доби 200 мг двічі на добу внутрішньом’язово, починаючи з 9-ї доби пацієнтів переводили на пероральний прийом Армадину по 2 таблетки (125 мг) двічі на добу протягом 8 днів.
Хворі контрольної групи отримували лише лікування згідно з протоколами.
Обидві групи були порівнянні за віком, ступенем неврологічного дефіциту, рівнем свідомості, локалізацією ішемічного вогнища.
Статистична обробка результатів дослідження проводилась за допомогою сучасних методів математичного аналізу з використанням пакета статистичних програм Statistica 6 та Excel 2003. Розраховувались середні показники та помилки середніх. Як критерій вірогідності відхилення показників використовували параметричний критерій Стьюдента і непараметричний критерій U (Вілкоксона — Манна — Уїтні).
Результати та їх обговорення
Клінічні особливості розвитку та перебігу кожного підтипу первинного ішемічного інсульту проводили за єдиним алгоритмом: аналіз показників клінічних шкал, дослідження частоти виникнення постінсультних ускладнень, визначення показників стаціонарної летальності та строків госпіталізації.
У табл. 1 показана динаміка неврологічних змін за шкалами NIHSS, ESS, SS за період лікування у стаціонарі.
Згідно з даними шкали NIHSS, у першу добу неврологічний дефіцит в основній групі оцінювався Me = 6 балів [3; 9]. Варто відзначити, що у 12 хворих основної групи рівень порушень неврологічних функцій був менший за 6 балів [2; 7,75], тобто легкий. У 7 хворих — понад 8 балів, Me = 9 [8; 10,75], в одного хворого — тяжкий ступінь, 14 балів. У контрольній групі середній сумарний неврологічний дефіцит становив 4 [2; 7,75] бали.
За Європейською шкалою інсульту, що характеризує рівень рухових порушень хворих, які перенесли інсульт, оцінка при надходженні становила в середньому в основній групі Me = 82 [66; 94] та Me = 78 [59; 84] — у контрольній групі.
За шкалою SS у перший день захворювання отримані такі дані: в основній групі Me = 82 [66; 94] та Me = 78 [59; 84] — у контрольній групі.
Аналізуючи процес відновлення за шкалами NIHSS, ESS та SS, можна сказати, що спостерігається поступове покращення втрачених функцій пацієнтів уже на 5-ту добу, без суттєвої різниці в обох групах. На 16-ту добу неврологічний дефіцит і функціональна залежність були більш вираженими в групі пацієнтів, які не приймали Армадин (табл. 1). Це свідчить про позитивний вплив Армадину на відновлення внаслідок інсульту втрачених функцій. Причому значне покращення визначалось після 5-ї доби лікування і досягло клінічної значимості на 16-ту добу.
При оцінці неврологічного дефіциту в пацієнтів в основній і контрольній групах після закінчення лікування відмічались вірогідне зменшення ступеня парезу, регрес чутливих розладів та координаторних порушень серед пацієнтів, які приймали Армадин (табл. 2).
Як первинна кінцева точка дослідження виступала комбінована оцінка змін значень індексу Бартел. Індекс Бартел застосовують для визначення порушень життєдіяльності, незалежності хворого від сторонньої допомоги, особливо найбільш загальних із рутинної діяльності людини (наприклад, прийом їжі, персональний туалет, одягання, пересування та ін.).
При першому огляді пацієнтів індекс Бартел в обох групах був приблизно однаковий (67,8 та 68,2 бала) без вірогідної різниці між групами (р > 0,1). На 16-ту добу від початку інсульту в основній групі індекс Бартел становив 23,6 ± 0,6 бала. Аналогічний показник у контрольній групі становив 34,4 ± 1,2 бала. Тобто здатність до самообслуговування в групі пацієнтів, які приймали Армадин, була вищою, що дозволяє опосередковано судити про покращення якості життя в цих хворих. Армадин вірогідно сприяв досягненню незалежності хворих при користуванні туалетом. Так, у групі, яка отримувала Армадин, 85 % хворих досягли незалежності при виконуванні цих побутових навичок, тоді як у контрольній групі лише 60 % хворих змогли користуватись туалетом самостійно (р < 0,05)
У багатьох хворих, які перенесли ішемічний інсульт, у ранній період розвиваються різні ускладнення, що є основними причинами смерті та суттєво впливають на ступінь інвалідизації і, відповідно, якість життя. Іноді всі зусилля, що були витрачені на збереження життя в першу-другу добу виявляються марними у зв’язку з розвитком гострих ускладнень. Тому протягом останніх років догляду в спеціалізованих центрах із лікування гострих інсультів приділяється таке велике значення. Лікування у спеціалізованих центрах, згідно з доказовими даними, сьогодні є одним із пунктів, рекомендованих для виконання при лікуванні гострих інсультів.
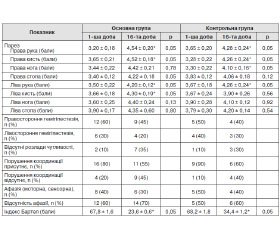
Результати вивчення частоти розвитку найбільш поширених постінсультних соматичних та неврологічних ускладнень протягом перебування в неврологічному стаціонарі з приводу первинних ішемічних інсультів у пацієнтів наведені в табл. 3.
Табл. 3 демонструє, що в пацієнтів контрольної групи спостерігається тенденція до частішого розвитку більшості соматичних та неврологічних ускладнень порівняно з пацієнтами контрольної групи. Особливо це стосувалось пірексії й запорів. Крім того, якщо в групі Армадину тенденція до розвитку ускладнень із часом зменшувалась, то в групі, що не приймала Армадин, кількість ускладнень на 16-ту добу збільшилась. Варто відзначити, що в групі Армадину не визначалось випадків повторного інсульту, а в контрольній групі в 1 (10 %) пацієнтки на 14-ту добу розвинувся повторний ішемічний інсульт, що був діагностований клінічно та підтверджений на МРТ. Випадків ранньої стаціонарної летальності у пацієнтів обох груп не відбулось.
Таким чином, із великою вірогідністю Армадин запобігає виникненню ускладнень у гострому періоді ішемічного інсульту. Можна припустити, що цей ефект ЕМГПС виявляється завдяки його мембранопротекторним та антиоксидантним властивостям, завдяки яким Армадин покращує структурно-функціональні властивості мембран клітин та синаптичну передачу, знижує рівень пригнічення окислювального процесу в умовах гіпоксії та відновлює активність ферментів антиоксидантного захисту, активізуючи супероксиддисмутазу.
У проведеному дослідженні у хворих обох груп визначались помірні порушення ліпідного обміну у вигляді гіперхолестеринемії, гіпертригліцеридемії, помірного підвищення ліпопротеїнів низької щільності. На фоні проведеного лікування в основній та контрольній групах визначалась позитивна динаміка. Дані наведені в табл. 4. Так, рівень загального холестерину в основній групі знизився з 6,27 ± 1,30 ммоль/л до 5,12 ± 1,80 ммоль/л, а в контрольній — відповідно з 6,08 ± 1,12 ммоль/л до 5,54 ± 0,40 ммоль/л (р < 0,05). По-різному знизились також показники рівня тригліцеридів та ліпопротеїнів низької щільності. У контрольній групі рівень зниження був менш значним.
Отримані дані свідчать про ефективність Армадину в корекції порушень ліпідного обміну.
Не викликає сумніву наявність причинно-наслідкових зв’язків між церебральною ішемією мозку та емоційно-афективними розладами. Даний стан можливо пояснити, враховуючи сучасні клініко-експериментальні дослідження [11]. У хворих як із гострою, так і з хронічною ішемією мозку часто розвиваються патологічна тривога, астенічний та вегетативний симптомокомплекси.
У розвитку тривожних розладів одне з провідних місць займає порушення інгібуючого впливу в ЦНС γ-аміномасляної кислоти (ГАМК). На фоні гемодинамічних порушень у мозку відбувається зниження чутливості ГАМК-бензодіазепінового комплексу, а також пригнічення фізіологічних протитривожних механізмів. Порушення ГАМК-залежних процесів у ЦНС опосередковує дисфункцію серотонін-, катехоламін- та пептидергічних систем, що набувають при поступовому прогресуванні тривожних розладів ролі самостійних патогенетичних механізмів [12].
Таким чином, з одного боку, гіпоксичні та ішемічні процеси в головному мозку сприяють розвитку психоемоційних порушень, а з іншого — тривалий стрес, викликаний усвідомленням хворого свого захворювання, стану, у якому він опинився, викликає прогресування проявів ішемії мозку. Наявність у складі Армадину янтарної кислоти сприяє через ланцюг нейрохімічних реакцій підвищенню в головному мозку рівня ГАМК. Таким чином, використання цього сучасного антиоксиданту сприяє зменшенню тривоги, страху та покращенню якості життя пацієнтів. При цьому перевагою є відсутність в Армадину активуючої дії, підвищення судомної активності, порушення сну.
Визначали вплив Армадину на тривогу за допомогою шкали Спілбергера. 16 пацієнтів основної групи та 7 пацієнтів групи контролю пройшли тестування за шкалою Спілбергера, що визначає реактивну та особистісну тривожність.
Як видно з табл. 5, показники реактивної тривоги, що залежить від ситуації, у якій знаходиться пацієнт, значно покращились у групі Армадину: на початку лікування — 42,4 ± 3,4 та 24,6 ± 2,8 бала на 15-ту добу. У контрольній групі відповідні показники суттєво не відрізнялись (41,2 ± 3,2 та 39,1 ± 2,1 бала).
Показники особистісної тривоги, що характеризують якості особистості та мало залежать від ситуації, після лікування також статистично значимо покращились у групі Армадину (р < 0,05).
Таким чином, Армадин проявив антитривожні властивості та сприяв покращенню стану хворих та їх ставлення до життєвої ситуації.
Дослідження показало безпечність застосування Армадину у комплексі зі стандартною терапією для лікування ішемічного інсульту. Препарат не викликав побічної дії. Всі пацієнти отримали лікування в повному обсязі та оцінили ефективність терапії як добру (13 осіб) та задовільну (7 пацієнтів).
Висновки
1. Застосування Армадину в комплексному лікуванні ішемічного інсульту сприяє відновленню втрачених функцій у пацієнтів у гострому періоді.
2. Армадин позитивно впливає на самообслуговування та незалежність від сторонньої допомоги, що, у свою чергу, покращує життя пацієнтів та їх близьких.
3. Армадин запобігає виникненню ускладнень та повторних порушень мозкового кровообігу в гострому періоді ішемічного інсульту.
4. Армадин покращує ліпідний спектр крові та може застосовуватись у хворих із гіперхолестеринемією та дисліпідемією.
5. Армадин впливає на реактивну тривогу та сприяє зменшенню її проявів.
Таким чином, отримані результати свідчать про ефективність застосування Армадину в лікуванні ішемічного інсульту та доцільність його призначення з метою ефективної ранньої реабілітації постінсультних хворих.
1. Klaus Fassbender, Clotilde Balucani. Streamlining of prehospital stroke management: the golden hour // Lancet Neurol. — 2013. — 12. — 585-96.
2. Majid A. Neuroprotection in Stroke: Past, Present, and Future // ISRN Neurol. — 2014. — 515-716. doi: 10.1155/2014/515716.
3. Minnerup J., Wersching H., Schilling M., Schabitz W.R. Analysis of early phase and subsequent phase III stroke studies of neuroprotectants: outcomes and predictors for success // Exp. Transl. Stroke Med. — 2014. — Vol. 6 (1). — 2. doi: 10.1186/2040-7378-6-2.
4. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001.
5. Скворцова В.И. Участие апоптоза в формировании инфаркта мозга // Журнал неврологии и психиатрии им. Корсакова. Приложение «Инсульт». — 2001. — Вып. 2. — С. 12-19.
6. Виничук С.М., Мохнач В.А., Прокопив М.М. Окислительный стресс при остром ишемическом инсульте и его коррекция с использованием антиоксиданта Мексидол // Международный неврологический журнал. — 2006. — 1(5).
7. Парфенов В.А., Хасанова Д.Р. Ишемический инсульт. — М.: Медицинское информационное агентство, 2012.
8. Бадалян О.Л., Савенков А.А., Таишева К.Х., Тертыш-ник О.Ю. Возможности применения Нейрокса в комплексном лечении хронической ишемии мозга // РМЖ. — 2010. — Т. 18, № 6. — С. 1-4.
9. Верещагин Н.В., Танашян М.М., Федорова Т.Н., Смирнова И.Н. Антиоксиданты в неврологии // Атмосфера. Нервные болезни. — 2004. — № 3. — С. 8-12.
10. Скворцова В.И., Стаховская Л.В., Нарциссов Я.Р. и др. Рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности мексидола в комплексной терапии ишемического инсульта в остром периоде // Журн. неврол. и психиатр. — 2006. — Т. 8. — С. 52-59.
11. Костенко Е.В., Петрова Л.В., Зайцев К.А и др. Опыт применения антиоксидантной терапии (мексиприм) при лечении больных в раннем восстановительном периоде ишемического инсульта полушарной локализации // РМЖ. — 2010. — № 18, 22. — С. 1-5.
12. Путилина М.В. Современные представления о терапии тревожно-депрессивных расстройств при хронической ишемии головного мозга // РМЖ. — 2011. — № 19, 2. — С. 1-6.
13. Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія». Наказ МОЗ України від 17.08.2007 № 487 [Электронный ресурс] / Міністерство охорони здоров’я України // Международный неврологический журнал. — 2007. — № 5(15). — Режим доступу: http://www.mif-ua.com/archive/article/3549
14. Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ішемічному інсульті. Наказ МОЗ України від 03.08.2012 № 602. Розділ 1.1. Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога та медична реабілітація) [Электронный ресурс] / Міністерство охорони здоров’я України. — К., 2012. — Режим доступу: http://www.moz.gov.ua/ua/portal/dn_20120803_602.html
15. Kwan J. Early neurological deterioration in acute stroke: clinical characteristics and impact on outcome / J. Kwan, P. Hand // QJM: An International Journal of Medicine. — 2006. — Vol. 99(9). — P. 625-633.
16. Rankin J. Cerebral vascular accidents in patients over the age of 60 / J. Rankin // Scottish Medical Journal. — 1957. — Vol. 2. — P. 200-215.
17. Bonita R. Modification of Rankin Scale: Recovery of motor function after stroke / R. Bonita, R. Beaghole // Stroke. — 1988. — Vol. 19(12). — P. 1497-1500.
18. Mahoney F.I. Functional evaluation: the Barthel Index / F.I. Mahoney, D. Barthel // Maryland State Medical Journal. — 1965. — Vol. 14. — P. 61-65.
19. The Barthel ADL Index: a reliability study / C. Collin, D.T. Wade, S. Davies [et al.] // International Disability Studies. — 1988. — Vol. 10. — P. 61-63.
20. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment / J. Adams, B. Bendixen, L. Kappelle [et al.] // Stroke. –1993. — Vol. 24(1). — P. 35-41.
21. Complications after acute stroke / R.J. Davenport, M.S. Dennis, I. Wellwood [et al.] // Stroke. — 1996. — Vol. 27 (3). — P. 415-420.
22. Hantson L., De Weerdt W. et al. The European Stroke Scale // Stroke. — 1994. — 25. — 2215-2219.

/44/44.jpg)
/45/45.jpg)
/46/46.jpg)
/47/47.jpg)