Статья опубликована на с. 120-124
Проблема мозгового инсульта была и продолжает оставаться одной из наиболее актуальных в клинической неврологии. Ежегодно в мире около 15 млн человек переносят первичный или повторный инсульт. В США этот показатель составляет 750 тыс., в странах Европейского союза — до 1 млн, в Украине — 105–110 тыс. человек в год. В большинстве стран мира мозговой инсульт входит в четверку самых частых причин смерти и является одной из основных причин инвалидизации взрослого населения (Young A.R., 2007; Olesen J. et al., 2006). Среди причин инвалидности у пациентов, перенесших инсульт, важное место занимают не только двигательные нарушения, но и когнитивные расстройства, частота которых колеб-лется в диапазоне от 12 до 57 %. Частота деменций у больных, перенесших инсульт, составляет 26 %, причем с возрастом она имеет тенденцию к увеличению. У больных старше 60 лет риск возникновения деменции в первые 3 мес. после инсульта в 9 раз выше, чем у лиц без инсульта. У больных, перенесших инсульт в возрасте 60–69 лет, деменция развивается в 15 % случаев, в возрасте 70–79 лет — в 26 % случаев, старше 80 лет — в 36 % случаев. По некоторым данным (Дамулин И.В., 2002), повторные инсульты ассоциируются с более высоким риском развития когнитивных нарушений.
Развитие когнитивных расстройств приводит к утяжелению состояния больного и ухудшению прогноза основного заболевания. У таких пациентов в 1,7 раза выше риск летального исхода и в 3,1 раза выше риск возникновения в последующем болезни Альцгеймера, чем у лиц аналогичного возраста без когнитивных нарушений (Яхно Н.Н. и др., 2005).
Однако, несмотря на серьезный прогноз, все же существует потенциальная возможность обратимости сосудистых умеренных когнитивных нарушений. Поэтому не прекращается поиск перспективных лекарственных препаратов, позволяющих обеспечить коррекцию и уменьшить бремя данной патологии.
12–13 марта 2015 года в Буковеле состоялась научно-практическая конференция с международным участием «Современные аспекты клинической неврологии», в рамках которой были рассмотрены актуальные вопросы постинсультных когнитивных нарушений и сосудистой деменции, а также перспективные методы их фармакологической коррекции.
С докладом «Перспективы коррекции когнитивных нарушений у больных после перенесенного инсульта» выступил профессор неврологии Amos D. Korczyn (г. Тель-Авив, Израиль).
Инсульт является одной из основных причин инвалидизации взрослого населения, поскольку даже в случае своевременного оказания квалифицированной медицинской помощи у пациента, который перенес инсульт, наблюдается неполное восстановление потерянных в острый период болезни функций. Примерно у 50 % пациентов после церебральной сосудистой катастрофы наблюдаются когнитивные нарушения, которые в ряде случаев приводят к социально-бытовой дезадаптации даже при отсутствии значительных двигательных нарушений. Данные расстройства препятствуют последующему восстановлению утраченных функций. Когнитивные дисфункции, проявляющиеся в изменении таких интеллектуально-мнестических характеристик, как кратковременная память, абстрактное восприятие, сосредоточенность, внимательность, в виде нарушения концентрации внимания, имеют негативное влияние на социальную активность и качество жизни больных, перенесших инсульт.
Лечение когнитивных расстройств и профилактика их последующего ухудшения являются основными аспектами реабилитации пациентов при данной патологии. Вместе с тем, по мнению ряда исследователей (Keningsberg P.-A. et al.), до 2025 года не ожидается каких-либо значительных успехов в разработке лекарственных препаратов, призванных решить эту проблему. Поэтому профилактика таких заболеваний, как сосудистая деменция, болезнь Альцгеймера, путем воздействия на сосудистые и связанные с образом жизни факторы риска может быть более реалистичной целью, чем их лечение. Теоретически медикаментозная терапия для улучшения когнитивной функции может способствовать лучшему ее восстановлению, однако в настоящее время отсутствуют достаточные клинические доказательства ее эффективности. Именно поэтому признана острая необходимость в убедительных, хорошо спланированных исследованиях по изучению эффективности лечения пациентов с постинсультными нарушениями когнитивной функции и профилактики ее ухудшения.
Сосудистые когнитивные нарушения (СКН) представляют собой нарушение когнитивных функций различной степени выраженности, которые формируются вследствие воздействия целого ряда факторов.
Существует несколько вариантов сосудистых когнитивных нарушений:
— СКН мультиинфарктной природы: в результате повторных острых нарушений мозгового кровообращения с формированием крупных очагов;
— когнитивные нарушения вследствие единичного инфаркта в «стратегической» зоне головного мозга. К таким зонам относятся зрительные бугры, гиппокамп, полосатое тело, префронтальная лобная кора, область стыка височной, теменной и затылочной долей левого полушария;
— СКН вследствие гипоперфузии головного мозга, возникающие в результате нарушения системной гемодинамики и снижения церебральной перфузии;
— СКН при лакунарном инфаркте;
— болезнь Бинсвангера;
— постинсультные когнитивные нарушения (ПИКН).
Под ПИКН следует понимать любые когнитивные расстройства, которые имеют временную связь с инсультом, т.е. выявляются в первые 3 месяца после него (ранние ПИКН) или в более поздние сроки, но обычно не позднее года после инсульта (поздние ПИКН). Согласно собственным исследованиям их частота варьирует от 10 % (в течение 3 месяцев после инсульта) до 30 % случаев (в течение года).
Единственным объективным методом оценки выраженности когнитивных расстройств после инсульта является нейропсихологическое тестирование. При выборе конкретной методики проведения и интерпретации результатов тестирования необходимо учитывать преморбидный интеллектуальный уровень пациента (образование, культурные особенности), клинические особенности предполагаемых когнитивных расстройств, степень чувствительности, специфичности и воспроизводимости того или иного нейропсихологического теста.
В настоящее время международное научное сообщество рекомендует для использования в повседневной практике Монреальскую шкалу оценки когнитивных функций (Montreal Cognitive Assessment — МоСА). Преимущество данного метода заключается в том, что он содержит задания на управляющие функции и на память (заучивание пяти слов). Следовательно, шкала МоСА применима как при сосудистых когнитивных нарушениях, так и при сочетании цереброваскулярной патологии с нейродегенеративным процессом.
Опыт применения шкалы МоСА свидетельствует о высокой чувствительности данной методики, но недостаточной специфичности. Поэтому низкий результат теста (менее 26 баллов) не всегда означает наличие у пациента когнитивных расстройств, в то время как высокий результат (выше 26 баллов) практически исключает когнитивные нарушения. В спорных случаях целесообразно наблюдение в динамике и повторное тестирование.
Кроме того, для подтверждения наличия или отсутствия постинсультных когнитивных нарушений важным является выявление предикторов с помощью методов визуализации, определения факторов риска и биомаркеров.
Современные методы нейровизуализации позволяют более точно представить субстрат ПИКН. Помимо уточнения характера, обширности и локализации поражения мозга, связанного с развитием инсульта, эти методы выявляют дополнительные церебральные изменения, повышающие риск ПИКН («немые» инфаркты, диффузное поражение белого вещества, церебральные микрокровоизлияния, церебральная атрофия и т.д.). «Немые» инфаркты, случайно выявляемые при КТ или МРТ (встречаются примерно в 5 раз чаще, чем клинически явные эпизоды инсульта), являются несомненным фактором развития деменции. Выраженность диффузного поражения белого вещества (в том числе до развития инсульта) также является независимым предиктором ПИКН. Однако ключевым фактором, влияющим на риск развития когнитивных нарушений, по данным большинства исследований, является церебральная атрофия. Связь с развитием ПИКН показана как в отношении общей церебральной атрофии, так и в отношении атрофии медиальных отделов височных долей, особенно гиппокампа.
К факторам риска относятся повторный характер инсульта, большой объем очага, выраженные двигательные и/или сенсорные нарушения, локализация очага в таламусе, внутренней капсуле, лобных долях, левом полушарии.
Исследования биомаркеров в цереброспинальной жидкости (b-амилоида и t-протеина), характерных для болезни Альцгеймера, позволяют провести дифференциальную диагностику с постинсультными когнитивными нарушениями либо предположить их сочетание.
ПИКН является частью нозологического синдрома сосудистой деменции. Было изучено несколько подходов к ее лечению. Тем не менее препараты, применяемые при болезни Альцгеймера, такие как ингибиторы холинэстеразы или блокаторы рецепторов N-метил-D-аспартата, продемонстрировали лишь ограниченную эффективность при сосудистой деменции, и ни один из них не был одобрен основными регуляторными агентствами для применения по данному специфическому показанию (Еrkinjuntti, 2002; Romen G.C. et al., 2010).
Препараты с плейотропными эффектами и множественными механизмами действия продемонстрировали потенциал в исследованиях, посвященных сосудистой деменции.Так, Церебролизин показал преимущество в сравнении с плацебо: разница между группами по шкале ADAS-Cog cоставила 6,2 балла (Guekht A.B. et al., 2011), но лишь в одном исследовании. Цитиколин — субъективное улучшение в последнем исследовании при постинсультных когнитивных нарушениях (Alvarez J. et al., 2011). Актовегин показал значимые положительные данные в ряде исследовательских работ при лечении смешанной деменции.
Актовегин (Takeda Pharmaceuticals) представляет собой депротеинизированный ультрафильтрат крови телят, включающий более 200 биологических субстанций. Этот препарат применяется в клинической практике по ряду показаний, включая ишемический инсульт, черепно-мозговую травму, энцефалопатии различного генеза, нарушения периферической артериальной и венозной перфузии, диабетическую полинейропатию.
Благодаря большому количеству биоактивных составляющих Актовегин оказывает влияние на множество биохимических процессов, а также обладает плейотропными нейропротекторными и метаболическими эффектами. Cогласно данным F. Machicao et al. (2012), Актовегин при добавлении к первичной культуре нейронов крыс in vitro дозозависимо увеличивает количество нейронов и синапсов, а также снижает апоптоз. Также было установлено, что Актовегин активирует in vitro экспрессию NF-κB, фактора транскрипции с предполагаемыми нейропротекторными свойствами (Elminger M.W., 2011), что объясняет его нейропротекторные и антиапоптические эффекты. Кроме того, он оказывает множественные метаболические действия, включая улучшение поглощения и утилизации кислорода, повышение энергетического метаболизма клетки, поглощения глюкозы, ускорение заживления ран, повышение выживаемости клеток в условиях ишемии и гамма-облучения. Эти эффекты могут улучшать энергетический метаболизм ткани головного мозга, а также обусловливать значимые благоприятные эффекты при когнитивных нарушениях, вызванных перенесенным инсультом.
В предшествующих исследованиях были продемонстрированы клиническая эффективность и благоприятный профиль переносимости Актовегина у пациентов с деменцией смешанного генеза.
В двойном слепом плацебо-контролируемом исследовании с участием 60 пациентов с деменцией легкой/средней степени выраженности (органическим мозговым синдромом) внутривенное введение Актовегина способствовало статистически значимо более выраженному улучшению когнитивной функции (Kanowski S. et al., 1995). Об этом свидетельствовала оценка терапии по гериатрической шкале SCAG и шкале общей клинической оценки по сравнению с плацебо спустя 4 нед. Прием Актовегина перорально также достоверно улучшал показатели шкал краткого теста оценки когнитивной функции и общей клинической оценки по сравнению с таковыми в группе плацебо в исследовании с участием 200 пациентов с деменцией легкой/средней степени выраженности (Herrmann W.M. et al., 1994). Актовегин также был эффективен в улучшении когнитивной функции в рандомизированном плацебо-контролируемом исследовании с участием 120 пациентов с деменцией, у 77 из которых диагностировали сосудистую деменцию (Herrmann W.M., 1992).
Позднее были проведены два пилотных исследования (Derevyannykh E.A. et al., 2008), по данным которых был сделан вывод, что применение Актовегина способствовало статистически значимо лучшему восстановлению функционального состояния и уменьшению неврологического дефицита при назначении в острый период ишемического инсульта. В первом исследовании Актовегин (n = 32) обусловливал достоверно более выраженное улучшение показателей краткой шкалы оценки психического статуса и шкалы неврологического дефицита Гусева и Скворцовой по сравнению с таковыми при использовании пирацетама (n = 11) после проведения терапии в течение 30 сут. В другом исследовании применение Актовегина внутривенно в течение 10 сут. обусловливало статистически значимое улучшение функционального восстановления по шкале Barthel на 30-й день после инсульта при назначении как в виде монотерапии (n = 25), так и в комбинации с цитиколином (n = 25) по сравнению с таковым в группе плацебо (n = 26). Показатель по шкале NIHSS также был лучше при лечении Актовегином, хотя достоверной значимости этот результат достигал только в группе комбинированной терапии с цитиколином. Тем не менее на сегодняшний день отсутствуют полученные в масштабных продолжительных рандомизированных контролируемых исследованиях данные о влиянии Актовегина на когнитивную функцию после инсульта.
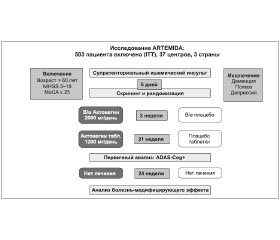
Именно поэтому было спланировано 12-месячное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование ARTEMIDA, основная цель которого заключается в оценке эффекта лечения Актовегином пациентов с постинсультными когнитивными нарушениями. В нем запланировано участие в общей сложности 503 пациентов в 37 исследовательских центрах трех стран — России, Беларуси и Казахстана. Протокол исследования был одобрен соответствующими компетентными органами и этическими комитетами, а само исследование проводится в соответствии с принципами Хельсинкской декларации, надлежащей клинической практики (GCP) и всеми существующими локальными нормативными требованиями.
Исследование предусматривало исходный скрининг (менее 7 сут. после произошедшего инсульта) с помощью шкалы МоСА, по завершении которого подходящие пациенты были рандомизированы на две группы: для дополнительного назначения Актовегина или плацебо в течение 6 мес.
После этого за пациентами осуществляется наблюдение в течение еще 6 мес., на протяжении которых участники исследования получают лечение согласно стандартной клинической практике, но без применения Актовегина (рис. 1).
Основной целью исследования является оценка эффективности и безопасности Актовегина в симптоматическом лечении пациентов с постинсультными когнитивными нарушениями. Мы очень надеемся, что исследование поможет ответить на вопрос о наличии у Актовегина болезнь-модифицирующего эффекта. Об этом можно будет судить по тому, как эффекты лечения при ПИКН, наблюдаемые к концу первых 6 мес., будут сохраняться в период последующего наблюдения после окончания этой терапии.
Участники, рандомизированные в группу Актовегина, получают препарат в дозе 2000 мг/сут (8 мг/мл) внутривенно до 20 инфузий с последующим назначением Актовегина перорально в дозе 1200 мг/сут (по 2 таблетки по 200 мг 3 раза в день) в оставшийся период 6-месячного лечения. Режим назначения отражает актуальные показания к применению Актовегина, за исключением того, что период пероральной терапии продлен. Этот пролонгированный период лечения в более высокой дозе, составившей 1800 мг/сут, ранее был признан безопасным и эффективным в исследовании с участием пациентов с диабетической полинейропатией.
Период лечения на протяжении 6 мес. (с последующим 6-месячным периодом наблюдения) был выбран в связи с тем, что в руководстве Европейского агентства лекарственных средств такой интервал признан минимально необходимым для проведения исследований, посвященных деменции.
В качестве первичной конечной точки исследования было выбрано изменение показателя когнитивной подшкалы шкалы оценки тяжести болезни Альцгеймера (Alzheimer’s Disease Assessment Scale, cognitive subscale — ADAS-cog+) по сравнению с исходным значением. Расширенная версия шкалы ADAS-cog (ADAS-cog+) включает три дополнительные характеристики: корректурная проба на вычеркивание двух знаков для оценки внимания, тест на отсроченное припоминание для оценки укрепления памяти и лабиринтный тест для оценки способности целенаправленной деятельности. Шкала ADAS-cog+ разработана в целях обеспечения большей чувствительности в выявлении пациентов с более легкой деменцией и была бы особенно полезной для оценки сосудистых когнитивных нарушений без деменции, поскольку способность к концентрации внимания и целенаправленной деятельности изменяется на ранних стадиях этого патологического состояния.
Безопасность будет оценена на основании регистрации неблагоприятных событий, оценки лабораторных данных, результатов физикального обследования, основных показателей жизнедеятельности и параметров электрокардиограммы.
В настоящее время исследование ARTEMIDA завершилось. К сожалению, мы пока располагаем лишь промежуточными результатами, которые являются очень обнадеживающими. Мы с нетерпением ожидаем окончательных выводов исследования, которые будут представлены на Первом конгрессе Европейской ассоциации неврологов, который пройдет в Берлине в июне этого года.
Выводы
— Инсульт и деменция являются распространенными заболеваниями, к сожалению, без легких и высокоэффективных подходов в обозримом будущем.
— Сосудистые когнитивные нарушения — важная и сложная проблема, требующая инновационных и стратегических решений.
— Постинсультные когнитивные нарушения являются частым состоянием после инсульта и представляют значительное бремя для пациентов и лиц, осуществляющих уход за ними, а также для системы здравоохранения в целом. У пациентов с высоким риском ПИКН должна использоваться шкала МоСА.
— Результаты исследования ARTEMIDA дадут ряд важных ответов, что позволит определить терапевтическую стратегию постинсультных когнитивных нарушений.

/123/123.jpg)