Статья опубликована на с. 63-69
По современным представлениям, система гемостаза является полисистемой, которая играет ведущую роль в сохранении гомеостаза организма [5]. Доказано, что типичной реакцией гемостаза на хирургическую агрессию является сочетание гиперкоагуляции с увеличением фибринолитической активности крови. Поддержание стабильности гемостатического баланса (Гайтон А.К., 2008) достигается равновесием между эндогенными прокоагулянтами и антикоагулянтами. При высокой травматичности оперативного вмешательства изменения, первоначально имеющие компенсаторно-приспособительный характер, становятся избыточными, приобретая таким образом четко очерченную патологическую направленность. Хирургический стресс-ответ становится основной причиной послеоперационной (п/о) дисфункции различных органов и систем, что диктует необходимость разработки подходов к его коррекции (Овечкин А.М., 2008). Сегодня итогом многих исследований выступает риск кровотечений как риск, связанный с профилактикой тромбоэмболических осложнений (ТЭО), а приоритетным заданием анестезиолога остается эффективная защита пациента от операционного стресса, адекватное лечение и профилактика интра- и послеоперационных осложнений, коррекция последствий хирургической агрессии [5, 6]. В большинстве исследований при анализе эффективности использования для тромбопрофилактики низкомолекулярных гепаринов (НМГ) преобладал учет тромботических осложнений [2–4], и только в единичных работах учитывали геморрагические. Венозная тромбоэмболия (ВТЭ) является основной причиной смерти и инвалидизации в онкологии, ортопедии и травматологии, в акушерстве риск увеличивается вдвойне. ВТЭ ежегодно приводит к 540 тыс. случаев смерти в Европейском союзе [5]. Летальный исход отмечается в 6 % всех случаев тромбоза глубоких вен (ТГВ) и в 12 % всех случаев легочной эмболии (ЛЭ) [8]. У 22–40 % больных в течение 2 лет после ТГВ развивается посттромботический синдром, который приводит к значительному нарушению качества жизни больных и представляет собой существенную нагрузку на систему здраво–охранения [1, 7]. Для профилактики и терапии артериальных или венозных тромбозов используются антикоагулянты различных групп (Bates S. еt al., 2008; Geerts W. еt al., 2008; Samama С. еt al., 2008). В европейских странах изменился взгляд на использование НМГ как при до-, так и при предоперационном его старте [9, 10]. Так, в Европе тромбопрофилактика проводится за 12 часов до оперативного вмешательства. В США — через 12–24 часа после оперативного вмешательства, для того чтобы свести к минимуму риск геморрагических осложнений. В Великобритании тромбопрофилактику начинают после оперативного вмешательства. При этом время ее начала зависит от выбранного антикоагулянта. Послеоперационная тромбопрофилактика имеет право на существование, если риск кровотечения превышает риск тромбоэмболических осложнений (Carsten Perka, Германия, 2011). В метаанализах показано, что при дооперационном использовании НМГ уменьшается частота тромботических осложнений, но увеличивается риск возникновения геморрагических [1, 4, 7].
По данным метаанализа, проведенного P. Mismetti и соавторами (2001), опирающегося на 59 клинических исследований, НМГ на 29 % превосходят НФГ в снижении риска клинически значимых ТЭО без увеличения риска развития больших и малых кровотечений. В лечении острого ТГВ НМГ, как минимум, не уступают НФГ, а возможно, и превосходят их. Рекомендуют оценивать соотношение риск/польза в каждом случае, основываясь на типе и дозе конкретного антикоагулянта, виде анестезии и факторах риска со стороны пациента. По данным междисциплинарных клинических рекомендаций, тромбопрофилактику с использованием НМГ следует начинать до или после операции, в зависимости от режима, признанного наиболее целесообразным в последних исследованиях [1].
Для определения оптимальной дозы антикоагулянта, достаточно эффективной и безопасной для профилактики ВТЭ, Balibrea и соавторы (2006) оценивали частоту зафиксированных симптомов ВТЭ, эпизодов кровотечений, тромбоцитопении, смертей и возможных осложнений, связанных с профилактикой ВТЭ [11]. Тромбопрофилактика, начатая ранее чем через 6 часов после операции, может увеличить вероятность кровотечения без повышения эффективности предотвращения ТЭО [7]. Профилактика тромбоза, начатая позже 12–24 часов после операции, может оказаться менее эффективной. Оптимальное начало тромбопрофилактики — через шесть часов после окончания операции [12].
Фармакологическая профилактика НФГ или НМГ может предотвратить в 10 раз больше нефатальных ВТЭ, чем нефатальных кровотечений. Данные умеренного качества свидетельствуют, что при использовании НФГ и НМГ можно пред–отвратить четыре смертельных случая от легочной эмболии на 1000 лечившихся пациентов [13]. Согласно метаанализу (Bottaro F.J. и соавт., 2008) увеличение продолжительности профилактических мероприятий с применением НМГ является эффективным и не повышает риск развития обширных кровотечений.
В исследованиях J.W. Eikelboom, посвященных профилактике ВТЭ, было показано, что обширные кровотечения являются сильным предиктором летального исхода (поскольку риск летального исхода возрастает в 7 раз). Вместе с тем в работах [1, 4, 5] было отмечено, что на фоне дооперационного введения эноксапарина натрия средняя кровопотеря при лапароскопической холецистэктомии достигала 64,7 ± 48,9 мл, что соответствовало ее величине без использования антикоагулянта. В исследовании CANBESURE было показано, что при использовании бемипарина натрия для тромбопрофилактики у хирургических пациентов на 82 % уменьшалась частота возникновения тяжелых ВТЭ без увеличения частоты геморрагических –осложнений. Так, в случае применения бемипарина натрия (CANBESURЕ) частота ВТЭ равнялась 10,1 и 10,8 %, при этом частота геморрагических осложнений была меньше на 0,6 % в сравнении с 7,3 и 11,5 % на фоне использования надропарина кальция и эноксапарина натрия. Результаты другого исследования, EXCLAIM, подтверждали вышесказанное.
Эффективность и безопасность бемипарина натрия по сравнению с НФГ была доказана у пациентов с умеренным и высоким риском ВТЭ [2]. В проспективном обсервационном исследовании по эффективности и безопасности бемипарина натрия (1009 чел., 2001–2003 гг.) частота зарегистрированных симптоматических ТГВ без тромбоэмболии легочной артерии (ТЭЛА) у травматологических больных составила 0,3 %, а уровень серьезных кровотечений достигал 1,4 % (14 случаев). При этом в 10 случаях отмечалось кровотечение из раны, в 3 — кровоизлияние в протезированный сустав, в 1 — желудочно-кишечное кровотечение. У 16,1 % пациентов возникла гематома в области послеоперационной раны, но никому из них не потребовалось местного повторного вмешательства или продления госпитализации. Реакции в месте введения препарата развились у 20 % пациентов, у большинства — умеренно выраженный экхимоз. Не было ни одного случая гематомы объемом более 5 см в диаметре в месте инъекции препарата, требовавшей отмены препарата. При этом количество возникших кровотечений было низким и не превышало 1,4 %, что соответствовало результатам других клинических исследований (Kakkar V.V., 2000, Novarro-Quilis A., 2003). В целом этот показатель ниже, чем при приеме фондапаринукса (2,7 %), и подобен (1,7 %) таковому при использовании эноксапарина натрия [14, 15]. Что касается оптимальных сроков начала тромбопрофилактики бемипарином натрия при ортопедических операциях, то при объединенном анализе результатов 5 рандомизированных исследований (n = 1759), в которых в качестве объективного контроля использовалась венография или ультразвуковое исследование (УЗИ), показано, что введение первой дозы препарата через 6 ч после завершения операции ассоциируется со снижением на 50 % частоты серьезных нежелательных событий по сравнению с предоперационным началом тромбопрофилактики (Gomez-Outes A. et al., 2008).
В многоцентровом двойном слепом рандомизированном исследовании M. Gonzalez и соавт. (1996) сравнивали эффективность бемипарина натрия в дозе 2500 МЕ и НФГ — 5000 МЕ дважды в сутки у пациентов с умеренным риском ВТЭ при проведении абдоминальных операций. Ни в одной группе не было зарегистрировано ни одного случая ТГВ или ТЭЛА. При послеоперационном старте тромбопрофилактики в 29,3 % случаев госпитализировать пациентов можно было в день операции, что сокращало расходы на лечение и пребывание больного в стационаре. При оценке эффективности и безопасности послеоперационного старта тромбопрофилактики бемипарином натрия во всей популяции пациентов отмечено только 3 случая ТГВ (0,3 %) и ни одного случая ТЭЛА (Abad J.I., Испания, 2010).
Было показано, что на фоне применения НМГ сокращение частоты всех случаев ВТЭ (24,4 против 22,7 %) было статистически незначительным, но существенно сокращалась частота ЛЭ (3,1 против 9,2 %) после спинальной травмы (Paciaroni M. и соавторы, 2008). Кроме того, использование НМГ по сравнению с применением НФГ было связано с почти значимым сокращением больших кровотечений (2,4 против 5,2 %). Введение НМГ в высоких дозах (> 3400 ЕД) необходимо начинать за 12 часов до операции с целью предотвращения кровотечения [5]. В исследовании G. Simonneau (Кламаре, Франция) с соавторами (2006) частота ВТЭ при использовании надропарина кальция и эноксапарина натрия составляла соответственно 15,9 и 12,6 %. Однако частота симптоматической ВТЭ и кровотечений была ниже в группе надропарина кальция (0,2 против 1,4 % и 7,3 против 11,5 % соответственно).
Начало введения НМГ в предоперационном режиме влияет на риск возникновения кровотечений. При применении эноксапарина натрия в дозе 40 мг при тотальном протезировании тазобедренного сустава или реконструкции переломов бедра (EPHESUS и PENTHIFRA) в первые часы после операционной травмы (Lassen M.R., 2009) усиливались процессы свертывания крови, связанные с потреблением основных субстратов гемокоагуляции — тромбоцитов и фибриногена [16]. У больных, получавших надропарин кальция (2009), во время операции показатели противосвертывающей и фибринолитической систем крови были стабильны, отсутствовало потребление AT III. –Удлинение протромбинового времени, активированного частичного тромбопластинового времени, тромбинового времени было менее выраженным, чем у пациентов, получавших НФГ в стандартных дозах [7, 8].
Вопрос о времени и начале тромбопрофилактики на сегодня остается дискутабельным. Существующие рекомендации европейских стран в качестве базовой рекомендации содержат указания о предоперационном начале тромбопрофилактики, однако в рутинной клинической практике чаще руководствуются принципом, что введение НМГ может переноситься на 6–12 часов после операции. Единого консенсуса на сегодня не существует. Идея послеоперационного начала тромбопрофилактики активно развивается на фоне накапливающихся доказательств того, что введение антикоагулянтов до операции не имеет объективных преимуществ, в то же время риск увеличения интраоперационной кровопотери возрастает. Y. Falck-Ytter рекомендует отдавать предпочтение применению НМГ по сравнению с другими средствами, которые были рекомендованы в качестве альтернативных (уровень 2C/2B, Falck-Ytter Y. и соавт. Chest, 2012). В США и Канаде больший акцент традиционно делался на увеличении риска кровотечений, чем на эффективности профилактики ВТЭ [4, 6], что подтверждено в 7-м издании руководства Американского колледжа пульмонологов (АССР) [7].
Что касается риска кровотечений на фоне применения НМГ, то, по мнению ряда авторов, оптимальным соотношением эффективности и риска обладают дозы НМГ не выше 3400 анти-Ха МЕ, поскольку применение больших доз нередко ассоциируется с большей вероятностью выраженных кровотечений.
В качестве конечной точки безопасности была принята частота развития кровотечений. Под критерий «большого» подходило:
— клинически признанное кровотечение, проявившееся снижением уровня гемоглобина не меньше чем на 20 г/л или требовавшее проведения гемотрансфузии в объеме 2 и больше доз крови; кровоизлияние в жизненно важные органы (внутричерепные, спинальные, ретроперитонеальные, внутриглазные, внутрипредсердные или перикардиальные, внутримышечные кровотечения с признаками компартмент-синдрома);
— фатальное кровотечение (со снижением уровня гемоглобина больше чем на 20 г/л), кровотечение, которое требовало хирургического вмешательства для его остановки;
— клинически значимое, другое кровотечение, соответствующее критериям «большого», которое требовало отмены антикоагулянта, спонтанная гематома на поверхности кожи ≥ 25 см2, спонтанное кровотечение из носа/рта/глотки длительностью 5 мин и больше, спонтанное желудочно-кишечное или ректальное кровотечение, кровотечение из десен дольше 5 мин;
— «малое» кровотечение — любое кровотечение, которое не входило в критерии «большого» или «клинически значимого». К шкалам для определения тромбоэмболического риска относятся CHADS2, Caprini Thrombosis Risk Factor Assessment scale, Rogers score.
Опубликованные данные рандомизированных исследований не дают точных рекомендаций по поводу до- или послеоперационного старта тромбопрофилактики [2, 4, 5, 7, 8]. В большинстве исследований при анализе эффективности использования для тромбопрофилактики НМГ преобладает учет тромботических осложнений [12–14, 16], и только в единичных работах учитывают геморрагические. Таким образом, стратегия профилактики базируется на соотношении эффективности предупреждения тромботических осложнений и безопасности относительно геморрагических осложнений (Укр. журнал Г.О. Можаева, 2005, т. 6, № 3).
Цель работы: изучить влияние старта тромбопрофилактики на частоту осложнений, связанных с ней.
Материалы и методы
Работа выполнялась на базе хирургических отделений КП «Днепропетровская шестая ГКБ ДОС» и центра общей и пластической хирургии «Гарвис» ТМ ООО «Эндотехномед» (Днепропетровск). В исследование включено 200 пациентов, которым проводились абдоминальные оперативные вмешательства в размере лапароскопической холецистэктомии или аллопластики больших вентральных грыж с использованием тотальной внутривенной анестезии с миорелаксацией и искусственной вентиляцией легких. Индукцию в наркоз проводили тиопенталом натрия (4–5 мг/кг), поддерживающая анестезия — путем постоянной инфузии пропофола (4–5 мг/кг/ч). Анальгезию обеспечивали введением фентанила (5 мкг/кг за первый час и 3 мкг/кг/ч в дальнейшем). Для миорелаксации использовали атракурия безилат (200 мкг/кг/ч) в течение 45 ± 15 минут. Критерии включения: возраст от 40 до 65 лет, индекс массы тела от 20 до 35 кг/м2, отсутствие сопутствующих заболеваний или сопутствующие заболевания в стадии стойкой компенсации, умеренный тромбоэмболический риск по Caprini, информированное согласие пациента на участие в исследовании. Критерии исключения из исследования: возраст до 40 и более 65 лет, индекс массы тела до 20 и более 35 кг/м2, пациенты с сопутствующими заболеваниями в стадии декомпенсации, высокий тромбоэмболический риск по Caprini, отказ пациента от участия в исследовании, наличие коагулопатии.
В зависимости от тромбопрофилактики пациенты (n = 200) были разделены на 6 групп:
— 1-я группа (n = 30), контрольная, — НФГ, 5000 МЕ за 2 часа до операции и по 5000 МЕ 2 раза в сутки в течение 7 дней после операции;
— 2-я группа (n = 30) — надропарин кальция в дозе 9500 анти-Ха МЕ (0,3 мл), который вводился за 2 часа до операции и по 0,2 мл 1 раз в сутки в течение 7 дней после нее;
— 3-я группа (n = 48) — эноксапарин натрия, 2500 МЕ за 2 часа до операции и 1 раз в сутки в течение 7 дней после операции;
— 4-я группа (n = 29) — эноксапарин натрия, 2500 МЕ за 8 часов до операции и 1 раз в сутки 7 дней после нее;
— 5-я группа (n = 34) — бемипарин натрия, 2500 МЕ за 2 часа до операции и 1 раз в сутки в течение 7 дней после операции;
— 6-я группа (n = 29) — бемипарин натрия, 2500 МЕ через 6 часов после операции, 1 раз в сутки в течение 7 дней после нее.
Точки контроля: перед операцией, 1, 5 и 7-е сутки после операции, 30-е сутки после выписки из стационара. У пациентов исследовали конечные точки эффективности и безопасности вводимых препаратов: объем кровопотери на фоне тромбопрофилактики, повторное вмешательство по поводу геморрагических осложнений, кровоточивость раны в раннем послеоперационном периоде, дополнительная терапия кровоточивости, кровотечение либо кровоточивость, которые не привели к отмене препарата и использованию дополнительных мероприятий, повышенная кровоточивость из раны по дренажам в послеоперационном периоде. Сюда же относили тромботические осложнения: бессимптомный либо симптоматический ТГВ, ТЭЛА. Статистическая обработка результатов — с помощью программного обеспечения пакета MS Excel, анализ проводился с помощью расчета критериев Стьюдента при р < 0,05.
Обсуждение результатов
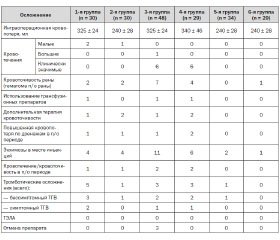
Анализ показал, что наибольшим объем кровопотери (340 ± 46 мл) был у пациентов с тромбопрофилактикой эноксапарином натрия, начатой за 8 часов до оперативного вмешательства. В то же время пациенты, у которых использовали тромбопрофилактику бемипарином натрия, независимо от ее начала, и пациенты с дооперационной тромбопрофилактикой надропарином кальция имели наименьший объем кровопотери (240 ± 28 мл).
При этом у 7 пациентов при дооперационном (за 2 часа) старте тромбопрофилактики эноксапарином натрия была отмечена клинически значимая кровопотеря, которая обусловила повторное оперативное вмешательство (n = 2), использование трансфузионных сред (n = 2), отмену антикоагулянта (n = 3) и исключение больных из данного исследования (n = 3). В группе тромбопрофилактики эноксапарином натрия, начатой за 8 часов до операции, также регистрировали клинически значимые кровотечения (n = 6), которые не потребовали отмены данного препарата, но в то же время обусловливали применение дополнительной гемо–статической терапии (n = 1) и трансфузионных сред (n = 1). Вместе с тем повышенная кровоточивость раны в раннем послеоперационном периоде имела место у 7 больных в группе со стартом тромбопрофилактики эноксапарином натрия за 2 часа до операции.
Это на 42 % превышало частоту данного вида осложнения при тромбопрофилактике эноксапарином натрия, начатой за 8 часов до операции, и на 71 % — показатели пациентов с тромбопрофилактикой НФГ и надропарином кальция, проводимой в стандартном режиме.
Лучший гемостатический профиль, не зависящий от начала тромбопрофилактики, имели пациенты, получавшие бемипарин натрия, на основании отсутствия данных о клинически значимой кровопотере (табл. 1).
Кровопотеря по дренажам имела место при тромбопрофилактике эноксапарином натрия, начатой за 8 часов до операции (n = 2), число ее случаев на 50 % превышало таковое при старте тромбопрофилактики НФГ, надропарином кальция или эно–ксапарином натрия за 2 часа до операции. В то же время на фоне тромбопрофилактики бемипарином натрия, независимо от времени ее начала, не было отмечено ни одного случая увеличения объема кровопотери по дренажам.
Частота умеренно выраженного экхимоза в месте введения препарата была наибольшей в группе тромбопрофилактики эноксапарином натрия, начатой за 2 часа до операции (n = 11). Это на 45 % превышало число случаев при старте тромбопрофилактики эноксапарином натрия за 8 часов до операции и на 63 % — при тромбопрофилактике НФГ и надропарином кальция.
Независимо от вида препарата, использованного для тромбопрофилактики, не было зарегистрировано ни одного случая гематомы объемом свыше 25 см в диаметре в месте инъекции препарата. Частота кровотечения в периоперационном периоде при тромбопрофилактике эноксапарином натрия, независимо от времени ее начала до операции, на 50 % превышала количество случаев при тромбопрофилактике НФГ, а также надропарином кальция с дооперационным стартом. При этом на фоне тромбопрофилактики бемипарином натрия, как при до-, так и при послеоперационном ее начале, не было зарегистрировано такого вида осложнений.
При анализе результатов допплерографического УЗИ сосудов нижних конечностей на 30-е сутки после операции наибольшая частота бессимптомного ТГВ была зафиксирована у пациентов, получавших НФГ (n = 3). Это на 33 % превышало таковую в группах эноксапарина натрия. У пациентов с тромбопрофилактикой надропарином кальция и бемипарином натрия, начатой за 2 часа до операции, частота бессимптомного ТГВ составляла 1 случай на каждую группу. Симптоматические проявления ТГВ, подтвержденные при допплерографическом УЗИ сосудов нижних конечностей, были отмечены у 2 пациентов с тромбопрофилактикой НФГ. Это на 50 % превышало количество случаев в группах тромбопрофилактики эноксапарином натрия при полном отсутствии данного вида осложнений у пациентов, получавших надропарин кальция либо бемипарин натрия с послеоперационным стартом. Независимо от препарата, используемого для тромбопрофилактики, и начала его введения ни одного летального исхода, связанного с фатальным тромбозом или кровотечением, зарегистрировано не было.
Выводы
1. Применение бемипарина натрия, независимо от времени начала тромбопрофилактики, так же как и дооперационный старт тромбопрофилактики надропарином кальция, обеспечивает уменьшение интраоперационной кровопотери на 26,1 %. Интраоперационная кровопотеря при старте тромбопрофилактики за 2 часа до операции одинакова на фоне использования эноксапарина натрия и НФГ, тогда как при тромбопрофилактике эноксапарином натрия, начатой за 8 часов до операции, она увеличивается на 4,6 %.
2. Применение эноксапарина натрия для тромбопрофилактики в дооперационном периоде достоверно повышает кровоточивость раны и увеличивает частоту кровотечений в послеоперационном периоде.
3. Тромбопрофилактика бемипарином натрия, независимо от начала старта, обеспечивает наименьшее число экхимозов в месте инъекции препарата.
4. Наибольшее число тромботических осложнений в виде ТГВ отмечается на 30-е сутки после операции, это обусловлено использованием для профилактики ТЭО НФГ в стандартном режиме.
Список литературы
1. Hirsh J. Antithrombotic and Thrombolytic Therapy / J. Hirsh, P. Chair, G. Guyatt; ACCP Guidelines (8th ed.) // Chest. — 2008. — Vol. 133. — P. 71-109.
2. Anticlotting drugs and regional anaesthetic techniques: comparative update of the safety recommendations / J. Llau, J. Andres, C. Gomar [et al.] // EJA. — 2007. — Vol. 24. — P. 387-398.
3. Venous thromboembolism prevention in surgery and obstetrics: clinical practice guidelines / C. Samama, P. Albaladejo, D. Benhamou [et al.] // EJA. — 2006. — Vol. 23. — P. 95-116.
4. Observational study of bemiparin, first dose admini–stered 6 hours after surgery, in hip or knee replacement surgery / J. Abad, A. Gomez-Qutes, J. Martinez-Gonzales [et al.] // Pathophysiol. Haemost. Thromb. — 2007. — Vol. 36 (suppl. 1).
5. Treasure T. NICE guidance on reducing the risk of venous thromboembolism in patients admitted to hospital / T. Treasure, J. Hill // J. R. Soc. Med. — 2010. — Vol. 103 (6). — P. 21021-21022.
6. Усенко Л.В. Летальность и заболеваемость, связанные с анестезией. Пути повышения ее безопасности / Л. В. Усенко // Біль, знеболювання і інтенсивна терапія. — 2011. — № 2. — С. 41-45.
7. The Use of Anti-Xa Assay to Monitor Intravenous Unfractionated Heparin Therapy / A.F. Rosenberg, M. Zumberg, L. Taylor, N. Harris // Journal of Pharmacy Practice. — 2010. — Vol. 23 (3). — P. 210-216.
8. Macintyre P.E. The scientific evidence for acute pain treatment / P.E. Macintyre, S.M. Walker // Curr. Opin. Anaesthesiol. — 2010. — Vol. 23 (5). — P. 623-628.
9. Chapman T.M. Bemiparin — a review of its use in the prevention of venous thromboembolism and treatment of deep vein thrombosis / T.M. Chapman, K.L. Goa // Drugs. — 2003. — Vol. 63 (21). — P. 2357-2377.
10. Perka C. Preoperative versus postoperative initiation of thromboprophylaxis following major orthopedic surgery: safety and efficacy of postoperative administration supported by recent trials of new oral anticoagulants // Thrombosis. — 2011. — 9. — 17.
11. Balibrea J.L., Altimiras J., Larruzea I., Gormes-Outes A., Martenez-Gonzalez J., Rocha E. Optimal dosing of bemiparin as prophylaxis against venous thromboembolism in surgery for cancer: An audit of practice // International Journal of Surgery. — 2007. — 5(2). — 114-9.
12. Raskob G.E., Hirch J. Controversies in timing of the first dose of anticoagulant prophylaxis against venous thromboembolism after major orthopaedic surgery // Chest. — 2003. — 124. — 379S-385S.
13. Prevention of VTE in Nonorthopedic Surgical Patients Antithrombotic Therapy and Prevention of Thrombosis, 9th ed.: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines / Gould M.K., Garcia D.A., Wren S.M., Karanicolas P.J., Arcelus J.I., Heit J.A., Samama C.M., FCCP // Chest. — 2012. — 141(2) (Suppl.). — e227S-e277S.
14. Bounameaux H., Perneger T. Fondaparinux: a new pentasaccharide for thrombosis prevention // Lancet. — 2002. — 359. — 1710-1711.
15. Eikelboom J.W., Quinlan D.J., Douketis J.D. Extended duration prophylaxis against venous thrombo–embolism after total hip or knee replacement; a meta-–analysis of the randomized trials // Lancet. — 2001. — 358. — 9-15.
16. Sobieraj D.M., Lee S., Сoleman C.I. et al. Prolonged versus standard-duration venous thromboprophylaxis in major orthopedic surgery // Ann. Intern. Med. — 2012. — Vol. 156. — P. 720-727.

/67.jpg)